山东省聊城市2021年普通高中学业水平等级考试模拟卷(二)化学试卷 扫描版含答案
文档属性
| 名称 | 山东省聊城市2021年普通高中学业水平等级考试模拟卷(二)化学试卷 扫描版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-24 00:00:00 | ||
图片预览



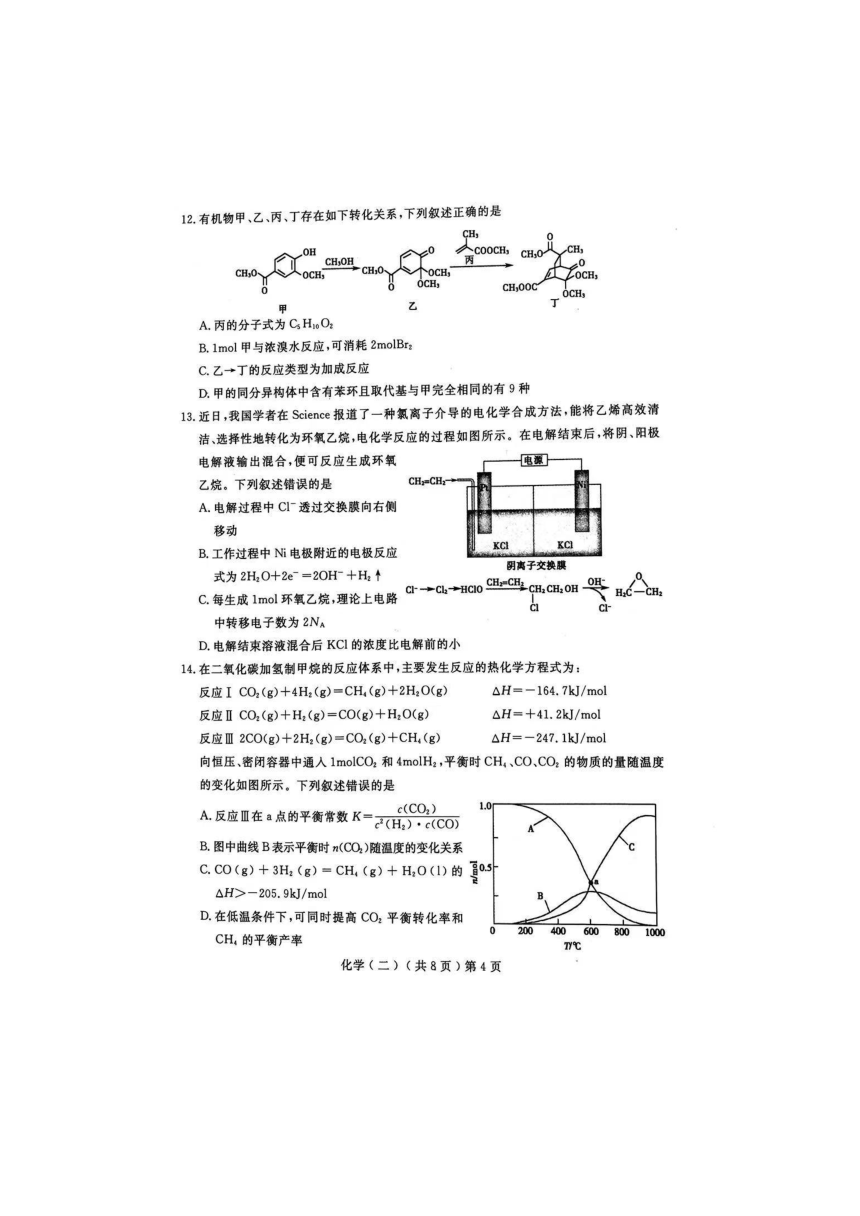

文档简介
15.常温时,某酸溶液中存在如下关系c(H2Y)+c(HY-)+c(Y2-)=0.1mol/L。
lgc(H2Y)、lgc(HY-)和lgc(Y2-)随pH变化的
关系如图所示。下列叙述错误的是
A.曲线③表示pH与lgc(Y2-)的变化关系
C反应HY+Y=2HY的化学平衡常数-o
B.K2(Na2Y)的数量级为102
11.444
,8
14
为K=1
681012
D.由a至b,溶液中水的电离程度先增大后减小
三、非选择题:本题共5小题,共60分
16.(11分)重铬酸钾(K2Cr2O1)是一种强氧化剂,在实验室和工业中都有很广泛的应用。某
实验小组以铬铁矿[主要成分为FeO·Cr2O3,还含有少量的MgCO3、Al2O3、SiO2等]为
原料,制备K2Cr2O7流程如下:
纯碱、硝酸钠
醋酸
醋酸Kcl
矿氯化每慢取过姆化过雄化2复分解过}→Ka9
铬「高温熔融
滤渣1
滤渣2
已知:①酸化1后的溶液中含有Na2CrO4、Na2CO3等。
②NaNO2具有还原性,当溶液酸性很强时易被强氧化剂氧化。
(1)高温氧化时发生多个反应,其中Al2O3和SiO2分别转化为
NaAlo2和
FeO·Cr2O3参与反应的产物中含有Fe2O3、NaNO2等,该反应化学方程式为
2)滤渣1的成分为
(3)为使溶液中铝元素尽可能生成沉淀而除去,则需调节溶液中A3+、AO2浓度均不超
过10-6mol/L。为达此目的酸化1溶液的pH范围是
已知:A(OH3()H+(aq)+AO(a)+H2O(l)K=1×10-1;K[A(OH)3]=1×103
(4)酸化2时,酸化的作用是
在酸化时溶液酸性不能太强的原因是
(5)称取K2Cr2O2样品2.40g,配成250mL溶液,取25.0mL于碘量瓶中,加入稀硫酸和足
量碘化钾,并放于暗处,约6mn后加入适量水和数滴淀粉指示剂,用0.24
mol/L
na2S2O3标
准溶液滴定至终点(杂质不参与反应),共用去Na2S2O3标准溶液20.00mL,所得样品中
K2Cr2O7的质量分数为
相关反应:|)Cr2O3+I+H+一Cr3++12+H2Oⅱ)I2+2S2O3=2I+S4O
17.(13分)金属陶瓷是一种复合材料兼有金属和陶瓷的优点应用非常广泛,金属基体可
为Co、Cr、Ni,陶瓷基体为碳化硅等。回答下列问题:
(1)Co位于元素周期表中第四周期
族,Cr与Ni的基态原子核外未成对电子数
之比为
(2)与C相比,Si原子之间难以形成双键的原因是
(3)已知CO2的一种晶体结构与SO2、SC相似,则该CO2晶体的熔点比SO2晶体的
(填“高”、“低”),原因是
化学(二)(共8页)第5页
lgc(H2Y)、lgc(HY-)和lgc(Y2-)随pH变化的
关系如图所示。下列叙述错误的是
A.曲线③表示pH与lgc(Y2-)的变化关系
C反应HY+Y=2HY的化学平衡常数-o
B.K2(Na2Y)的数量级为102
11.444
,8
14
为K=1
681012
D.由a至b,溶液中水的电离程度先增大后减小
三、非选择题:本题共5小题,共60分
16.(11分)重铬酸钾(K2Cr2O1)是一种强氧化剂,在实验室和工业中都有很广泛的应用。某
实验小组以铬铁矿[主要成分为FeO·Cr2O3,还含有少量的MgCO3、Al2O3、SiO2等]为
原料,制备K2Cr2O7流程如下:
纯碱、硝酸钠
醋酸
醋酸Kcl
矿氯化每慢取过姆化过雄化2复分解过}→Ka9
铬「高温熔融
滤渣1
滤渣2
已知:①酸化1后的溶液中含有Na2CrO4、Na2CO3等。
②NaNO2具有还原性,当溶液酸性很强时易被强氧化剂氧化。
(1)高温氧化时发生多个反应,其中Al2O3和SiO2分别转化为
NaAlo2和
FeO·Cr2O3参与反应的产物中含有Fe2O3、NaNO2等,该反应化学方程式为
2)滤渣1的成分为
(3)为使溶液中铝元素尽可能生成沉淀而除去,则需调节溶液中A3+、AO2浓度均不超
过10-6mol/L。为达此目的酸化1溶液的pH范围是
已知:A(OH3()H+(aq)+AO(a)+H2O(l)K=1×10-1;K[A(OH)3]=1×103
(4)酸化2时,酸化的作用是
在酸化时溶液酸性不能太强的原因是
(5)称取K2Cr2O2样品2.40g,配成250mL溶液,取25.0mL于碘量瓶中,加入稀硫酸和足
量碘化钾,并放于暗处,约6mn后加入适量水和数滴淀粉指示剂,用0.24
mol/L
na2S2O3标
准溶液滴定至终点(杂质不参与反应),共用去Na2S2O3标准溶液20.00mL,所得样品中
K2Cr2O7的质量分数为
相关反应:|)Cr2O3+I+H+一Cr3++12+H2Oⅱ)I2+2S2O3=2I+S4O
17.(13分)金属陶瓷是一种复合材料兼有金属和陶瓷的优点应用非常广泛,金属基体可
为Co、Cr、Ni,陶瓷基体为碳化硅等。回答下列问题:
(1)Co位于元素周期表中第四周期
族,Cr与Ni的基态原子核外未成对电子数
之比为
(2)与C相比,Si原子之间难以形成双键的原因是
(3)已知CO2的一种晶体结构与SO2、SC相似,则该CO2晶体的熔点比SO2晶体的
(填“高”、“低”),原因是
化学(二)(共8页)第5页
同课章节目录
