第十单元课题1常见的酸和碱 课件(35张ppt)
文档属性
| 名称 | 第十单元课题1常见的酸和碱 课件(35张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-25 00:00:00 | ||
图片预览










文档简介
第十单元 酸和碱
课题1 常见的酸和碱
课前准备
教学分析
1.认识几种常见的酸和碱,了解氢氧化钠和氢氧化钙。
学习目标
2.了解常见的酸碱指示剂——石蕊和酚酞。
3.掌握盐酸和硫酸的物理性质、化学性质、用途。
4.掌握浓硫酸的腐蚀性、吸水性以及浓硫酸稀释的正确操作。
5.了解酸碱溶液的导电性,认识酸碱的概念、结构特点和化学通性。
课前准备
教学分析
学习重点 盐酸和硫酸的物理性质、化学性质、用途;氢氧化钠和
氢氧化钙的俗名、化学性质。
学习难点 了解浓硫酸稀释的正确操作以及原因;认识不同的酸、
不同的碱具有相似的化学性质的原因。
课前准备
教学分析
学习方法 联系生活实际、认真观察思考、大胆动手探究、及时
对比概括。
学具准备 试管架、试管、试管夹、胶头滴管、烧杯、玻璃棒、
点滴板、长颈漏斗、玻璃片、稀盐酸、稀硫酸、溶液
的导电性测试仪、氢氧化钠、氢氧化钙、生石灰、石
灰石等。
教学内容
01
情景引入
02
互动新授
03
巩固扩展
04
课堂小结
点我喔
情景引入
一些水果有酸味,是因为水果中含有各种果酸。
情景引入
在生活中我们也接触过“碱” ,例如肥皂中有少量的氢氧化钠、抹墙的石灰浆中含有氢氧化钙等。
互动新授
(酸、碱与指示剂作用)
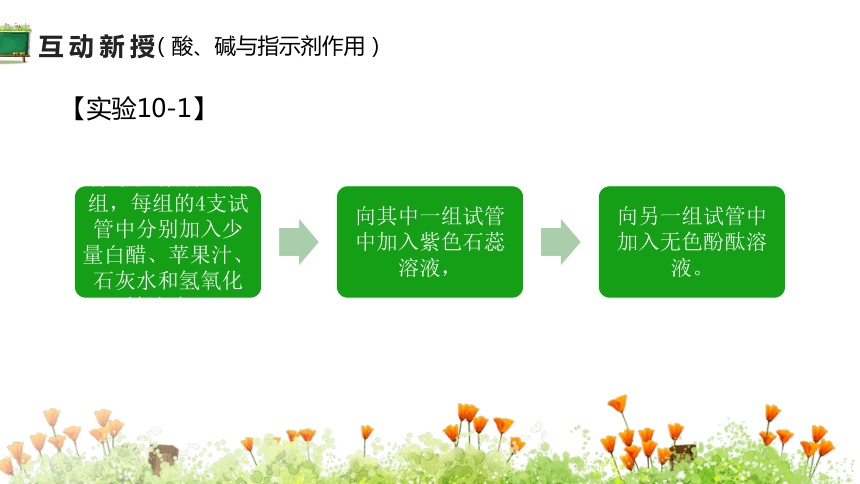
【实验10-1】
互动新授
(酸、碱与指示剂作用)
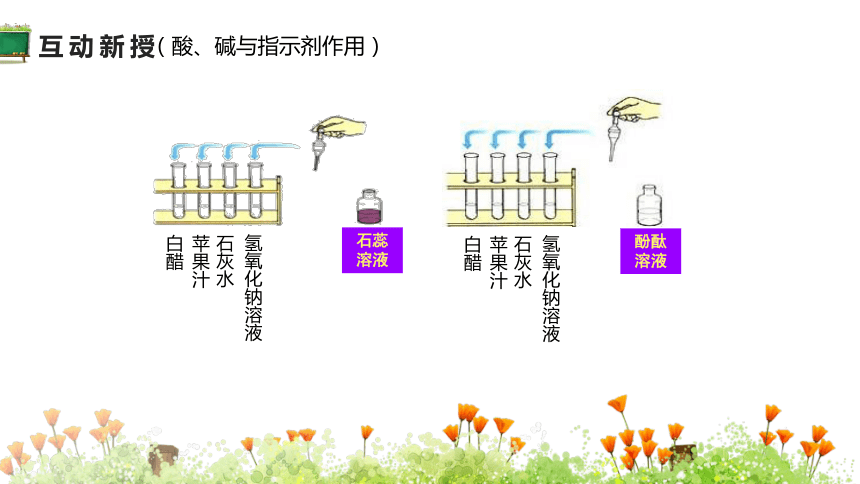
白醋
苹果汁
石灰水
氢氧化钠溶液
石蕊溶液
酚酞溶液
白醋
苹果汁
石灰水
氢氧化钠溶液
互动新授
(酸、碱与指示剂作用)
{0505E3EF-67EA-436B-97B2-0124C06EBD24}?
加入紫色石蕊溶液后的颜色变化
加入无色酚酞溶液后的颜色变化
白醋
红色
不变色(无色)
苹果汁
红色
不变色(无色)
石灰水
蓝色
红色
氢氧化钠溶液
蓝色
红色
石蕊遇酸变红、遇碱变蓝;酚酞遇酸不变色、遇碱变红。
互动新授
(酸、碱与指示剂作用)
互动新授
(几种常见的酸)
【实验10-2】
(1)观察盐酸、硫酸的颜色和状态。
(3)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
{C4B1156A-380E-4F78-BDF5-A606A8083BF9}?
盐酸(HCl)
硫酸(H2SO4)
颜色、状态
无色液体
无色、油状液体
打开试剂瓶盖后的现象
瓶口有白雾产生
瓶口没有明显现象
气味
有刺激性气味
有酸味
密度
常用浓盐酸(37%~38%)
1.19g/mL
常用浓硫酸(98%)
1.84g/mL
互动新授
(几种常见的酸)
盐酸、硫酸都属于酸,它们的用途非常广泛。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
用 途
盐酸
重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
硫酸
重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等
浓硫酸有吸水性,在实验室中常用它做干燥剂
互动新授
(几种常见的酸)
在实验室和化工生产中常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。另外,生活中常见的许多物质中也含有酸。
柠檬、柑橘等水果中含有柠檬酸
食醋中含有醋酸
汽车用铅酸蓄电池中含有硫酸
互动新授
(浓硫酸的腐蚀性)
【实验10-3】
将纸、小木棍、布放到玻璃片上做下列实验。
{0505E3EF-67EA-436B-97B2-0124C06EBD24}实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到小布条上
纸张用浓硫酸写过字的地方变成黑色
小木棍蘸有浓硫酸的地方变成黑色
小布条蘸有浓硫酸的地方变成黑色
浓硫酸具有强腐蚀性,能夺取纸张、木材、布料、皮肤等含有碳、氢、氧元素的化合物中的水分,生成黑色的炭。这种作用通常叫做脱水作用。
互动新授
【实验10-4】
将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,用玻璃棒不断搅拌,并用手轻轻触碰烧杯外壁。有什么感觉?
手感觉烫,说明浓硫酸溶于水放出大量的热。
能否将水倒入浓硫酸呢?
不能。水的密度较小,水会浮在浓硫酸上面,溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅。
(浓硫酸的腐蚀性)
互动新授
注意
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒入浓硫酸。
如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
(浓硫酸的腐蚀性)
互动新授
(酸的化学性质)
【探究】如右图所示,在白色点滴板上进
行实验,并观察现象。
紫色石蕊溶液
无色酚酞溶液
稀盐酸
稀硫酸
变红
变红
不变色(无色)
不变色(无色)
酸能使紫色石蕊溶液变红;不能使无色酚酞溶液变色。
互动新授
(酸的化学性质)
金属和酸反应的化学方程式
{5940675A-B579-460E-94D1-54222C63F5DA}
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
Mg+2HCl MgCl2+H2↑
Mg+H2SO4 MgSO4+H2↑
Zn+2HCl ZnCl2+H2↑
Zn+H2SO4 ZnSO4+H2↑
Fe+2HCl FeCl2+H2↑
Fe+H2SO4 FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
互动新授
(酸的化学性质)
反应物和生成物都有单质和化合物;只有金属活动性顺序中,排在(H)之前的活泼金属才能和稀酸发生置换反应,生成氢气。
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
互动新授
(酸的化学性质)
在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出铁钉,用水洗净,铁钉表面和溶液颜色有什么变化?
{5940675A-B579-460E-94D1-54222C63F5DA}
现象
反应的化学方程式
铁锈+稀盐酸
铁锈+稀硫酸
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁钉表面的锈脱落,无色溶液变成黄色(铁钉表面还有一些气泡产生)
互动新授
(酸的化学性质)
上述反应的生成物有什么共同之处?利用以上反应清除铁制品表面的锈,除锈时能否将铁制品长时间浸在酸中?为什么?
都有盐和水生成。像氯化铁、硫酸铁、等都是由金属离子和酸根离子构成的化合物,我们称之为盐;用稀酸除锈时,金属制品不能长时间浸泡在酸溶液中,因为当铁锈脱落被除去后,裸露出来的金属就会和稀酸反应,所以有些实验看到铁钉表面铁锈脱落后,还可以看到有气泡产生。
互动新授
(几种常见的碱)
【实验10-5】氢氧化钠
{FABFCF23-3B69-468F-B69F-88F6DE6A72F2}实验
现象
分析
观察氢氧化钠的颜色
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放入盛有少量水的试管里,并用手轻轻触碰试管外壁
白色、固体
表面有潮解现象
吸收了空气中的水分
迅速溶解、手触摸烧杯外壁,感觉有些热
氢氧化钠易溶于水,并放出热量
互动新授
(几种常见的碱)
{8A107856-5554-42FB-B03E-39F5DBC370BA}物质名称
化学式
俗名
物理性质
化学性质
用途
氢氧化钠
NaOH
苛性钠、火碱、
烧碱
白色固体、易溶于水
强烈的腐蚀性
可作某些气体的干燥剂;肥皂、造纸、
纺织等工业;在生活中除油污
互动新授
(几种常见的碱)
【实验10-5】氢氧化钙
互动新授
(几种常见的碱)
{5940675A-B579-460E-94D1-54222C63F5DA}
现象
颜色、状态
在水中的溶解情况
向澄清石灰水中通入CO2
白色、粉末状固体
微溶于水
澄清石灰水变浑浊
{22838BEF-8BB2-4498-84A7-C5851F593DF1}物质名称
化学式
俗名
物理性质
用途
由来
氢氧化钙
Ca(OH)2
熟石灰、消石灰
白色粉末、微溶于水
建筑材料、改良
酸性土壤
CaO+H2O= Ca(OH)2
互动新授
(碱的化学性质)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
加紫色石蕊溶液
加无色酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
(1)碱与指示剂作用 变色
变蓝
变红
变蓝
变红
互动新授
(碱的化学性质)
(2)碱+非金属氧化物 盐+水
Ca(OH)2+CO2 CaCO3↓+H2O
2NaOH+CO2 Na2CO3+H2O
2NaOH+SO3 Na2SO4+H2O
互动新授
(碱的化学性质)
【实验10-7】
盐酸
硫酸
氢氧化钠溶液
氢氧化钙溶液
蒸馏水
乙醇
互动新授
(碱的化学性质)
√
√
√
√
×
×
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质;碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
巩固扩展
例 废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是( )。
A.Mg和Al B.Cu和Ag C.Al和Cu D.Mg和Ag
B
巩固扩展
例 下列关于氢氧化钠的叙述中错误的是( )。
A.其水溶液能使石蕊溶液变红
B.能去除油污,可做厨房的清洁剂
C.固体氢氧化钠可用作二氧化碳气体的干燥剂
D.如果不慎将氢氧化钠溶液沾到皮肤上,要用较多的
水冲洗,再涂上硼酸溶液
C
巩固扩展
例 下列质量增加的变化有一种与其他三种存在着本质的区别,这种变化是( )。
A.长期放置在空气中的氢氧化钠质量增加
B.久置在潮湿空气中的铁钉质量增加
C.久置在空气中的生石灰质量增加
D.长期敞口放置的浓硫酸质量增加
D
课堂小结
1.酸碱指示剂:紫色石蕊溶液遇酸变红,遇碱变蓝;无色酚酞
溶液遇酸不变色,遇碱变红。
2.几种常见的酸——盐酸、硫酸的物理性质、化学性质和用途。
3.浓硫酸的性质:腐蚀性、脱水性和吸水性。
4.酸的化学性质:(1)能与指示剂作用;(2)能与活泼金属发生
置换反应;(3)能与金属氧化物反应。
课堂小结
5.氢氧化钠[NaOH]
6.氢氧化钙[Ca(OH)2]
7.碱的通性:不同的碱具有一些相似的化学性质。 (1)碱能与指示剂作用;(2)碱能与非金属氧化物反应生成盐和水。
8.酸碱溶液具有导电性:酸在水中都能解离出H+和酸根离子,碱在水中都能解离出金属离子和OH-。
课题1 常见的酸和碱
课前准备
教学分析
1.认识几种常见的酸和碱,了解氢氧化钠和氢氧化钙。
学习目标
2.了解常见的酸碱指示剂——石蕊和酚酞。
3.掌握盐酸和硫酸的物理性质、化学性质、用途。
4.掌握浓硫酸的腐蚀性、吸水性以及浓硫酸稀释的正确操作。
5.了解酸碱溶液的导电性,认识酸碱的概念、结构特点和化学通性。
课前准备
教学分析
学习重点 盐酸和硫酸的物理性质、化学性质、用途;氢氧化钠和
氢氧化钙的俗名、化学性质。
学习难点 了解浓硫酸稀释的正确操作以及原因;认识不同的酸、
不同的碱具有相似的化学性质的原因。
课前准备
教学分析
学习方法 联系生活实际、认真观察思考、大胆动手探究、及时
对比概括。
学具准备 试管架、试管、试管夹、胶头滴管、烧杯、玻璃棒、
点滴板、长颈漏斗、玻璃片、稀盐酸、稀硫酸、溶液
的导电性测试仪、氢氧化钠、氢氧化钙、生石灰、石
灰石等。
教学内容
01
情景引入
02
互动新授
03
巩固扩展
04
课堂小结
点我喔
情景引入
一些水果有酸味,是因为水果中含有各种果酸。
情景引入
在生活中我们也接触过“碱” ,例如肥皂中有少量的氢氧化钠、抹墙的石灰浆中含有氢氧化钙等。
互动新授
(酸、碱与指示剂作用)
【实验10-1】
互动新授
(酸、碱与指示剂作用)
白醋
苹果汁
石灰水
氢氧化钠溶液
石蕊溶液
酚酞溶液
白醋
苹果汁
石灰水
氢氧化钠溶液
互动新授
(酸、碱与指示剂作用)
{0505E3EF-67EA-436B-97B2-0124C06EBD24}?
加入紫色石蕊溶液后的颜色变化
加入无色酚酞溶液后的颜色变化
白醋
红色
不变色(无色)
苹果汁
红色
不变色(无色)
石灰水
蓝色
红色
氢氧化钠溶液
蓝色
红色
石蕊遇酸变红、遇碱变蓝;酚酞遇酸不变色、遇碱变红。
互动新授
(酸、碱与指示剂作用)
互动新授
(几种常见的酸)
【实验10-2】
(1)观察盐酸、硫酸的颜色和状态。
(3)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
{C4B1156A-380E-4F78-BDF5-A606A8083BF9}?
盐酸(HCl)
硫酸(H2SO4)
颜色、状态
无色液体
无色、油状液体
打开试剂瓶盖后的现象
瓶口有白雾产生
瓶口没有明显现象
气味
有刺激性气味
有酸味
密度
常用浓盐酸(37%~38%)
1.19g/mL
常用浓硫酸(98%)
1.84g/mL
互动新授
(几种常见的酸)
盐酸、硫酸都属于酸,它们的用途非常广泛。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
用 途
盐酸
重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
硫酸
重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等
浓硫酸有吸水性,在实验室中常用它做干燥剂
互动新授
(几种常见的酸)
在实验室和化工生产中常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。另外,生活中常见的许多物质中也含有酸。
柠檬、柑橘等水果中含有柠檬酸
食醋中含有醋酸
汽车用铅酸蓄电池中含有硫酸
互动新授
(浓硫酸的腐蚀性)
【实验10-3】
将纸、小木棍、布放到玻璃片上做下列实验。
{0505E3EF-67EA-436B-97B2-0124C06EBD24}实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到小布条上
纸张用浓硫酸写过字的地方变成黑色
小木棍蘸有浓硫酸的地方变成黑色
小布条蘸有浓硫酸的地方变成黑色
浓硫酸具有强腐蚀性,能夺取纸张、木材、布料、皮肤等含有碳、氢、氧元素的化合物中的水分,生成黑色的炭。这种作用通常叫做脱水作用。
互动新授
【实验10-4】
将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,用玻璃棒不断搅拌,并用手轻轻触碰烧杯外壁。有什么感觉?
手感觉烫,说明浓硫酸溶于水放出大量的热。
能否将水倒入浓硫酸呢?
不能。水的密度较小,水会浮在浓硫酸上面,溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅。
(浓硫酸的腐蚀性)
互动新授
注意
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒入浓硫酸。
如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
(浓硫酸的腐蚀性)
互动新授
(酸的化学性质)
【探究】如右图所示,在白色点滴板上进
行实验,并观察现象。
紫色石蕊溶液
无色酚酞溶液
稀盐酸
稀硫酸
变红
变红
不变色(无色)
不变色(无色)
酸能使紫色石蕊溶液变红;不能使无色酚酞溶液变色。
互动新授
(酸的化学性质)
金属和酸反应的化学方程式
{5940675A-B579-460E-94D1-54222C63F5DA}
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
Mg+2HCl MgCl2+H2↑
Mg+H2SO4 MgSO4+H2↑
Zn+2HCl ZnCl2+H2↑
Zn+H2SO4 ZnSO4+H2↑
Fe+2HCl FeCl2+H2↑
Fe+H2SO4 FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
互动新授
(酸的化学性质)
反应物和生成物都有单质和化合物;只有金属活动性顺序中,排在(H)之前的活泼金属才能和稀酸发生置换反应,生成氢气。
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
互动新授
(酸的化学性质)
在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出铁钉,用水洗净,铁钉表面和溶液颜色有什么变化?
{5940675A-B579-460E-94D1-54222C63F5DA}
现象
反应的化学方程式
铁锈+稀盐酸
铁锈+稀硫酸
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁钉表面的锈脱落,无色溶液变成黄色(铁钉表面还有一些气泡产生)
互动新授
(酸的化学性质)
上述反应的生成物有什么共同之处?利用以上反应清除铁制品表面的锈,除锈时能否将铁制品长时间浸在酸中?为什么?
都有盐和水生成。像氯化铁、硫酸铁、等都是由金属离子和酸根离子构成的化合物,我们称之为盐;用稀酸除锈时,金属制品不能长时间浸泡在酸溶液中,因为当铁锈脱落被除去后,裸露出来的金属就会和稀酸反应,所以有些实验看到铁钉表面铁锈脱落后,还可以看到有气泡产生。
互动新授
(几种常见的碱)
【实验10-5】氢氧化钠
{FABFCF23-3B69-468F-B69F-88F6DE6A72F2}实验
现象
分析
观察氢氧化钠的颜色
将氢氧化钠放在表面皿上,放置一会儿
将氢氧化钠放入盛有少量水的试管里,并用手轻轻触碰试管外壁
白色、固体
表面有潮解现象
吸收了空气中的水分
迅速溶解、手触摸烧杯外壁,感觉有些热
氢氧化钠易溶于水,并放出热量
互动新授
(几种常见的碱)
{8A107856-5554-42FB-B03E-39F5DBC370BA}物质名称
化学式
俗名
物理性质
化学性质
用途
氢氧化钠
NaOH
苛性钠、火碱、
烧碱
白色固体、易溶于水
强烈的腐蚀性
可作某些气体的干燥剂;肥皂、造纸、
纺织等工业;在生活中除油污
互动新授
(几种常见的碱)
【实验10-5】氢氧化钙
互动新授
(几种常见的碱)
{5940675A-B579-460E-94D1-54222C63F5DA}
现象
颜色、状态
在水中的溶解情况
向澄清石灰水中通入CO2
白色、粉末状固体
微溶于水
澄清石灰水变浑浊
{22838BEF-8BB2-4498-84A7-C5851F593DF1}物质名称
化学式
俗名
物理性质
用途
由来
氢氧化钙
Ca(OH)2
熟石灰、消石灰
白色粉末、微溶于水
建筑材料、改良
酸性土壤
CaO+H2O= Ca(OH)2
互动新授
(碱的化学性质)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
加紫色石蕊溶液
加无色酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
(1)碱与指示剂作用 变色
变蓝
变红
变蓝
变红
互动新授
(碱的化学性质)
(2)碱+非金属氧化物 盐+水
Ca(OH)2+CO2 CaCO3↓+H2O
2NaOH+CO2 Na2CO3+H2O
2NaOH+SO3 Na2SO4+H2O
互动新授
(碱的化学性质)
【实验10-7】
盐酸
硫酸
氢氧化钠溶液
氢氧化钙溶液
蒸馏水
乙醇
互动新授
(碱的化学性质)
√
√
√
√
×
×
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质;碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
巩固扩展
例 废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是( )。
A.Mg和Al B.Cu和Ag C.Al和Cu D.Mg和Ag
B
巩固扩展
例 下列关于氢氧化钠的叙述中错误的是( )。
A.其水溶液能使石蕊溶液变红
B.能去除油污,可做厨房的清洁剂
C.固体氢氧化钠可用作二氧化碳气体的干燥剂
D.如果不慎将氢氧化钠溶液沾到皮肤上,要用较多的
水冲洗,再涂上硼酸溶液
C
巩固扩展
例 下列质量增加的变化有一种与其他三种存在着本质的区别,这种变化是( )。
A.长期放置在空气中的氢氧化钠质量增加
B.久置在潮湿空气中的铁钉质量增加
C.久置在空气中的生石灰质量增加
D.长期敞口放置的浓硫酸质量增加
D
课堂小结
1.酸碱指示剂:紫色石蕊溶液遇酸变红,遇碱变蓝;无色酚酞
溶液遇酸不变色,遇碱变红。
2.几种常见的酸——盐酸、硫酸的物理性质、化学性质和用途。
3.浓硫酸的性质:腐蚀性、脱水性和吸水性。
4.酸的化学性质:(1)能与指示剂作用;(2)能与活泼金属发生
置换反应;(3)能与金属氧化物反应。
课堂小结
5.氢氧化钠[NaOH]
6.氢氧化钙[Ca(OH)2]
7.碱的通性:不同的碱具有一些相似的化学性质。 (1)碱能与指示剂作用;(2)碱能与非金属氧化物反应生成盐和水。
8.酸碱溶液具有导电性:酸在水中都能解离出H+和酸根离子,碱在水中都能解离出金属离子和OH-。
同课章节目录
