江苏省泗阳县新袁中学2012届九年级化学 原子的构成
文档属性
| 名称 | 江苏省泗阳县新袁中学2012届九年级化学 原子的构成 |
|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-03 00:00:00 | ||
图片预览



文档简介
(共19张PPT)
【课前练习】
1、物质是由___________________构成的。
2、保持物质化学性质的最小粒子是_____,
在化学变化中最小的粒子是______。
3、从微观角度分析,化学变化的实质是:
____________________________________。
分子、原子等微小粒子
分子
原子
分子分裂成原子,而原子重新组合成新的分子的过程
早在公元前5—4世纪,古代希腊哲学家留基伯爵
德谟克利特认为万物皆由大量不可分割的微小物质
粒子组成,这种粒子叫做原子,各原子没有质的区
别,只有形状、大小和位置的差异.
1803年,英国化学及物理学家道尔顿认为同一元
素的原子,性质和位置都相同,不同元素的原子性质
和质量都不同.
原子究竟能否再分?
【猜想】我想象中的原子结构是什么?
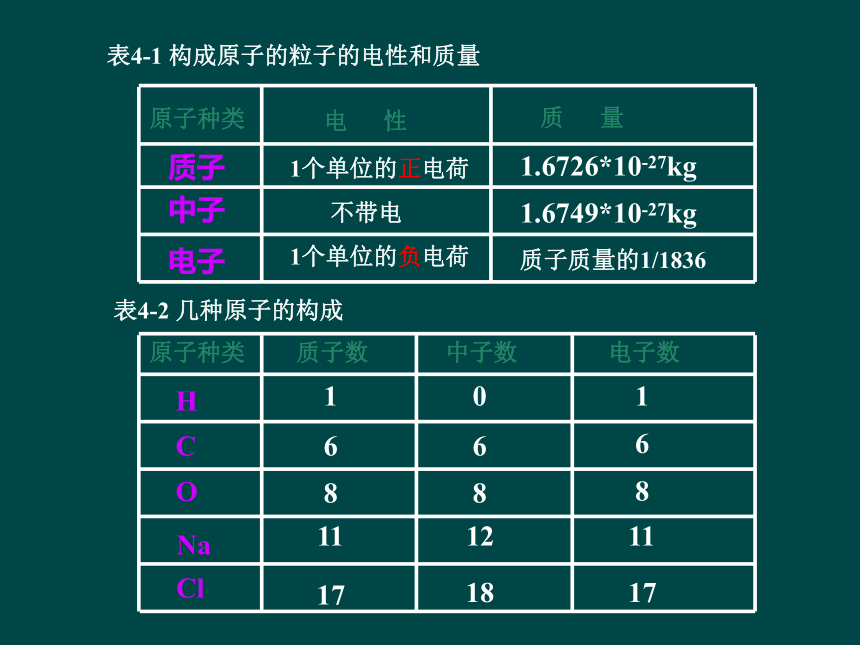
质子数
H
O
C
中子数
电子数
Na
原子种类
Cl
1
0
6
6
8
8
12
11
18
17
1
6
8
11
17
电 性
质子
电子
中子
质 量
原子种类
1个单位的正电荷
1个单位的负电荷
不带电
1.6726*10-27kg
1.6749*10-27kg
质子质量的1/1836
表4-1 构成原子的粒子的电性和质量
表4-2 几种原子的构成
原子
原子核
核外电子
质子
中子
电荷
+1
0
-1
质量
1.6726×10-27kg
1.6749×10-27kg
(1.6726×10-27) kg
1836
一、原子的构成
(带正电)
(带负电)
不显
电性
核电荷数(Z)
=质子数
= 核外电子数
(e-)
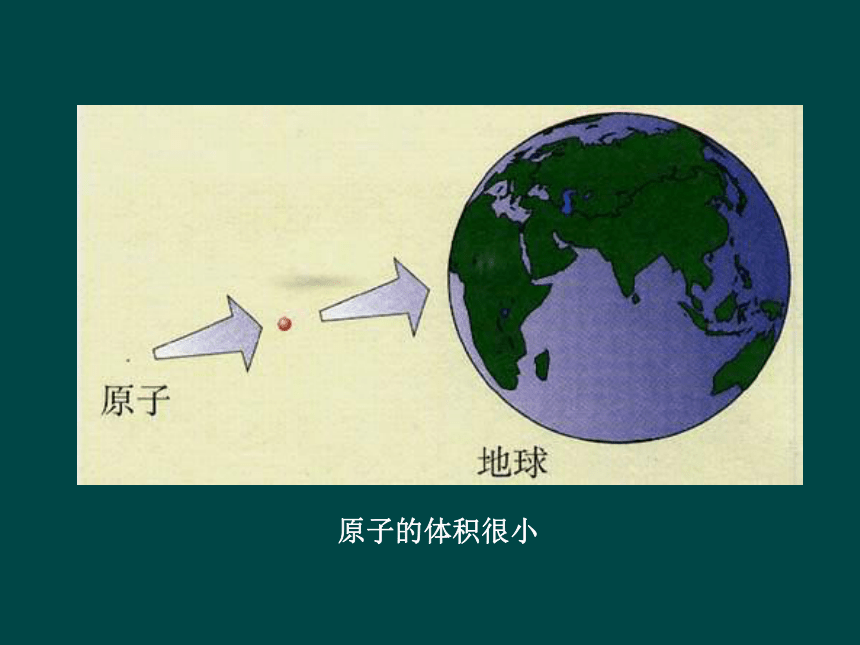
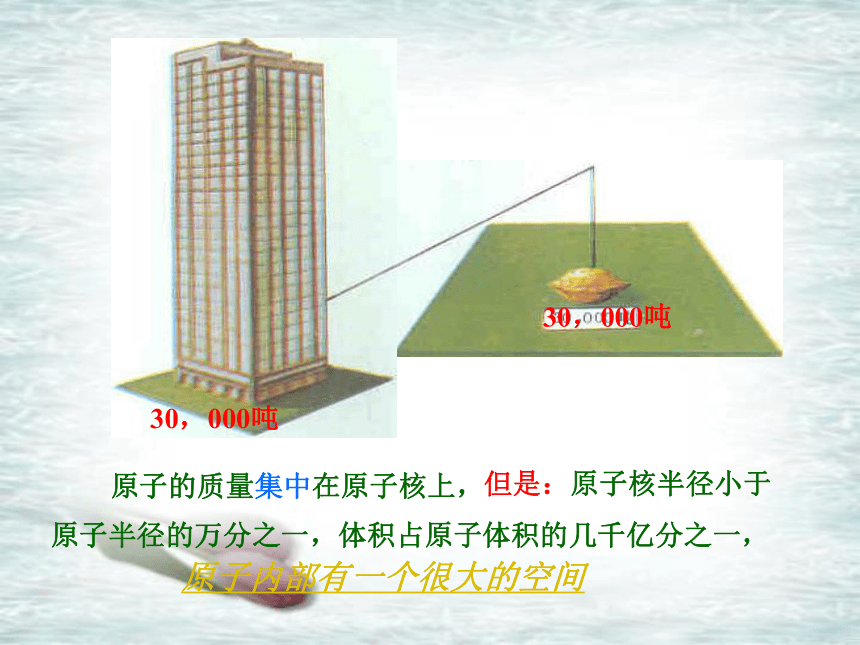
原子的体积很小
原子内部有一个很大的空间
原子的质量集中在原子核上,
30,000吨
30,000吨
但是:原子核半径小于
原子半径的万分之一,体积占原子体积的几千亿分之一,
课堂练习
质子数
H
O
C
中子数
电子数
Na
原子种类
Cl
N
Al
1
0
6
6
7
7
8
8
12
11
14
13
18
17
质子数
中子数
电子数
分子种类
H2
CO2
O2
H2O
CH4
H2O2
Al2O3
1
6
7
8
11
13
17
2
2
16
16
0
16
核电荷数(Z)
=质子数
= 核外电子数
10
8
10
张青莲(1908-- ) p69
资 料
经过测定知:
原子的数目
碳原子
质 量(kg)
原子种类
1个
1个
1.997*10-26
1.674*10-27
1个
2.657*10-26
氢原子
氧原子
钠原子
1个
3.826*10-26
二、相对原子质量
1、定义:
以一种碳原子质量的1/12为标准,其他原子的质量
跟它相比较所得的比值。
(Ar)
2、公式:
m(x)
m(碳)/12
Ar(x) ==
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Fe
元素名称
符号
相对原子质量
元素名称
符号
相对原子质量
元素名称
符号
相对原子质量
氢
氦
锂
氮
氧
氟
氖
1
4
12
14
16
19
20
钠
镁
铝
硅
铍
碳
硼
磷
硫
氯
氩
钾
钙
铁
7
9
10.8
23
24
27
28
31
32
35.5
40
39
40
56
资 料2
请阅读课本P153附录Ⅱ--相对原子质量表,请找出氮、氯、钠、铁的相对原子质量(保留4位有效数字)。
原子的发展历程
早在公元前5—4世纪,古代希腊哲学家留基伯爵
德谟克利特认为万物皆由大量不可分割的微小物质
粒子组成,这种粒子叫做原子,各原子没有质的区
别,只有形状、大小和位置的差异.
1803年,英国化学及物理学家道尔顿认为同一元
素的原子,性质和位置都相同,不同元素的原子性质
和质量都不同.
1897年,美国物理学家汤姆逊发现电子,认为原
子的模型为枣糕型,原子是一个平均分布着正电荷
的粒子,其中镶嵌着许多电子,中和了正电荷,从
而形成了中性原子
资 料
1909年至1911年,英国 物理学家卢瑟福和他的合作者通过α离子的散射实验证明了原子核带正电,提出了原子结构的核式结构学说。
即:在原子的中心有一个带正电荷的
核,它的质量几乎等于原子的全部质量,
电子在它的周围沿着不同的轨道运转,
就像行星环绕太阳运转一样。
卢瑟福原子模型
1932年,英国物理学家查德威克发现了原子核中有电中性的中子
道尔顿原子模型
汤姆生原子模型
卢瑟福原子模型
练 习
1、下列有关相对原子质量的说法正确的是:( )
A、相对原子质量就是原子的质量
B、相对原子质量是一个比值
C、相对原子质量都是一个整数
D、相对原子质量的单位是克
2、决定相对原子质量大小的主要粒子是 :( )
A、中子 B、质子
C、质子和中子 D、电子和质子
3、已知某原子的相对原子质量为a,一个碳原子的质量
为b,试求该原子的质量?
B
C
(ab/12)
【课前练习】
1、物质是由___________________构成的。
2、保持物质化学性质的最小粒子是_____,
在化学变化中最小的粒子是______。
3、从微观角度分析,化学变化的实质是:
____________________________________。
分子、原子等微小粒子
分子
原子
分子分裂成原子,而原子重新组合成新的分子的过程
早在公元前5—4世纪,古代希腊哲学家留基伯爵
德谟克利特认为万物皆由大量不可分割的微小物质
粒子组成,这种粒子叫做原子,各原子没有质的区
别,只有形状、大小和位置的差异.
1803年,英国化学及物理学家道尔顿认为同一元
素的原子,性质和位置都相同,不同元素的原子性质
和质量都不同.
原子究竟能否再分?
【猜想】我想象中的原子结构是什么?
质子数
H
O
C
中子数
电子数
Na
原子种类
Cl
1
0
6
6
8
8
12
11
18
17
1
6
8
11
17
电 性
质子
电子
中子
质 量
原子种类
1个单位的正电荷
1个单位的负电荷
不带电
1.6726*10-27kg
1.6749*10-27kg
质子质量的1/1836
表4-1 构成原子的粒子的电性和质量
表4-2 几种原子的构成
原子
原子核
核外电子
质子
中子
电荷
+1
0
-1
质量
1.6726×10-27kg
1.6749×10-27kg
(1.6726×10-27) kg
1836
一、原子的构成
(带正电)
(带负电)
不显
电性
核电荷数(Z)
=质子数
= 核外电子数
(e-)
原子的体积很小
原子内部有一个很大的空间
原子的质量集中在原子核上,
30,000吨
30,000吨
但是:原子核半径小于
原子半径的万分之一,体积占原子体积的几千亿分之一,
课堂练习
质子数
H
O
C
中子数
电子数
Na
原子种类
Cl
N
Al
1
0
6
6
7
7
8
8
12
11
14
13
18
17
质子数
中子数
电子数
分子种类
H2
CO2
O2
H2O
CH4
H2O2
Al2O3
1
6
7
8
11
13
17
2
2
16
16
0
16
核电荷数(Z)
=质子数
= 核外电子数
10
8
10
张青莲(1908-- ) p69
资 料
经过测定知:
原子的数目
碳原子
质 量(kg)
原子种类
1个
1个
1.997*10-26
1.674*10-27
1个
2.657*10-26
氢原子
氧原子
钠原子
1个
3.826*10-26
二、相对原子质量
1、定义:
以一种碳原子质量的1/12为标准,其他原子的质量
跟它相比较所得的比值。
(Ar)
2、公式:
m(x)
m(碳)/12
Ar(x) ==
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Fe
元素名称
符号
相对原子质量
元素名称
符号
相对原子质量
元素名称
符号
相对原子质量
氢
氦
锂
氮
氧
氟
氖
1
4
12
14
16
19
20
钠
镁
铝
硅
铍
碳
硼
磷
硫
氯
氩
钾
钙
铁
7
9
10.8
23
24
27
28
31
32
35.5
40
39
40
56
资 料2
请阅读课本P153附录Ⅱ--相对原子质量表,请找出氮、氯、钠、铁的相对原子质量(保留4位有效数字)。
原子的发展历程
早在公元前5—4世纪,古代希腊哲学家留基伯爵
德谟克利特认为万物皆由大量不可分割的微小物质
粒子组成,这种粒子叫做原子,各原子没有质的区
别,只有形状、大小和位置的差异.
1803年,英国化学及物理学家道尔顿认为同一元
素的原子,性质和位置都相同,不同元素的原子性质
和质量都不同.
1897年,美国物理学家汤姆逊发现电子,认为原
子的模型为枣糕型,原子是一个平均分布着正电荷
的粒子,其中镶嵌着许多电子,中和了正电荷,从
而形成了中性原子
资 料
1909年至1911年,英国 物理学家卢瑟福和他的合作者通过α离子的散射实验证明了原子核带正电,提出了原子结构的核式结构学说。
即:在原子的中心有一个带正电荷的
核,它的质量几乎等于原子的全部质量,
电子在它的周围沿着不同的轨道运转,
就像行星环绕太阳运转一样。
卢瑟福原子模型
1932年,英国物理学家查德威克发现了原子核中有电中性的中子
道尔顿原子模型
汤姆生原子模型
卢瑟福原子模型
练 习
1、下列有关相对原子质量的说法正确的是:( )
A、相对原子质量就是原子的质量
B、相对原子质量是一个比值
C、相对原子质量都是一个整数
D、相对原子质量的单位是克
2、决定相对原子质量大小的主要粒子是 :( )
A、中子 B、质子
C、质子和中子 D、电子和质子
3、已知某原子的相对原子质量为a,一个碳原子的质量
为b,试求该原子的质量?
B
C
(ab/12)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
