2021届高考化学三轮复习冲刺 有机化学实验 课件(63张ppt)
文档属性
| 名称 | 2021届高考化学三轮复习冲刺 有机化学实验 课件(63张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-25 00:00:00 | ||
图片预览





文档简介
(共66张PPT)
2021届高考化学三轮复习冲刺
有机实验
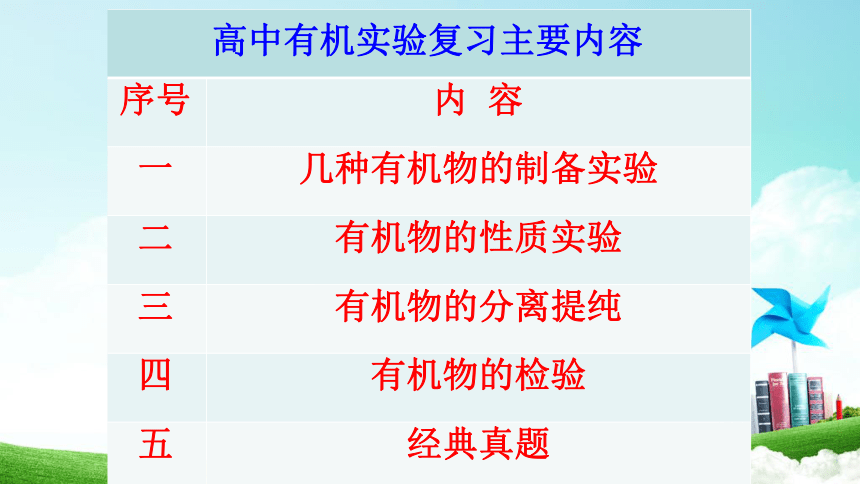
高中有机实验复习主要内容
序号
内
容
一
几种有机物的制备实验
二
有机物的性质实验
三
有机物的分离提纯
四
有机物的检验
五
经典真题
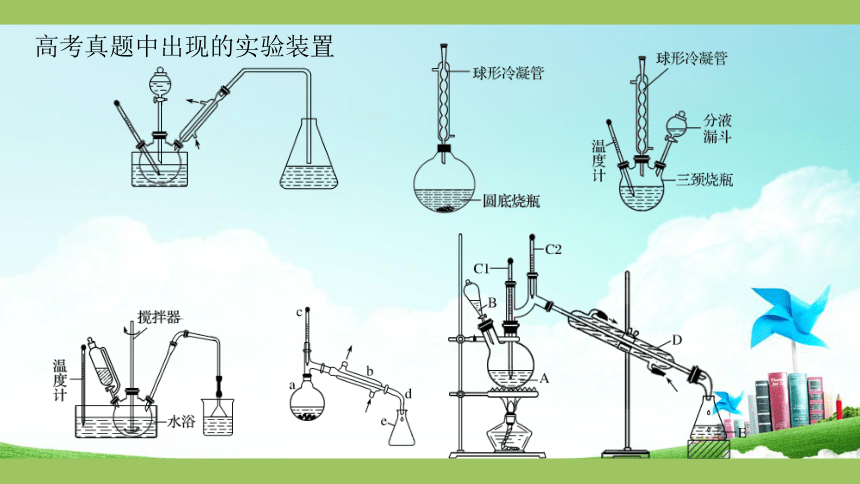
高考真题中出现的实验装置
浓H2SO4
2
2
2
2
2
CH
-CH
CH
=CH
↑+H
O
170℃
H
OH
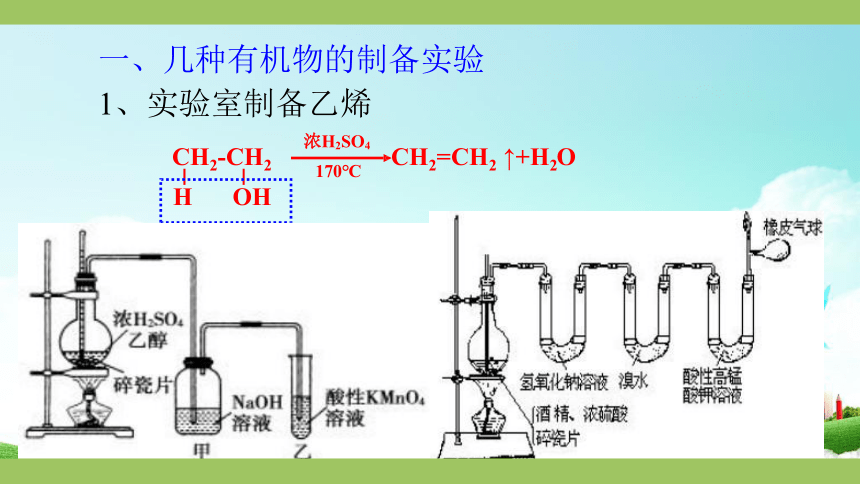
一、几种有机物的制备实验
1、实验室制备乙烯
7.浓硫酸作用
8.碎瓷片作用
注意事项:
催化剂和脱水剂
防暴沸(液液加热)
1.药品混合次序:浓硫酸加入到无水乙醇中(体积比为3:1),
2.现象:
反应液逐渐变黑、有刺激性气味
3.除杂:
气体中常混有杂质CO2、SO2、乙醚及乙醇,可通过碱溶液除去;
4.气体收集:常用排水法收集
5.温度计的位置:
水银球放在反应液中
6.为什么迅速升温到170℃
防止副产品乙醚在140℃生成
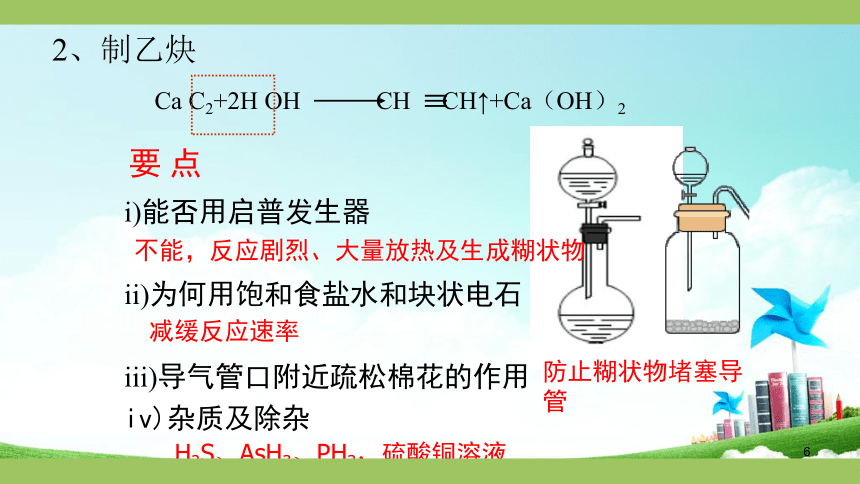
2、制乙炔
Ca
C2+2H
OH
CH
CH↑+Ca(OH)2
要
点
i)能否用启普发生器
ii)为何用饱和食盐水和块状电石
iii)导气管口附近疏松棉花的作用
iv)杂质及除杂
不能,反应剧烈、大量放热及生成糊状物
减缓反应速率
防止糊状物堵塞导管
H2S、AsH3、PH3,硫酸铜溶液
6
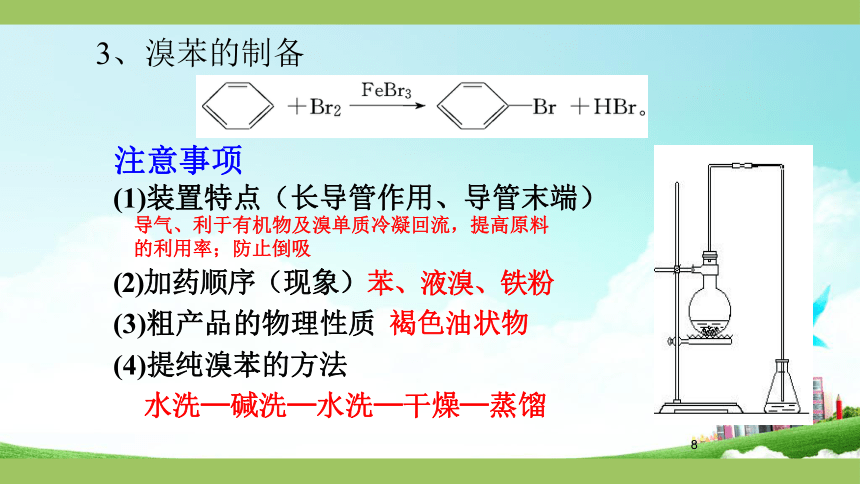
3、溴苯的制备
8
注意事项
(1)装置特点(长导管作用、导管末端)
导气、利于有机物及溴单质冷凝回流,提高原料
的利用率;防止倒吸
(2)加药顺序(现象)苯、液溴、铁粉
(3)粗产品的物理性质
褐色油状物
(4)提纯溴苯的方法
水洗—碱洗—水洗—干燥—蒸馏
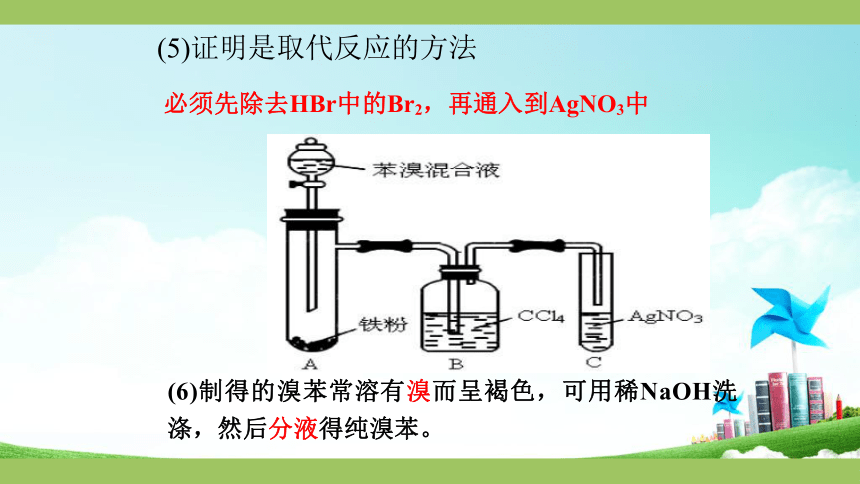
(5)证明是取代反应的方法
必须先除去HBr中的Br2,再通入到AgNO3中
(6)制得的溴苯常溶有溴而呈褐色,可用稀NaOH洗涤,然后分液得纯溴苯。
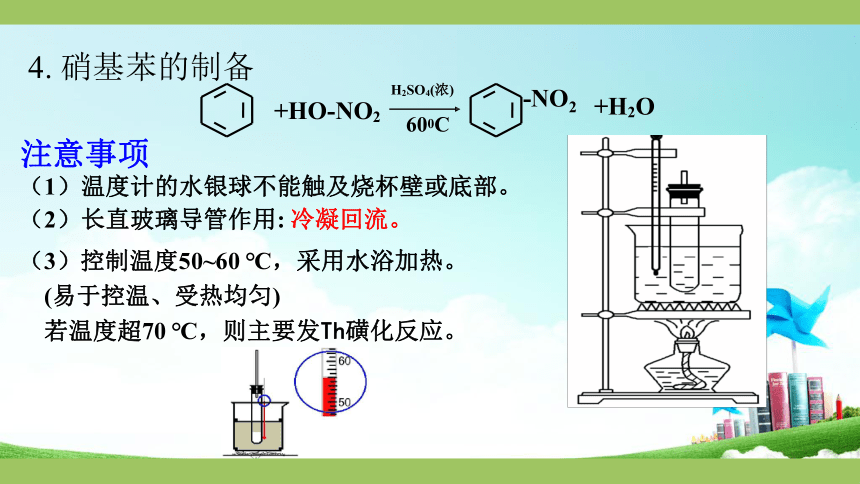
4.
硝基苯的制备
+HO-NO2
-NO
2
+H2O
H2SO4(浓)
600C
注意事项
(1)温度计的水银球不能触及烧杯壁或底部。
(2)长直玻璃导管作用:
冷凝回流。
(3)控制温度50~60
℃,采用水浴加热。
(易于控温、受热均匀)
若温度超70
℃,则主要发Th磺化反应。
(4)浓硫酸作用:
催化剂和吸水剂。
苯。
(5)将浓硫酸慢慢注入浓硝酸中,并不断振荡降温,冷却后再逐滴滴入苯,边滴边振荡。
(6)将反应液倒入盛水的烧杯中,底部有黄色油状物质。
(7)纯硝基苯为无色、具有苦杏仁气味的油状液体,
其
密度大于水,有毒。
(
8
)
简述粗产品获得纯硝基苯的实验操作:
依次用蒸馏水和氢氧化钠溶液洗涤(除去硝酸和硫酸),再用蒸馏水洗涤(除去氢氧化钠溶液及与其反应生成的盐),然后用无水氯化钙干燥,最后进行蒸馏(除去苯)可得纯净的硝基
水洗—碱洗—水洗—干燥—蒸馏
5、乙酸乙酯的制备
CH3
CO
OH
+H
OCH2CH3
3
2
3
2
CH
COOCH
CH
+H
O
△
浓H
SO
2
4
酯化反应是一个可逆反应,酯化反应的酸可以是有机羧酸或者是无机含氧酸。
注意事项
1.加入药品的次序:
保证乙醇加在浓硫酸之前
课本叙述:先加入乙醇,然后边振荡试管缓慢
7.试管A加热的目的:a.
加入浓硫酸和乙酸
2.气体出口处导管的位置:
在饱和碳酸钠溶液液面上
3.加碎瓷片作用:
防暴沸
4.饱和碳酸钠溶液作用:
吸收乙醇,中和乙酸,降低乙
酸乙酯的溶解度。便于分层析出。
5.浓硫酸作用:
催化剂和吸水剂
6.长弯导管作用:导气、冷凝
加快反应速率
b.
促进乙酸乙酯的
挥发,使平衡正向移动,提高产率
含有杂质的物质
所用试剂
分离方法
乙酸乙酯(乙酸)
溴乙烷(乙醇)
乙烷(乙烯)
乙醇(NaCl)
苯(苯酚)
溴苯(溴)
乙醇(水)
甲苯(乙醇)
苯(乙醛)
乙醇(苯酚)
实例总结1:
物质的分离提纯:
饱和Na2CO3
溶液
分液
蒸馏水
分液
溴水
洗气
蒸馏
NaOH溶液
分液
NaOH溶液
分液
CaO
蒸馏
蒸馏水
分液
蒸馏水
分液
NaOH溶液
蒸馏
含有杂质的物质
所用试剂
分离方法
乙
烯(SO2、CO2)
乙炔(H2S、PH3)
溴化钠溶液(碘化钠)
乙醇(乙酸)
乙酸(乙醇)
溴苯(溴、苯、溴化铁)
溴乙烷(溴)
硝基苯(苯、酸)
提纯苯甲酸
提纯蛋白质
实例总结2:
物质的分离提纯:
NaOH溶液
洗气
蒸馏水
、
NaOH溶液
洗涤-分液-蒸馏
溴的四氯化碳溶液
洗涤—萃取分液
NaOH溶液或碳酸钠溶液等
蒸馏
NaOH溶液
、硫酸
蒸发——蒸馏
蒸馏水、NaOH溶液
洗涤-分液-蒸馏
NaHSO3溶液
洗涤—分液
硫酸铜溶液
洗气
蒸馏水
重结晶
蒸馏水、浓轻金属盐
盐析/渗析
1.(2020·大庆高三质检)下列有机实验的说法正确的是
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口
倒出有机层
B.因为乙烯具有还原性,所以乙烯通入到溴水中能使溴水褪色
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分
吸收乙酸和乙醇
D.充满CH4和Cl2的试管倒置在饱和食盐水溶液之上,光照充分反应后,
液体会充满试管
√
解析 苯的密度小于水,用苯萃取溴水中的Br2,分层后苯层在上面,水层在下面,所以分液时先从分液漏斗下口放出水层,再从上口倒出有机层,A项正确;
乙烯分子中含有碳碳双键,能与溴水发生加成反应生成1,2-二溴乙烷,使溴水褪色,并非因为还原性,B项错误;
乙酸乙酯制备实验中,不能将导管插入饱和碳酸钠溶液液面以下,易引起倒吸现象,C项错误;
CH4和Cl2在光照条件下发生取代反应,生成CH3Cl气体、HCl气体、CH2Cl2液体、CHCl3液体、CCl4液体,其中HCl气体极易溶于水,试管倒置在饱和食盐水之上,液体不断上升,但不会充满试管,D项错误。
2.(2020·南昌高三联考)加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
√
解析 A项,装置乙试管中收集到的液体物质是苯和甲苯,两种物质的分子中都含有苯环,在催化剂存在下可以与Br2发生取代反应,正确;
B项,加热聚丙烯废塑料得到的不饱和烃乙烯、丙烯可以与Br2发生加成反应,产生1,2-二溴乙烷和1,2-二溴丙烷,它们都是液体物质,难溶于水,密度比水大,正确;
C项,加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,气体物质有氢气、甲烷、乙烯、丙烯,液体物质有苯和甲苯,其中苯和甲苯经冷水降温留在小试管中;气体中乙烯、丙烯与溴的四氯化碳溶液反应变为液体,剩余气体为氢气、甲烷,燃烧产生H2O、CO2,无污染,因此可作为清洁燃料使用,正确;
D项,甲烷是正四面体结构,分子中只有一种H原子,其二氯代物只有1种,错误。
3.(2020·福建省龙岩市高中质检)已知:①
+HNO3
+H2O ΔH<0;②硝基苯沸点210.9
℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
√
解析 浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能会导致液体迸溅,故A错误;
反应在50~60
℃下进行,低于水的沸点,因此可以利用水浴加热控制,这样可使反应容器受热均匀,便于控制温度,但图中水浴的水的用量太少,反应液受热不均匀,故B错误;
硝基苯为油状液体,不溶于水且密度比水大,在下层,分液操作时应将分液漏斗上口的瓶塞打开,下端紧贴烧杯内壁,下层的液体从下口放出,故C正确;
蒸馏分离提纯操作中温度计用来测量蒸汽的温度,控制蒸馏出的物质的温度,温度计水银球应在烧瓶的支管口处,故D错误。
4.(2020·陕西省宜川中学高三月考)实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是
A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.酸性KMnO4溶液若倒吸可加快褪色速率
D.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
√
解析 依据石油分馏工业的分馏塔原理,设置了长导管,其作用除导气外,兼起冷凝气体的作用,故A正确;
装置Ⅱ中冷水的作用是冷凝收集裂化油,故B正确;
因为装置Ⅱ中有不饱和烃生成,所以酸性KMnO4溶液若倒吸可加快褪色速率,故C正确;
根据裂化的反应原理,试管Ⅲ中溶液颜色变浅甚至褪色可说明发生了氧化还原反应,有常温下呈气态含碳原子数小于5的不饱和烃生成,不一定是乙烯,故D错误。
实验热点:有机实验
解题流程
分析制
备流程
熟悉重
要仪器
特殊实验
装置分析
①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。
②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。
③若制备物质易被空气中氧气氧化,应加排空气装置。
依据反应
特点作答
加热操作:①使用可燃性气体(如:H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。
②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。
有机制备:①有机物易挥发,反应中通常采用冷凝回流装置,以提高原料的利用率和产物的产率。
②在实验中需要控制反应条件,以减少副反应的发生。
③根据产品与杂质的性质特点,选择合适的分离提纯方法。
“有机物制备”评价型
(2020·全国卷Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称
相对分子质量
熔点/℃
沸点/℃
密度/
(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100
℃左右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g(约0.03
mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0
g。
(3)纯度测定:称取0.122
g粗产品,配成乙醇溶液,于100
mL容量瓶中定容。每次移取25.00
mL溶液,用0.010
00
mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50
mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为____(填标号)。
A.100
mL
B.250
mL
C.500
mL
D.1
000
mL
B
解析 该反应需要向三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g高锰酸钾,所以三颈烧瓶的最适宜规格为250
mL。
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是_________________
_______________________。
球形
无油珠说明不溶于
水的甲苯已经被完全氧化
解析 反应中应选用球形冷凝管,球形冷凝管散热面积大,冷凝效果好;回流液中不再出现油珠,说明不溶于水的甲苯(油状液体)已经被KMnO4完全氧化。
(3)加入适量饱和亚硫酸氢钠溶液的目的是__________________________
_______________________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理_____________________________________
_______________。
除去过量的高锰酸钾,避免在
用盐酸酸化时,产生氯气
+5H2C2O4+6H+===2Mn2++
10CO2↑+8H2O
解析 加入适量饱和亚硫酸氢钠溶液的目的:NaHSO3与KMnO4(H+)发生氧化还原反应除去过量的KMnO4(H+),防止用盐酸酸化时,KMnO4把盐酸中的Cl-氧化为Cl2;该过程也可用草酸在酸性条件下与KMnO4反应除去KMnO4,反应的离子方程式为
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是______。
MnO2
解析 用少量热水洗涤滤渣的目的是使生成的
尽可能溶于水,
故滤渣的主要成分是KMnO4在中性条件下的还原产物MnO2。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是________________。
苯甲酸升华而损失
解析 苯甲酸在100
℃左右开始升华,干燥苯甲酸晶体时,若温度过高,苯甲酸易升华而损失。
(6)本实验制备的苯甲酸的纯度为________;据此估算本实验中苯甲酸的产率最接近于____(填标号)。
A.70%
B.60%
C.50%
D.40%
86.0%
C
解析 根据反应
可知,
n(KOH)=0.010
00
mol·L-1×21.50×10-3
L×4,m(
)=
在理论上,1
mol甲苯反应后生成1
mol苯甲酸,则:
1.5
mL×0.867
g·mL-1
m
苯甲酸的理论产量m≈1.72
g
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
重结晶
解析 根据苯甲酸的水溶性可知,若要得到纯度更高的苯甲酸,需要利用重结晶的方法进行提纯。
三、有机物的分离提纯
1.
有机物分离提纯的方法
蒸馏(分馏)法、萃取法、(洗涤)分液法、过滤、洗气法、渗析、
盐析、
重结晶法
有机物提纯的三种常用方法:
蒸馏(分馏)法、(洗涤)分液法、
洗气法、
(1)洗气法
使用范围:用于除去气体中的某些杂质气体,洗涤剂必须只能吸收杂质气体
除去甲烷中的乙烯、乙炔(溴水)
除去乙烯中的SO2、CO2(NaOH溶液)除去乙炔中的H2S、PH3(CuSO4溶液)
(2)(洗涤)分液法
除去硝基苯中的残酸(NaOH溶液)除去溴苯中的溴(NaOH溶液)
除去乙酸乙酯中的乙酸
—(饱和碳酸钠溶液)除去苯中的苯酚(NaOH溶液)
除去苯中的甲苯(酸性高锰酸钾溶液)
除去苯酚中的苯甲酸(NaOH溶液通CO2)
用于除去某些液体中的杂质(有时分液前要加
入某种试剂使之
)
提纯硝基苯、由工业酒精制无水乙醇从乙酸和乙醇的混合液中分离出乙醇石油的分馏。
(3)蒸馏(分馏)
利用沸点的不同对互溶的两种液体的提纯或分离,蒸馏前,有时需加入某种试剂使混合物中的一成分转化成难挥发的物质。
(4)盐析和渗析
盐析:除去肥皂中的甘油和过量碱
渗析:除去淀粉中的少量葡萄糖或者NaCl
1、有机物鉴别常用的方法
(1)有机物的溶解性和密度
①易溶于水:低级醇、醛、羧酸、有机钠盐、乙二醇、丙三醇;
且同系物随碳原子数目增加,溶解性降低;含-OH
-COOH、-CHO数目越多,越易溶于水。
②难溶于水,比水轻:烃、一氯(氟)代物、酯;
③难溶于水,比水重:
大多数卤代烃(溴苯,四氯化碳,溴乙烷等)、硝基苯
。
四、有机物的检验
(2)有机物的燃烧情况
①
是否可燃:大部分有机物可燃,除CCl4
②燃烧时产生黑烟:
如:区分乙烷、乙烯和乙炔
③
燃烧气味:
如:区分蛋白质和纤维素
(3)根据有机物官能团性质
水、溴水、KMnO4、新制Cu(OH)2、银氨溶液、NaOH、NaHCO3、碘水、浓硝酸、Fe3+
常用的检验试剂
2、几种重要有机物的检验
有机物质
使用试剂
现象
烯烃(炔烃)
溴水或酸性高锰酸钾
褪色
苯的同系物
(甲苯)
溴水和酸性高锰酸钾
溴水不褪色
酸性高锰酸钾褪色
醇
铜丝
铜丝由黑变红
酚
浓溴水或氯化铁溶液
产生白色沉淀或溶液变紫色
有机物质
使用试剂
现象
醛
银氨溶液或
新制Cu(OH)2
光亮银镜或红色沉淀
乙酸(羧酸)
紫色石蕊试液或NaHCO3
变红或产生气泡
乙酸乙酯
水;酚酞和氢氧化钠
加热一段时间红色变浅
葡萄糖
新制Cu(OH)2
红色沉淀
蛋白质
浓硝酸
变黄
淀粉
碘水
溶液变蓝
1)步骤(含试剂):
(1)取少量卤代烃(溴乙烷),
(2)加氢氧化钠溶液,
(3)充分振荡或加热,
(4)冷却
,
(6)加硝酸银溶液,
2)现象:若产生白色(淡黄色、黄色)沉淀。3)结论:有-Cl、(-Br、-I)。
3、卤代烃中卤素原子的检验:
4、烯醛中碳碳双键的检验:
(1)若是纯净的液态样品(无水):
取样—加入溴的四氯化碳溶液—若褪色即可证明
(2)若是水溶液:
取样—加入足量的银氨溶液或新制氢氧化铜悬浊液,加热—
冷却(过滤)—加入硝酸酸化,再加入溴水—若褪色即可证明
5、二糖或多糖水解产物的检验:
—若二糖或多糖是在稀硫酸作用下水解
检验方法:
取样,加稀硫酸加热一定时间—向水解液中加入足量NaOH溶液中和至碱性—再加入银氨溶液或新制氢氧化铜悬浊液,加热,观察现象
6、溶解在苯中的苯酚的检验:
检验方法:
取样,向试样中加入NaOH溶液—振荡,静置分液—向水溶液中加入盐酸酸化,再滴入几滴氯化铁溶液(饱和溴水)—
若溶液呈紫色(产生白色沉淀)即可证明。
1.(2020·陕西省渭南中学高三模拟)锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点:144.5
℃,沸点:364.5
℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2
SnI4制备SnI4。
下列说法错误的是
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
√
解析 SnI4易水解,装置Ⅱ的主要作用是防止空气中的水蒸气进入到反应装置中,故A错误;
根据相似相溶原理,SnI4是非极性分子,可溶于CCl4中,故B正确;
冷凝水方向是“下进上出”,因此装置Ⅰ中a为冷凝水进水口,故C正确;
液体加热时易暴沸,因此需要加入碎瓷片,故D正确。
2.对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点:156.2
℃)、Br2和苯(沸点:80
℃)]进行纯化,未涉及的装置是
√
解析 除去Br2可以用SO2,原理是:Br2+SO2+2H2O===H2SO4+2HBr,故A正确;
分液可得苯和溴苯的混合液,故B正确;
该实验不涉及过滤操作,故C错误;
溴苯的沸点是156.2
℃、苯的沸点是80
℃,溴苯和苯用蒸馏法分离,故D正确。
3.在提纯粗苯甲酸(C6H5—COOH,常温下为晶体)过程中,下列操作未涉及的是
√
解析 提纯粗苯甲酸(C6H5—COOH,常温下为晶体)的步骤为:①将粗苯甲酸充分溶解于少量热水中,用到C装置;
②将溶液蒸发浓缩得到苯甲酸的饱和溶液,用到装置D;然后趁热过滤,除去不溶性杂质,用到B装置;
③滤液冷却结晶,滤出晶体;
④洗涤晶体。并未涉及A操作,因此选A。
4.下列实验室制取乙烯、除杂质、性质检验、收集的装置和原理正确的是
√
解析 温度计没有插入液面下,故A错误;
实验室制取乙烯时会产生杂质乙醇、SO2、CO2和H2O,SO2、乙醇和乙烯均可以使酸性高锰酸钾溶液褪色,故B错误;
乙烯能使溴的四氯化碳溶液褪色,故C正确;
乙烯的密度和空气相近,不能用排空气法收集,故D错误。
5.下列实验装置图正确的是
√
解析 乙烯密度稍小于空气,应该采用向下排空气法收集,但因为乙烯不易溶于水且乙烯密度接近空气密度,最好采用排水法收集,故A错误;
分馏时,温度计测量馏分温度,水银球应该位于蒸馏烧瓶支管口处,且进、出水口错误,故B错误;
实验室用苯和浓硝酸在浓硫酸作催化剂、加热50~60
℃制备硝基苯,该实验操作正确,故C正确;
实验室制取乙酸乙酯时,导气管不能伸入饱和碳酸钠溶液中,否则易产生倒吸现象,故D错误。
(2020·课标全国Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称
相对分子质量
熔点/℃
沸点/℃
密度/(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100
℃左右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
五、经典真题
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g(约0.03
mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0
g。
(3)纯度测定:称取0.122
g粗产品,配成乙醇溶液,于100
mL容量瓶中定容。每次移取25.00
mL溶液,用0.010
00
mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50
mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为________(填字母)。
A.100
mL
B.250
mL
C.500
mL
D.1
000
mL
(2)在反应装置中应选用________冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是________________________。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________________________
_________________________________________________;
该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理
_________________________________________________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是________。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
_________________________________________________。
(6)本实验制备的苯甲酸的纯度为________;据此估算本实验中苯甲酸的产率最接近于________(填字母)。
A.70%
B.60%
C.50%
D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
2021届高考化学三轮复习冲刺
有机实验
高中有机实验复习主要内容
序号
内
容
一
几种有机物的制备实验
二
有机物的性质实验
三
有机物的分离提纯
四
有机物的检验
五
经典真题
高考真题中出现的实验装置
浓H2SO4
2
2
2
2
2
CH
-CH
CH
=CH
↑+H
O
170℃
H
OH
一、几种有机物的制备实验
1、实验室制备乙烯
7.浓硫酸作用
8.碎瓷片作用
注意事项:
催化剂和脱水剂
防暴沸(液液加热)
1.药品混合次序:浓硫酸加入到无水乙醇中(体积比为3:1),
2.现象:
反应液逐渐变黑、有刺激性气味
3.除杂:
气体中常混有杂质CO2、SO2、乙醚及乙醇,可通过碱溶液除去;
4.气体收集:常用排水法收集
5.温度计的位置:
水银球放在反应液中
6.为什么迅速升温到170℃
防止副产品乙醚在140℃生成
2、制乙炔
Ca
C2+2H
OH
CH
CH↑+Ca(OH)2
要
点
i)能否用启普发生器
ii)为何用饱和食盐水和块状电石
iii)导气管口附近疏松棉花的作用
iv)杂质及除杂
不能,反应剧烈、大量放热及生成糊状物
减缓反应速率
防止糊状物堵塞导管
H2S、AsH3、PH3,硫酸铜溶液
6
3、溴苯的制备
8
注意事项
(1)装置特点(长导管作用、导管末端)
导气、利于有机物及溴单质冷凝回流,提高原料
的利用率;防止倒吸
(2)加药顺序(现象)苯、液溴、铁粉
(3)粗产品的物理性质
褐色油状物
(4)提纯溴苯的方法
水洗—碱洗—水洗—干燥—蒸馏
(5)证明是取代反应的方法
必须先除去HBr中的Br2,再通入到AgNO3中
(6)制得的溴苯常溶有溴而呈褐色,可用稀NaOH洗涤,然后分液得纯溴苯。
4.
硝基苯的制备
+HO-NO2
-NO
2
+H2O
H2SO4(浓)
600C
注意事项
(1)温度计的水银球不能触及烧杯壁或底部。
(2)长直玻璃导管作用:
冷凝回流。
(3)控制温度50~60
℃,采用水浴加热。
(易于控温、受热均匀)
若温度超70
℃,则主要发Th磺化反应。
(4)浓硫酸作用:
催化剂和吸水剂。
苯。
(5)将浓硫酸慢慢注入浓硝酸中,并不断振荡降温,冷却后再逐滴滴入苯,边滴边振荡。
(6)将反应液倒入盛水的烧杯中,底部有黄色油状物质。
(7)纯硝基苯为无色、具有苦杏仁气味的油状液体,
其
密度大于水,有毒。
(
8
)
简述粗产品获得纯硝基苯的实验操作:
依次用蒸馏水和氢氧化钠溶液洗涤(除去硝酸和硫酸),再用蒸馏水洗涤(除去氢氧化钠溶液及与其反应生成的盐),然后用无水氯化钙干燥,最后进行蒸馏(除去苯)可得纯净的硝基
水洗—碱洗—水洗—干燥—蒸馏
5、乙酸乙酯的制备
CH3
CO
OH
+H
OCH2CH3
3
2
3
2
CH
COOCH
CH
+H
O
△
浓H
SO
2
4
酯化反应是一个可逆反应,酯化反应的酸可以是有机羧酸或者是无机含氧酸。
注意事项
1.加入药品的次序:
保证乙醇加在浓硫酸之前
课本叙述:先加入乙醇,然后边振荡试管缓慢
7.试管A加热的目的:a.
加入浓硫酸和乙酸
2.气体出口处导管的位置:
在饱和碳酸钠溶液液面上
3.加碎瓷片作用:
防暴沸
4.饱和碳酸钠溶液作用:
吸收乙醇,中和乙酸,降低乙
酸乙酯的溶解度。便于分层析出。
5.浓硫酸作用:
催化剂和吸水剂
6.长弯导管作用:导气、冷凝
加快反应速率
b.
促进乙酸乙酯的
挥发,使平衡正向移动,提高产率
含有杂质的物质
所用试剂
分离方法
乙酸乙酯(乙酸)
溴乙烷(乙醇)
乙烷(乙烯)
乙醇(NaCl)
苯(苯酚)
溴苯(溴)
乙醇(水)
甲苯(乙醇)
苯(乙醛)
乙醇(苯酚)
实例总结1:
物质的分离提纯:
饱和Na2CO3
溶液
分液
蒸馏水
分液
溴水
洗气
蒸馏
NaOH溶液
分液
NaOH溶液
分液
CaO
蒸馏
蒸馏水
分液
蒸馏水
分液
NaOH溶液
蒸馏
含有杂质的物质
所用试剂
分离方法
乙
烯(SO2、CO2)
乙炔(H2S、PH3)
溴化钠溶液(碘化钠)
乙醇(乙酸)
乙酸(乙醇)
溴苯(溴、苯、溴化铁)
溴乙烷(溴)
硝基苯(苯、酸)
提纯苯甲酸
提纯蛋白质
实例总结2:
物质的分离提纯:
NaOH溶液
洗气
蒸馏水
、
NaOH溶液
洗涤-分液-蒸馏
溴的四氯化碳溶液
洗涤—萃取分液
NaOH溶液或碳酸钠溶液等
蒸馏
NaOH溶液
、硫酸
蒸发——蒸馏
蒸馏水、NaOH溶液
洗涤-分液-蒸馏
NaHSO3溶液
洗涤—分液
硫酸铜溶液
洗气
蒸馏水
重结晶
蒸馏水、浓轻金属盐
盐析/渗析
1.(2020·大庆高三质检)下列有机实验的说法正确的是
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口
倒出有机层
B.因为乙烯具有还原性,所以乙烯通入到溴水中能使溴水褪色
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分
吸收乙酸和乙醇
D.充满CH4和Cl2的试管倒置在饱和食盐水溶液之上,光照充分反应后,
液体会充满试管
√
解析 苯的密度小于水,用苯萃取溴水中的Br2,分层后苯层在上面,水层在下面,所以分液时先从分液漏斗下口放出水层,再从上口倒出有机层,A项正确;
乙烯分子中含有碳碳双键,能与溴水发生加成反应生成1,2-二溴乙烷,使溴水褪色,并非因为还原性,B项错误;
乙酸乙酯制备实验中,不能将导管插入饱和碳酸钠溶液液面以下,易引起倒吸现象,C项错误;
CH4和Cl2在光照条件下发生取代反应,生成CH3Cl气体、HCl气体、CH2Cl2液体、CHCl3液体、CCl4液体,其中HCl气体极易溶于水,试管倒置在饱和食盐水之上,液体不断上升,但不会充满试管,D项错误。
2.(2020·南昌高三联考)加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
√
解析 A项,装置乙试管中收集到的液体物质是苯和甲苯,两种物质的分子中都含有苯环,在催化剂存在下可以与Br2发生取代反应,正确;
B项,加热聚丙烯废塑料得到的不饱和烃乙烯、丙烯可以与Br2发生加成反应,产生1,2-二溴乙烷和1,2-二溴丙烷,它们都是液体物质,难溶于水,密度比水大,正确;
C项,加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,气体物质有氢气、甲烷、乙烯、丙烯,液体物质有苯和甲苯,其中苯和甲苯经冷水降温留在小试管中;气体中乙烯、丙烯与溴的四氯化碳溶液反应变为液体,剩余气体为氢气、甲烷,燃烧产生H2O、CO2,无污染,因此可作为清洁燃料使用,正确;
D项,甲烷是正四面体结构,分子中只有一种H原子,其二氯代物只有1种,错误。
3.(2020·福建省龙岩市高中质检)已知:①
+HNO3
+H2O ΔH<0;②硝基苯沸点210.9
℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
√
解析 浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能会导致液体迸溅,故A错误;
反应在50~60
℃下进行,低于水的沸点,因此可以利用水浴加热控制,这样可使反应容器受热均匀,便于控制温度,但图中水浴的水的用量太少,反应液受热不均匀,故B错误;
硝基苯为油状液体,不溶于水且密度比水大,在下层,分液操作时应将分液漏斗上口的瓶塞打开,下端紧贴烧杯内壁,下层的液体从下口放出,故C正确;
蒸馏分离提纯操作中温度计用来测量蒸汽的温度,控制蒸馏出的物质的温度,温度计水银球应在烧瓶的支管口处,故D错误。
4.(2020·陕西省宜川中学高三月考)实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是
A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.酸性KMnO4溶液若倒吸可加快褪色速率
D.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
√
解析 依据石油分馏工业的分馏塔原理,设置了长导管,其作用除导气外,兼起冷凝气体的作用,故A正确;
装置Ⅱ中冷水的作用是冷凝收集裂化油,故B正确;
因为装置Ⅱ中有不饱和烃生成,所以酸性KMnO4溶液若倒吸可加快褪色速率,故C正确;
根据裂化的反应原理,试管Ⅲ中溶液颜色变浅甚至褪色可说明发生了氧化还原反应,有常温下呈气态含碳原子数小于5的不饱和烃生成,不一定是乙烯,故D错误。
实验热点:有机实验
解题流程
分析制
备流程
熟悉重
要仪器
特殊实验
装置分析
①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。
②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。
③若制备物质易被空气中氧气氧化,应加排空气装置。
依据反应
特点作答
加热操作:①使用可燃性气体(如:H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。
②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。
有机制备:①有机物易挥发,反应中通常采用冷凝回流装置,以提高原料的利用率和产物的产率。
②在实验中需要控制反应条件,以减少副反应的发生。
③根据产品与杂质的性质特点,选择合适的分离提纯方法。
“有机物制备”评价型
(2020·全国卷Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称
相对分子质量
熔点/℃
沸点/℃
密度/
(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100
℃左右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g(约0.03
mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0
g。
(3)纯度测定:称取0.122
g粗产品,配成乙醇溶液,于100
mL容量瓶中定容。每次移取25.00
mL溶液,用0.010
00
mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50
mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为____(填标号)。
A.100
mL
B.250
mL
C.500
mL
D.1
000
mL
B
解析 该反应需要向三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g高锰酸钾,所以三颈烧瓶的最适宜规格为250
mL。
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是_________________
_______________________。
球形
无油珠说明不溶于
水的甲苯已经被完全氧化
解析 反应中应选用球形冷凝管,球形冷凝管散热面积大,冷凝效果好;回流液中不再出现油珠,说明不溶于水的甲苯(油状液体)已经被KMnO4完全氧化。
(3)加入适量饱和亚硫酸氢钠溶液的目的是__________________________
_______________________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理_____________________________________
_______________。
除去过量的高锰酸钾,避免在
用盐酸酸化时,产生氯气
+5H2C2O4+6H+===2Mn2++
10CO2↑+8H2O
解析 加入适量饱和亚硫酸氢钠溶液的目的:NaHSO3与KMnO4(H+)发生氧化还原反应除去过量的KMnO4(H+),防止用盐酸酸化时,KMnO4把盐酸中的Cl-氧化为Cl2;该过程也可用草酸在酸性条件下与KMnO4反应除去KMnO4,反应的离子方程式为
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是______。
MnO2
解析 用少量热水洗涤滤渣的目的是使生成的
尽可能溶于水,
故滤渣的主要成分是KMnO4在中性条件下的还原产物MnO2。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是________________。
苯甲酸升华而损失
解析 苯甲酸在100
℃左右开始升华,干燥苯甲酸晶体时,若温度过高,苯甲酸易升华而损失。
(6)本实验制备的苯甲酸的纯度为________;据此估算本实验中苯甲酸的产率最接近于____(填标号)。
A.70%
B.60%
C.50%
D.40%
86.0%
C
解析 根据反应
可知,
n(KOH)=0.010
00
mol·L-1×21.50×10-3
L×4,m(
)=
在理论上,1
mol甲苯反应后生成1
mol苯甲酸,则:
1.5
mL×0.867
g·mL-1
m
苯甲酸的理论产量m≈1.72
g
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
重结晶
解析 根据苯甲酸的水溶性可知,若要得到纯度更高的苯甲酸,需要利用重结晶的方法进行提纯。
三、有机物的分离提纯
1.
有机物分离提纯的方法
蒸馏(分馏)法、萃取法、(洗涤)分液法、过滤、洗气法、渗析、
盐析、
重结晶法
有机物提纯的三种常用方法:
蒸馏(分馏)法、(洗涤)分液法、
洗气法、
(1)洗气法
使用范围:用于除去气体中的某些杂质气体,洗涤剂必须只能吸收杂质气体
除去甲烷中的乙烯、乙炔(溴水)
除去乙烯中的SO2、CO2(NaOH溶液)除去乙炔中的H2S、PH3(CuSO4溶液)
(2)(洗涤)分液法
除去硝基苯中的残酸(NaOH溶液)除去溴苯中的溴(NaOH溶液)
除去乙酸乙酯中的乙酸
—(饱和碳酸钠溶液)除去苯中的苯酚(NaOH溶液)
除去苯中的甲苯(酸性高锰酸钾溶液)
除去苯酚中的苯甲酸(NaOH溶液通CO2)
用于除去某些液体中的杂质(有时分液前要加
入某种试剂使之
)
提纯硝基苯、由工业酒精制无水乙醇从乙酸和乙醇的混合液中分离出乙醇石油的分馏。
(3)蒸馏(分馏)
利用沸点的不同对互溶的两种液体的提纯或分离,蒸馏前,有时需加入某种试剂使混合物中的一成分转化成难挥发的物质。
(4)盐析和渗析
盐析:除去肥皂中的甘油和过量碱
渗析:除去淀粉中的少量葡萄糖或者NaCl
1、有机物鉴别常用的方法
(1)有机物的溶解性和密度
①易溶于水:低级醇、醛、羧酸、有机钠盐、乙二醇、丙三醇;
且同系物随碳原子数目增加,溶解性降低;含-OH
-COOH、-CHO数目越多,越易溶于水。
②难溶于水,比水轻:烃、一氯(氟)代物、酯;
③难溶于水,比水重:
大多数卤代烃(溴苯,四氯化碳,溴乙烷等)、硝基苯
。
四、有机物的检验
(2)有机物的燃烧情况
①
是否可燃:大部分有机物可燃,除CCl4
②燃烧时产生黑烟:
如:区分乙烷、乙烯和乙炔
③
燃烧气味:
如:区分蛋白质和纤维素
(3)根据有机物官能团性质
水、溴水、KMnO4、新制Cu(OH)2、银氨溶液、NaOH、NaHCO3、碘水、浓硝酸、Fe3+
常用的检验试剂
2、几种重要有机物的检验
有机物质
使用试剂
现象
烯烃(炔烃)
溴水或酸性高锰酸钾
褪色
苯的同系物
(甲苯)
溴水和酸性高锰酸钾
溴水不褪色
酸性高锰酸钾褪色
醇
铜丝
铜丝由黑变红
酚
浓溴水或氯化铁溶液
产生白色沉淀或溶液变紫色
有机物质
使用试剂
现象
醛
银氨溶液或
新制Cu(OH)2
光亮银镜或红色沉淀
乙酸(羧酸)
紫色石蕊试液或NaHCO3
变红或产生气泡
乙酸乙酯
水;酚酞和氢氧化钠
加热一段时间红色变浅
葡萄糖
新制Cu(OH)2
红色沉淀
蛋白质
浓硝酸
变黄
淀粉
碘水
溶液变蓝
1)步骤(含试剂):
(1)取少量卤代烃(溴乙烷),
(2)加氢氧化钠溶液,
(3)充分振荡或加热,
(4)冷却
,
(6)加硝酸银溶液,
2)现象:若产生白色(淡黄色、黄色)沉淀。3)结论:有-Cl、(-Br、-I)。
3、卤代烃中卤素原子的检验:
4、烯醛中碳碳双键的检验:
(1)若是纯净的液态样品(无水):
取样—加入溴的四氯化碳溶液—若褪色即可证明
(2)若是水溶液:
取样—加入足量的银氨溶液或新制氢氧化铜悬浊液,加热—
冷却(过滤)—加入硝酸酸化,再加入溴水—若褪色即可证明
5、二糖或多糖水解产物的检验:
—若二糖或多糖是在稀硫酸作用下水解
检验方法:
取样,加稀硫酸加热一定时间—向水解液中加入足量NaOH溶液中和至碱性—再加入银氨溶液或新制氢氧化铜悬浊液,加热,观察现象
6、溶解在苯中的苯酚的检验:
检验方法:
取样,向试样中加入NaOH溶液—振荡,静置分液—向水溶液中加入盐酸酸化,再滴入几滴氯化铁溶液(饱和溴水)—
若溶液呈紫色(产生白色沉淀)即可证明。
1.(2020·陕西省渭南中学高三模拟)锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点:144.5
℃,沸点:364.5
℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2
SnI4制备SnI4。
下列说法错误的是
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
√
解析 SnI4易水解,装置Ⅱ的主要作用是防止空气中的水蒸气进入到反应装置中,故A错误;
根据相似相溶原理,SnI4是非极性分子,可溶于CCl4中,故B正确;
冷凝水方向是“下进上出”,因此装置Ⅰ中a为冷凝水进水口,故C正确;
液体加热时易暴沸,因此需要加入碎瓷片,故D正确。
2.对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点:156.2
℃)、Br2和苯(沸点:80
℃)]进行纯化,未涉及的装置是
√
解析 除去Br2可以用SO2,原理是:Br2+SO2+2H2O===H2SO4+2HBr,故A正确;
分液可得苯和溴苯的混合液,故B正确;
该实验不涉及过滤操作,故C错误;
溴苯的沸点是156.2
℃、苯的沸点是80
℃,溴苯和苯用蒸馏法分离,故D正确。
3.在提纯粗苯甲酸(C6H5—COOH,常温下为晶体)过程中,下列操作未涉及的是
√
解析 提纯粗苯甲酸(C6H5—COOH,常温下为晶体)的步骤为:①将粗苯甲酸充分溶解于少量热水中,用到C装置;
②将溶液蒸发浓缩得到苯甲酸的饱和溶液,用到装置D;然后趁热过滤,除去不溶性杂质,用到B装置;
③滤液冷却结晶,滤出晶体;
④洗涤晶体。并未涉及A操作,因此选A。
4.下列实验室制取乙烯、除杂质、性质检验、收集的装置和原理正确的是
√
解析 温度计没有插入液面下,故A错误;
实验室制取乙烯时会产生杂质乙醇、SO2、CO2和H2O,SO2、乙醇和乙烯均可以使酸性高锰酸钾溶液褪色,故B错误;
乙烯能使溴的四氯化碳溶液褪色,故C正确;
乙烯的密度和空气相近,不能用排空气法收集,故D错误。
5.下列实验装置图正确的是
√
解析 乙烯密度稍小于空气,应该采用向下排空气法收集,但因为乙烯不易溶于水且乙烯密度接近空气密度,最好采用排水法收集,故A错误;
分馏时,温度计测量馏分温度,水银球应该位于蒸馏烧瓶支管口处,且进、出水口错误,故B错误;
实验室用苯和浓硝酸在浓硫酸作催化剂、加热50~60
℃制备硝基苯,该实验操作正确,故C正确;
实验室制取乙酸乙酯时,导气管不能伸入饱和碳酸钠溶液中,否则易产生倒吸现象,故D错误。
(2020·课标全国Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称
相对分子质量
熔点/℃
沸点/℃
密度/(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100
℃左右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
五、经典真题
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g(约0.03
mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0
g。
(3)纯度测定:称取0.122
g粗产品,配成乙醇溶液,于100
mL容量瓶中定容。每次移取25.00
mL溶液,用0.010
00
mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50
mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为________(填字母)。
A.100
mL
B.250
mL
C.500
mL
D.1
000
mL
(2)在反应装置中应选用________冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是________________________。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________________________
_________________________________________________;
该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理
_________________________________________________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是________。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
_________________________________________________。
(6)本实验制备的苯甲酸的纯度为________;据此估算本实验中苯甲酸的产率最接近于________(填字母)。
A.70%
B.60%
C.50%
D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
同课章节目录
