课题1 生活中常见的盐第3课时复分解反应课件(23张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐第3课时复分解反应课件(23张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-26 15:37:45 | ||
图片预览






文档简介
人教版化学九年级下册
课题1 生活中常见的盐
第3课时
目录
1
学习目标
2
自主探究
3
课堂达标
01
学习目标
1.理解复分解反应反应的概念,会判断什么是复分解反应。
2.掌握复分解反应发生的条件和实质,能判断复分解反应能否发生。
3.记住常见酸、碱、盐的溶解性和常见沉淀的种类及颜色。
4.知道物质分类的方法,能辨别常见物质的种类。
学 习 目 标
02
自主探究
写出下列物质反应的化学方程式。
(1)盐酸和氢氧化钠反应
(2)实验室制取二氧化碳的反应
(3)工业制烧碱的反应
(4)硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠
(5)用盐酸除铁锈
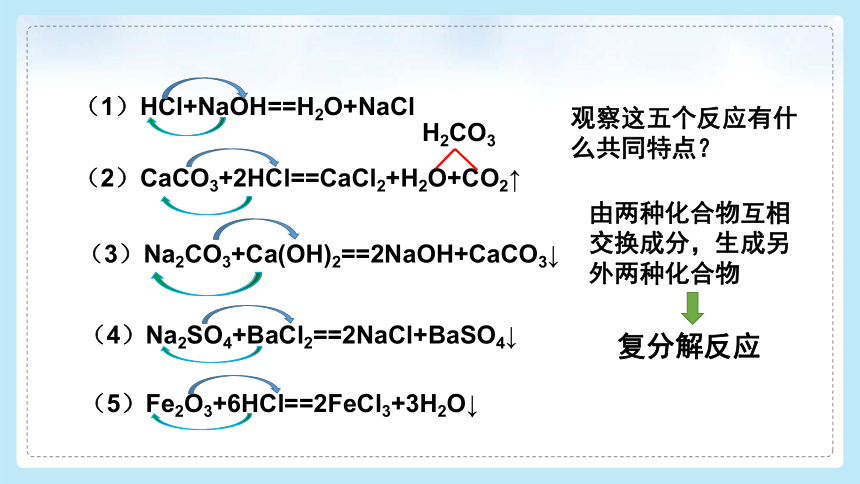
观察这五个反应有什么共同特点?
(1)HCl+NaOH==H2O+NaCl
由两种化合物互相交换成分,生成另外两种化合物
H2CO3
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
复分解反应
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
概念
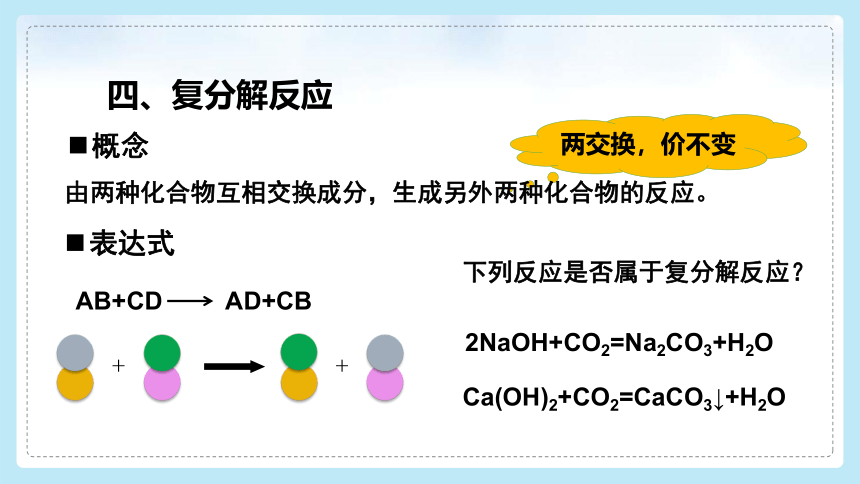
下列反应是否属于复分解反应?
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
+
+
四、复分解反应
表达式
两交换,价不变
由两种化合物互相交换成分,生成另外两种化合物的反应。
AB+CD AD+CB
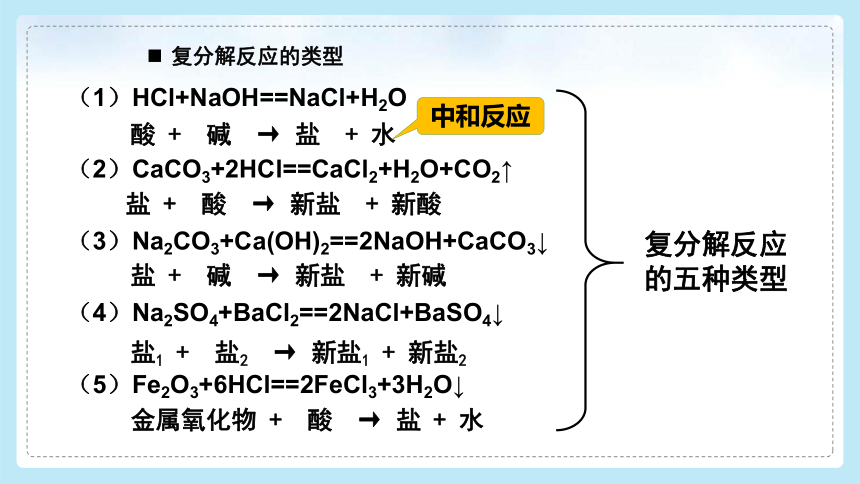
(1)HCl+NaOH==NaCl+H2O
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
复分解反应的五种类型
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
酸 + 碱 → 盐 + 水
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐1 + 盐2 → 新盐1 + 新盐2
金属氧化物 + 酸 → 盐 + 水
中和反应
复分解反应的类型
四种基本反应类型
化学反应类型
化合反应
分解反应
置换反应
复分解反应
3Fe+2O2 Fe3O4
点燃
2H2O 2H2↑+O2↑
通电
Fe+CuCl2 FeCl2+Cu
H2SO4+2NaOH
2H2O +Na2SO4
多变一
一变多
单换单
双交换,价不变
A+B+C…→D
A→ B+C…
A + BC→B + AC
AB + CD→ AD+ CB
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
实验11-3
分别向盛有硫酸铜溶液的试管里滴加氢氧化钠溶液和氯化钡溶液震荡,观察现象,并填写表格。
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH==
Cu(OH)2↓+Na2SO4
CuSO4+BaCl2==
BaSO4↓+CuCl2
讨论:
1.上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2.前面学过的酸碱中和反应也属于复分解反应,中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到共同现象是什么?
都有水生成
属于复分解反应
都有沉淀生成
都有气体生成
酸、碱、盐之间并不是都能发生复分解反应,需要满足什么样的条件,复分解反应才能发生呢?
NaCl和H2SO4、KNO3和Na2SO4能否发生复分解反应?
NaCl和H2SO4相互交换成分变成的是Na2SO4和HCl,两者都是溶于水的化合物
KNO3和Na2SO4相互交换成分变成的是K2SO4和NaNO3,两者也都是溶于水的化合物
反应类型
反应物需要满足条件
生成物需要满足条件
酸+碱
一种可溶即可(一般是酸可溶)
至少具备下列三个条件中的一个
①有沉淀生成
②有气体生成
③有水生成
酸+盐
盐可溶或者难溶,酸必须可溶
碱+盐
反应物两者都可溶
盐+盐
金属氧化物+酸
酸可溶
复分解反应发生的条件
酸、碱和盐的溶解性
(1)常见的酸都可溶。
(2)常见的碱类只溶“钾、钠、氨、钙、钡”。即氢氧化钾、氢氧化钠、氨水、氢氧化钙(微溶)、氢氧化钡可溶于水,其他的碱大多数不溶于水。
(3)常见盐的溶解性有如下规律:钾盐、钠盐、氨盐、硝酸盐都易溶于水,碳酸盐大多数难溶于水,氯化银和硫酸钡既不溶于水也不溶于酸。
酸类易溶除硅酸
碱溶钾、钠、氨、钙、钡
钾、钠、氨盐、硝酸盐
都能溶于水中间
盐酸盐不溶银、亚汞
硫酸盐难溶钡和铅
碳酸盐很简单
能溶只有钾、钠、铵
阅读课本第114附录Ⅰ,总结酸、碱、盐的溶解性规律
常见的七种沉淀
不能共存的离子对
BaSO4
AgCl
Cu(OH)2
Fe(OH)3
白色
蓝色
红褐色
不溶于酸
能溶于酸
生成水而不共存:H+和OH-
生成气体而不共存:H+和CO32-、H+和HCO3-、NH4+和OH-
生成沉淀而不共存:CO32-和Ca2+、 Ba2+、 Mg2+、 Ag+, Ag+和Cl-、 Ba2+和SO42-
探究所提供的五种溶液之间的反应,
√
√
√
×
2NaOH+H2SO4= Na2SO4 + 2H2O
NaCl+ H2SO4=不反应
K2CO3+H2SO4= K2SO4 + H2O + CO2
Ba(NO3)2+ H2SO4= BaSO4 + 2HNO3
中和反应,有水生成
有气体生成
有白色沉淀生成
NaOH溶液
NaCl溶液
K2CO3溶液
Ba(NO3)2溶液
稀硫酸
H+、Cl-
Na+、CO3 2-
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
复分解发生反应的实质
2HCl + Na2CO3
Na2SO4+ + H2O
CO2↑
K2SO4 + NaNO3
Na2SO4 + KNO3
物质
混合物
纯净物
单质
化合物
金属
非金属
盐
氧化物
酸
碱
Cu、Fe、Ag
N2 、O2 、C
H2O 、CO2 、 CuO
HCl、H2SO4
NaOH 、Ca(OH)2
BaSO4、 Na2CO3
根据物质种类
(一种物质)
根据元素种类
(多种物质)
(一种元素)
(多种元素)
溶液、合金、混合气体(如空气)、矿石等
五、物质的分类
03
课堂达标
课 堂 达 标
1.下列反应中不属于复分解反应的是( )
A.H2SO4+Ca(OH)2=CaSO4+2H2O
B.H2SO4+BaCl2=BaSO4↓+2HCl
C.2HCl+Fe=FeCl2+H2↑
D.2HCl+CaSO4=CaCl2+H2O+CO2 ↑
C
B
2.下列物质混合后,不能发生复分解反应的一组是( )
A.K2SO4溶液和Ba(OH)2溶液混合
B.KCl 溶液和Cu(NO3)2溶液混合
C.CuSO4溶液和NaOH溶液混合
D.CaCO3和HCl溶液
3.下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A.Cu2+、H+、SO42-、Cl-
B.Ba2+、Na+、Cl-、NO3-
C.K+、Ca2+、OH-、CO32-
D.Na+、H+、 CO32- 、 NO3-
4.现有Fe、CuO、MgCl2溶液、Ca(OH)2溶液、稀H2SO4五种物质,在常温下它们两两相互发生的化学反应有( )
A.7个 B.6个 C.5个 D.4个
D
B
5.下列实验中无明显现象的是( )
A.向H2SO4溶液中滴加Ba(OH)2溶液
B.向Mg(NO3)2溶液中滴加Na2SO4溶液
C.将浓硫酸加入蒸馏水中并不断搅拌
D.将(NH4)2SO4和熟石灰混合研磨
6.通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
B
C
7.不用其他试剂,仅仅利用试管和胶头滴管就可以区别下列四种物质的溶液:①CuSO4;②MgCl2;③KOH;④NaNO3。则正确的鉴别顺序是( )
A.②③①④ B.①②③④ C.①③②④ D.②①③④
C
8.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和操作错误的是( )
C
9.把下列物质进行分类
O2 H2O CO2 N2 Fe H2SO4 NaOH CuSO4 Na2CO3 Mg(OH)2 NH4Cl Hg I2 CuO Cl2 Cu
酸
碱
盐
氧化物
金属单质
非金属单质
O2
CuO
H2O
CO2
N2
Fe
H2SO4
NaOH
CuSO4
Na2CO3
Mg(OH)2
NH4Cl
Hg
I2
Cl2
Cu
10.下图表示物质间的转化关系(图中“→”表示某种物质转化成另一种物质)。
(1)转化①的基本反应类型是_____________________;
(2)向澄清石灰水中通入CO2能够实现转化②,反应的化学方程式为________________________________________;
(3)若转化③、④、⑤都是与同种物质反应生成CaCl2,则该物质是_____________________。
稀盐酸(HCl)
CO2+Ca(OH)2==CaCO3↓+H2O
分解反应
11.将下列各组中的两种溶液混合(溶液中的原有的水分子忽略不写):
(1)A组发生化学变化,化学方程式为 。
实质是反应物1中的 (填粒子符号,下同)与反应物2中的______ 结合形成 。
(2)B组发生化学变化,且B组反应物1是盐的水溶液,反应物2是碱的水溶液,则B组中反应物1是 (填名称,下同),反应物2是 ;
(3)C组没有发生化学反应,原因是(微观角度解释):
。
编号
反应物1
反应物2
混合后存在的粒子
A
稀盐酸(H+、Cl-)
氢氧化钾溶液(K+、OH-)
K+、Cl-、H2O
B
Na+、SO42-、Cu(OH)2↓
C
氯化钠溶液(Na+、Cl-)
稀硫酸(H+、SO42-)
H+、SO42- 、Na+、Cl-
HCl+KOH=KCl +H2O
H+
OH-
H2O
硫酸铜溶液
氢氧化钠溶液
混合前后,溶液中的离子没有结合成新的分子
课程结束
人教版化学九年级下册
课题1 生活中常见的盐
第3课时
目录
1
学习目标
2
自主探究
3
课堂达标
01
学习目标
1.理解复分解反应反应的概念,会判断什么是复分解反应。
2.掌握复分解反应发生的条件和实质,能判断复分解反应能否发生。
3.记住常见酸、碱、盐的溶解性和常见沉淀的种类及颜色。
4.知道物质分类的方法,能辨别常见物质的种类。
学 习 目 标
02
自主探究
写出下列物质反应的化学方程式。
(1)盐酸和氢氧化钠反应
(2)实验室制取二氧化碳的反应
(3)工业制烧碱的反应
(4)硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠
(5)用盐酸除铁锈
观察这五个反应有什么共同特点?
(1)HCl+NaOH==H2O+NaCl
由两种化合物互相交换成分,生成另外两种化合物
H2CO3
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
复分解反应
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
概念
下列反应是否属于复分解反应?
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
+
+
四、复分解反应
表达式
两交换,价不变
由两种化合物互相交换成分,生成另外两种化合物的反应。
AB+CD AD+CB
(1)HCl+NaOH==NaCl+H2O
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
复分解反应的五种类型
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
酸 + 碱 → 盐 + 水
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐1 + 盐2 → 新盐1 + 新盐2
金属氧化物 + 酸 → 盐 + 水
中和反应
复分解反应的类型
四种基本反应类型
化学反应类型
化合反应
分解反应
置换反应
复分解反应
3Fe+2O2 Fe3O4
点燃
2H2O 2H2↑+O2↑
通电
Fe+CuCl2 FeCl2+Cu
H2SO4+2NaOH
2H2O +Na2SO4
多变一
一变多
单换单
双交换,价不变
A+B+C…→D
A→ B+C…
A + BC→B + AC
AB + CD→ AD+ CB
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
实验11-3
分别向盛有硫酸铜溶液的试管里滴加氢氧化钠溶液和氯化钡溶液震荡,观察现象,并填写表格。
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH==
Cu(OH)2↓+Na2SO4
CuSO4+BaCl2==
BaSO4↓+CuCl2
讨论:
1.上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2.前面学过的酸碱中和反应也属于复分解反应,中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到共同现象是什么?
都有水生成
属于复分解反应
都有沉淀生成
都有气体生成
酸、碱、盐之间并不是都能发生复分解反应,需要满足什么样的条件,复分解反应才能发生呢?
NaCl和H2SO4、KNO3和Na2SO4能否发生复分解反应?
NaCl和H2SO4相互交换成分变成的是Na2SO4和HCl,两者都是溶于水的化合物
KNO3和Na2SO4相互交换成分变成的是K2SO4和NaNO3,两者也都是溶于水的化合物
反应类型
反应物需要满足条件
生成物需要满足条件
酸+碱
一种可溶即可(一般是酸可溶)
至少具备下列三个条件中的一个
①有沉淀生成
②有气体生成
③有水生成
酸+盐
盐可溶或者难溶,酸必须可溶
碱+盐
反应物两者都可溶
盐+盐
金属氧化物+酸
酸可溶
复分解反应发生的条件
酸、碱和盐的溶解性
(1)常见的酸都可溶。
(2)常见的碱类只溶“钾、钠、氨、钙、钡”。即氢氧化钾、氢氧化钠、氨水、氢氧化钙(微溶)、氢氧化钡可溶于水,其他的碱大多数不溶于水。
(3)常见盐的溶解性有如下规律:钾盐、钠盐、氨盐、硝酸盐都易溶于水,碳酸盐大多数难溶于水,氯化银和硫酸钡既不溶于水也不溶于酸。
酸类易溶除硅酸
碱溶钾、钠、氨、钙、钡
钾、钠、氨盐、硝酸盐
都能溶于水中间
盐酸盐不溶银、亚汞
硫酸盐难溶钡和铅
碳酸盐很简单
能溶只有钾、钠、铵
阅读课本第114附录Ⅰ,总结酸、碱、盐的溶解性规律
常见的七种沉淀
不能共存的离子对
BaSO4
AgCl
Cu(OH)2
Fe(OH)3
白色
蓝色
红褐色
不溶于酸
能溶于酸
生成水而不共存:H+和OH-
生成气体而不共存:H+和CO32-、H+和HCO3-、NH4+和OH-
生成沉淀而不共存:CO32-和Ca2+、 Ba2+、 Mg2+、 Ag+, Ag+和Cl-、 Ba2+和SO42-
探究所提供的五种溶液之间的反应,
√
√
√
×
2NaOH+H2SO4= Na2SO4 + 2H2O
NaCl+ H2SO4=不反应
K2CO3+H2SO4= K2SO4 + H2O + CO2
Ba(NO3)2+ H2SO4= BaSO4 + 2HNO3
中和反应,有水生成
有气体生成
有白色沉淀生成
NaOH溶液
NaCl溶液
K2CO3溶液
Ba(NO3)2溶液
稀硫酸
H+、Cl-
Na+、CO3 2-
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
复分解发生反应的实质
2HCl + Na2CO3
Na2SO4+ + H2O
CO2↑
K2SO4 + NaNO3
Na2SO4 + KNO3
物质
混合物
纯净物
单质
化合物
金属
非金属
盐
氧化物
酸
碱
Cu、Fe、Ag
N2 、O2 、C
H2O 、CO2 、 CuO
HCl、H2SO4
NaOH 、Ca(OH)2
BaSO4、 Na2CO3
根据物质种类
(一种物质)
根据元素种类
(多种物质)
(一种元素)
(多种元素)
溶液、合金、混合气体(如空气)、矿石等
五、物质的分类
03
课堂达标
课 堂 达 标
1.下列反应中不属于复分解反应的是( )
A.H2SO4+Ca(OH)2=CaSO4+2H2O
B.H2SO4+BaCl2=BaSO4↓+2HCl
C.2HCl+Fe=FeCl2+H2↑
D.2HCl+CaSO4=CaCl2+H2O+CO2 ↑
C
B
2.下列物质混合后,不能发生复分解反应的一组是( )
A.K2SO4溶液和Ba(OH)2溶液混合
B.KCl 溶液和Cu(NO3)2溶液混合
C.CuSO4溶液和NaOH溶液混合
D.CaCO3和HCl溶液
3.下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A.Cu2+、H+、SO42-、Cl-
B.Ba2+、Na+、Cl-、NO3-
C.K+、Ca2+、OH-、CO32-
D.Na+、H+、 CO32- 、 NO3-
4.现有Fe、CuO、MgCl2溶液、Ca(OH)2溶液、稀H2SO4五种物质,在常温下它们两两相互发生的化学反应有( )
A.7个 B.6个 C.5个 D.4个
D
B
5.下列实验中无明显现象的是( )
A.向H2SO4溶液中滴加Ba(OH)2溶液
B.向Mg(NO3)2溶液中滴加Na2SO4溶液
C.将浓硫酸加入蒸馏水中并不断搅拌
D.将(NH4)2SO4和熟石灰混合研磨
6.通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
B
C
7.不用其他试剂,仅仅利用试管和胶头滴管就可以区别下列四种物质的溶液:①CuSO4;②MgCl2;③KOH;④NaNO3。则正确的鉴别顺序是( )
A.②③①④ B.①②③④ C.①③②④ D.②①③④
C
8.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和操作错误的是( )
C
9.把下列物质进行分类
O2 H2O CO2 N2 Fe H2SO4 NaOH CuSO4 Na2CO3 Mg(OH)2 NH4Cl Hg I2 CuO Cl2 Cu
酸
碱
盐
氧化物
金属单质
非金属单质
O2
CuO
H2O
CO2
N2
Fe
H2SO4
NaOH
CuSO4
Na2CO3
Mg(OH)2
NH4Cl
Hg
I2
Cl2
Cu
10.下图表示物质间的转化关系(图中“→”表示某种物质转化成另一种物质)。
(1)转化①的基本反应类型是_____________________;
(2)向澄清石灰水中通入CO2能够实现转化②,反应的化学方程式为________________________________________;
(3)若转化③、④、⑤都是与同种物质反应生成CaCl2,则该物质是_____________________。
稀盐酸(HCl)
CO2+Ca(OH)2==CaCO3↓+H2O
分解反应
11.将下列各组中的两种溶液混合(溶液中的原有的水分子忽略不写):
(1)A组发生化学变化,化学方程式为 。
实质是反应物1中的 (填粒子符号,下同)与反应物2中的______ 结合形成 。
(2)B组发生化学变化,且B组反应物1是盐的水溶液,反应物2是碱的水溶液,则B组中反应物1是 (填名称,下同),反应物2是 ;
(3)C组没有发生化学反应,原因是(微观角度解释):
。
编号
反应物1
反应物2
混合后存在的粒子
A
稀盐酸(H+、Cl-)
氢氧化钾溶液(K+、OH-)
K+、Cl-、H2O
B
Na+、SO42-、Cu(OH)2↓
C
氯化钠溶液(Na+、Cl-)
稀硫酸(H+、SO42-)
H+、SO42- 、Na+、Cl-
HCl+KOH=KCl +H2O
H+
OH-
H2O
硫酸铜溶液
氢氧化钠溶液
混合前后,溶液中的离子没有结合成新的分子
课程结束
人教版化学九年级下册
同课章节目录
