2020-2021学年鲁科版(2019)高中化学必修第二册第2章《化学键 化学反应规律》测试题(含答案)
文档属性
| 名称 | 2020-2021学年鲁科版(2019)高中化学必修第二册第2章《化学键 化学反应规律》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 336.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-26 17:24:51 | ||
图片预览



文档简介
《化学键
化学反应规律》测试题
一、单选题
1.有共价键的离子化合物是(
)
A.
B.
C.
D.
2.下列措施,一定不能加快化学反应速率的是
A.增大压强
B.升高温度
C.加催化剂
D.增大固体质量
3.下列属于吸热反应的是(
)
①冰雪融化
②KMnO4分解制O2③铝与氧化铁的反应
④钠与水反应
⑤二氧化碳与灼热木炭反应
⑥碘的升华
⑦Ba(OH)2?8H2O和NH4Cl反应
A.②⑥⑦
B.②⑤⑦
C.①②⑤⑥⑦
D.③④
4.如图所示为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是
A.H2(g)和O2(g)反应生成H2O(g),这是个吸热反应过程
B.由2mol
H2和1mol
O2变成4mol
H、2mol
O原子,这是个放热反应过程
C.2mol
H2(g)和1mol
O2(g)反应生成2mol
H2O(g),共放出484kJ能量
D.4mol
H、2mol
O生成2mol
H2O(g),共放出484kJ能量
5.利用反应:2NO(g)+2CO(g)
2CO2(g)+N2(g)△H=-46.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.增大压强
C.升高温度
D.及时移出CO2和N2
6.在一定温度下,可逆反应A(g)
+
3B(g)2C(g)达到平衡的标志是
A.单位时间内生成n
mol
A,同时生成2n
mol
C
B.A、B、C的浓度相等
C.单位时间内生成n
mol
A,同时生成3n
mol
B
D.A、B、C的分子数之比为1:3:2
7.铝的原子结构示意图为(
)
A.
B.
C.
D.
8.反应
A(g)+3B(g)2C(g)+2D(g)
在四种不同情况下的反应速率分别为①v(A)=1.2mol·L?1·min?1
②v(B)=0.75mol·L?1·s?1
③v(C)=0.5
mol·L?1·s?1
④v(D)=0.6
mol·L?1·s?1,
该反应进行的快慢顺序为
A.④>③=②>①
B.④<③=②<①
C.①>②>③>④
D.④>③>②>①
9.已知合成氨反应:N2(g)+3H2(g)2NH3(g)△H<0,工业上选择的适宜条件为500℃、铁做催化剂、20MPa~50MPa.下列叙述中正确的是
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,所以工业生产中尽可能提高温度
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
10.氮及其化合物的转化过程如图所示。下列分析不合理的是
A.催化剂
a
表面发生了非极性共价键的断裂和极性共价键的形成
B.催化剂不能改变反应焓变但可降低反应活化能
C.在催化剂
b
表面形成氮氧键时,涉及电子转移
D.催化剂
a、b
能提高反应的平衡转化率
11.下列说法中正确的是
A.NaHSO4在熔融状态下电离与在水中电离时,破坏的化学键完全相同
B.H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致
C.I2是分子晶体,加热升华过程中只需克服分子间作用力
D.CO2和PCl5分子中每个原子的最外层都具有8电子稳定结构
12.下列有关化学用语表示正确的是
A.中子数为34,质子数为29的铜原子:
B.的结构式:
C.氯离子的结构示意图:
D.的电子式为
13.下列表示正确的是
A.N2分子的结构式:
B.次氯酸的电离方程式:HClO
=
H+
+
ClO-
C.CCl4的电子式:
D.S2-的结构示意图:
14.某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g)?
2Z(g)。反应过程中测定的部分数据如下表:
t/min
n(X)/mol
n(Y)/mol
0
1.20
0.60
1
0.90
2
0.80
4
0.20
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2
mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2
mol
Z的同时消耗1
mol
Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2
mol
X和0.6
mol
Y,X的转化率将减小
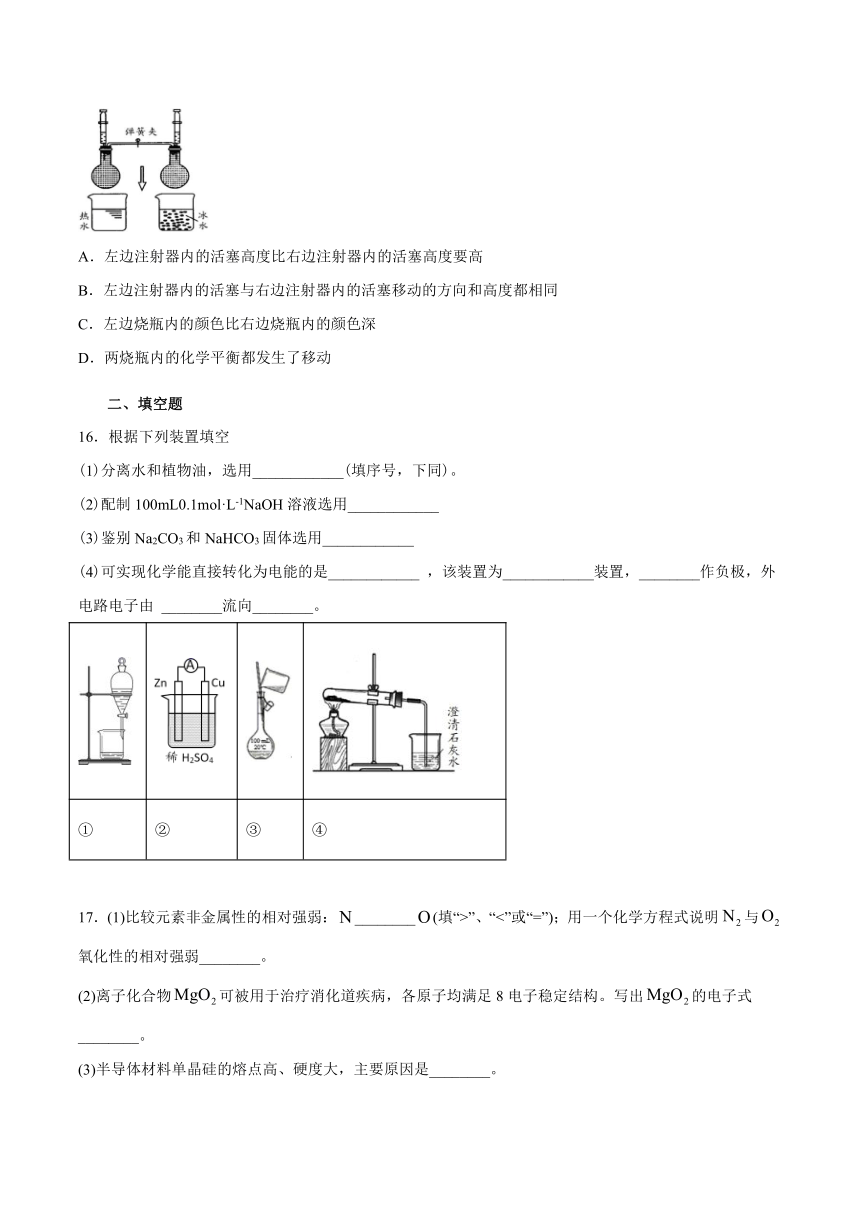
15.如图所示,把NO2和N2O4的混合气体盛在两个连通的烧瓶里,调节左、右两边注射器内活塞,使其高度相等,关闭弹簧夹;同时把一个烧瓶放在热水里,另一个放在冰水里。下列对实验现象的描述错误的是(
)。
A.左边注射器内的活塞高度比右边注射器内的活塞高度要高
B.左边注射器内的活塞与右边注射器内的活塞移动的方向和高度都相同
C.左边烧瓶内的颜色比右边烧瓶内的颜色深
D.两烧瓶内的化学平衡都发生了移动
二、填空题
16.根据下列装置填空
(1)分离水和植物油,选用____________(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液选用____________
(3)鉴别Na2CO3和NaHCO3固体选用____________
(4)可实现化学能直接转化为电能的是____________
,该装置为____________装置,________作负极,外电路电子由
________流向________。
①
②
③
④
17.(1)比较元素非金属性的相对强弱:________(填“>”、“<”或“=”);用一个化学方程式说明与氧化性的相对强弱________。
(2)离子化合物可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
18.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)上述反应______________(“是”或“不是”)可逆反应。
(2)如图所示表示NO2变化的曲线是___________________,用O2表示从0~2s内该反应的平均反应速率v(O2)=__________________。
(3)不能说明该反应已达到平衡状态的是________________________。
a.v(NO2)=2v(O2)
b.容器内气体压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内气体的密度保持不变
19.我国科学家成功合成了含N的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
(1)N在元素周期表中的位置是______。
(2)N中,N原子之间的相互作用是______(填“离子键”或“共价键”)。
(3)非金属性O强于N,用原子结构解释原因:______,得电子能力O大于N。
(4)砷(As)与氮位于同一主族,下列推断正确的是______(填序号)。
①
砷元素的最低负化合价为?3价
②
热稳定性:AsH3>NH3
③
砷的最高价氧化物对应的水化物属于酸
20.某温度时,在0.5L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
(1)该反应的化学方程式为__________。
(2)0~4min内,用B表示的反应速率v(B)=__________。
(3)第4min时,正、逆反应速率的大小关系为:v(正)__________v(逆),(填“>”“<”或“=”)。
(4)下列措施能加快反应速率的是__________。
A.恒温恒容充入He气
B.缩小体积,使压强增大
C.恒温恒压充入He气
D.使用催化剂
三、元素或物质推断题
21.已知X、Y、Z、W四种元素分别是元素周期表中短周期的元素,且原子序数依次增大。X、W同主族,X无中子,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)Z元素的元素符号:
________
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为_________,它的共价键属于________
(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为______________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________
(写化学式),由X、Z、W三元素形成的离子化合物的电子式为______________________。
(4)X与W形成的化合物溶于水,发生反应的化学方程式为_________________。已知分子式为NH5的物质,其组成与该化合物相似,为离子化合物,预测NH5与足量稀盐酸反应的化学方程式__________________
四、实验题
22.文献表明:相同条件下,草酸根(C2O42?)的还原性强于Fe2+。为检验这一结论,完成如下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾[K3Fe(C2O4)3?3H2O]为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3]
3?Fe3++
3C2O42?
K=6.3×10?21
ⅲ.FeC2O4?2H2O为黄色固体,微溶于水,可溶于强酸。
(实验1)通过Fe3+和C2O42?在溶液中的反应比较Fe2+和C2O42?的还原性强弱。
操作
现象
在避光处,向10
mL
0.5
mol·L?1
FeCl3溶液中缓慢加入0.5
mol·L?1
K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤
得到翠绿色溶液和翠绿色晶体
(1)C2O42?中碳元素的化合价是______。
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______。
(3)经检验,翠绿色晶体为K3Fe(C2O4)3?3H2O。设计实验,确认实验1中没有发生氧化还原反应的操作和现象是______。实验1中未发生氧化还原反应的原因是______。
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:[Fe(C2O4)3]3?+H2O
FeC2O4?2H2O↓+
______
+______。_________
(实验2)通过比较H2O2与Fe2+、C2O42?反应的难易,判断二者还原性的强弱。
步骤
操作
现象
Ⅰ
向1
mL
0.5
mol·L?1
FeSO4溶液中加入1
mL
0.5
mol·L?1
K2C2O4溶液,过滤
立即产生黄色沉淀
Ⅱ
洗涤Ⅰ中的黄色沉淀,向其中加入过量的
6%
H2O2溶液,振荡,静置
剧烈放热,产生大量的红褐色沉淀和无色气体
Ⅲ
待充分反应后,向其中加入稀硫酸,调节pH约为4
得到翠绿色溶液
(5)证明Fe2+被氧化的实验现象是______。
(6)以上现象能否说明C2O42?没有被氧化。请判断并说明理由:______。
(实验3)通过其他实验方案比较Fe2+和C2O42?的还原性强弱。
(7)用FeCl3溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42?的还原性强弱。画出装置图并描述预期现象:______。
五、计算题
23.在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
参考答案
1.A
2.D
3.B
4.C
5.B
6.A
7.A
8.A
9.D
10.D
11.C
12.B
13.A
14.A
15.B
16.①
③
④
②
原电池
Zn
Zn
Cu
17.<
硅原子之间通过共价键结合,形成空间立体网状结构的原子晶体
18.是
b
1.5×10-3mol?L-1?s-1
a、d
19.第2周期、第VA族
共价键
电子层数O与N相同,核电荷数O大于N,原子半径O小于N
①
③
20.3A2B
0.1mol/(L·min)
>
BD
21.O
极性
NH4NO3
NaH+H2O=NaOH+H2↑
NH5+HCl=NH4Cl+H2↑
22.+3
溶液中存在平衡:[Fe(C2O4)3]3-Fe3++3C2O42-,加入硫酸后,H+与C2O42-结合生成H2C2O4,使平衡正向移动,c(Fe3+)增大,遇KSCN溶液变红
取少量实验1中的翠绿色溶液,滴加K3Fe(CN)6溶液,不出现蓝色沉淀
Fe3+与C2O42-生成稳定的[Fe(C2O4)]3-,浓度降低,Fe3+的氧化性和C2O42-的还原性减弱
2;4;2
;3C2O42-
;
2CO2
Ⅱ中产生大量红褐色沉淀或Ⅲ中得到翠绿色溶液
不能说明。有+4价碳的化合物生成,才能说明C2O42-被氧化,以上现象无法判断是否生成了+4价碳的化合物,因此不能说明C2O42-没有被氧化
电流计的指针偏转,电池工作一段时间后,取少量左侧烧杯中的溶液,滴加K3Fe(CN)6溶液,出现蓝色沉淀
23.0.0010mol?L-1?s-1
大于
1.3mol/L
化学反应规律》测试题
一、单选题
1.有共价键的离子化合物是(
)
A.
B.
C.
D.
2.下列措施,一定不能加快化学反应速率的是
A.增大压强
B.升高温度
C.加催化剂
D.增大固体质量
3.下列属于吸热反应的是(
)
①冰雪融化
②KMnO4分解制O2③铝与氧化铁的反应
④钠与水反应
⑤二氧化碳与灼热木炭反应
⑥碘的升华
⑦Ba(OH)2?8H2O和NH4Cl反应
A.②⑥⑦
B.②⑤⑦
C.①②⑤⑥⑦
D.③④
4.如图所示为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是
A.H2(g)和O2(g)反应生成H2O(g),这是个吸热反应过程
B.由2mol
H2和1mol
O2变成4mol
H、2mol
O原子,这是个放热反应过程
C.2mol
H2(g)和1mol
O2(g)反应生成2mol
H2O(g),共放出484kJ能量
D.4mol
H、2mol
O生成2mol
H2O(g),共放出484kJ能量
5.利用反应:2NO(g)+2CO(g)
2CO2(g)+N2(g)△H=-46.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.增大压强
C.升高温度
D.及时移出CO2和N2
6.在一定温度下,可逆反应A(g)
+
3B(g)2C(g)达到平衡的标志是
A.单位时间内生成n
mol
A,同时生成2n
mol
C
B.A、B、C的浓度相等
C.单位时间内生成n
mol
A,同时生成3n
mol
B
D.A、B、C的分子数之比为1:3:2
7.铝的原子结构示意图为(
)
A.
B.
C.
D.
8.反应
A(g)+3B(g)2C(g)+2D(g)
在四种不同情况下的反应速率分别为①v(A)=1.2mol·L?1·min?1
②v(B)=0.75mol·L?1·s?1
③v(C)=0.5
mol·L?1·s?1
④v(D)=0.6
mol·L?1·s?1,
该反应进行的快慢顺序为
A.④>③=②>①
B.④<③=②<①
C.①>②>③>④
D.④>③>②>①
9.已知合成氨反应:N2(g)+3H2(g)2NH3(g)△H<0,工业上选择的适宜条件为500℃、铁做催化剂、20MPa~50MPa.下列叙述中正确的是
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,所以工业生产中尽可能提高温度
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
10.氮及其化合物的转化过程如图所示。下列分析不合理的是
A.催化剂
a
表面发生了非极性共价键的断裂和极性共价键的形成
B.催化剂不能改变反应焓变但可降低反应活化能
C.在催化剂
b
表面形成氮氧键时,涉及电子转移
D.催化剂
a、b
能提高反应的平衡转化率
11.下列说法中正确的是
A.NaHSO4在熔融状态下电离与在水中电离时,破坏的化学键完全相同
B.H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致
C.I2是分子晶体,加热升华过程中只需克服分子间作用力
D.CO2和PCl5分子中每个原子的最外层都具有8电子稳定结构
12.下列有关化学用语表示正确的是
A.中子数为34,质子数为29的铜原子:
B.的结构式:
C.氯离子的结构示意图:
D.的电子式为
13.下列表示正确的是
A.N2分子的结构式:
B.次氯酸的电离方程式:HClO
=
H+
+
ClO-
C.CCl4的电子式:
D.S2-的结构示意图:
14.某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g)?
2Z(g)。反应过程中测定的部分数据如下表:
t/min
n(X)/mol
n(Y)/mol
0
1.20
0.60
1
0.90
2
0.80
4
0.20
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2
mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2
mol
Z的同时消耗1
mol
Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2
mol
X和0.6
mol
Y,X的转化率将减小
15.如图所示,把NO2和N2O4的混合气体盛在两个连通的烧瓶里,调节左、右两边注射器内活塞,使其高度相等,关闭弹簧夹;同时把一个烧瓶放在热水里,另一个放在冰水里。下列对实验现象的描述错误的是(
)。
A.左边注射器内的活塞高度比右边注射器内的活塞高度要高
B.左边注射器内的活塞与右边注射器内的活塞移动的方向和高度都相同
C.左边烧瓶内的颜色比右边烧瓶内的颜色深
D.两烧瓶内的化学平衡都发生了移动
二、填空题
16.根据下列装置填空
(1)分离水和植物油,选用____________(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液选用____________
(3)鉴别Na2CO3和NaHCO3固体选用____________
(4)可实现化学能直接转化为电能的是____________
,该装置为____________装置,________作负极,外电路电子由
________流向________。
①
②
③
④
17.(1)比较元素非金属性的相对强弱:________(填“>”、“<”或“=”);用一个化学方程式说明与氧化性的相对强弱________。
(2)离子化合物可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
18.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)上述反应______________(“是”或“不是”)可逆反应。
(2)如图所示表示NO2变化的曲线是___________________,用O2表示从0~2s内该反应的平均反应速率v(O2)=__________________。
(3)不能说明该反应已达到平衡状态的是________________________。
a.v(NO2)=2v(O2)
b.容器内气体压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内气体的密度保持不变
19.我国科学家成功合成了含N的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
(1)N在元素周期表中的位置是______。
(2)N中,N原子之间的相互作用是______(填“离子键”或“共价键”)。
(3)非金属性O强于N,用原子结构解释原因:______,得电子能力O大于N。
(4)砷(As)与氮位于同一主族,下列推断正确的是______(填序号)。
①
砷元素的最低负化合价为?3价
②
热稳定性:AsH3>NH3
③
砷的最高价氧化物对应的水化物属于酸
20.某温度时,在0.5L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
(1)该反应的化学方程式为__________。
(2)0~4min内,用B表示的反应速率v(B)=__________。
(3)第4min时,正、逆反应速率的大小关系为:v(正)__________v(逆),(填“>”“<”或“=”)。
(4)下列措施能加快反应速率的是__________。
A.恒温恒容充入He气
B.缩小体积,使压强增大
C.恒温恒压充入He气
D.使用催化剂
三、元素或物质推断题
21.已知X、Y、Z、W四种元素分别是元素周期表中短周期的元素,且原子序数依次增大。X、W同主族,X无中子,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)Z元素的元素符号:
________
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为_________,它的共价键属于________
(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为______________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________
(写化学式),由X、Z、W三元素形成的离子化合物的电子式为______________________。
(4)X与W形成的化合物溶于水,发生反应的化学方程式为_________________。已知分子式为NH5的物质,其组成与该化合物相似,为离子化合物,预测NH5与足量稀盐酸反应的化学方程式__________________
四、实验题
22.文献表明:相同条件下,草酸根(C2O42?)的还原性强于Fe2+。为检验这一结论,完成如下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾[K3Fe(C2O4)3?3H2O]为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3]
3?Fe3++
3C2O42?
K=6.3×10?21
ⅲ.FeC2O4?2H2O为黄色固体,微溶于水,可溶于强酸。
(实验1)通过Fe3+和C2O42?在溶液中的反应比较Fe2+和C2O42?的还原性强弱。
操作
现象
在避光处,向10
mL
0.5
mol·L?1
FeCl3溶液中缓慢加入0.5
mol·L?1
K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤
得到翠绿色溶液和翠绿色晶体
(1)C2O42?中碳元素的化合价是______。
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______。
(3)经检验,翠绿色晶体为K3Fe(C2O4)3?3H2O。设计实验,确认实验1中没有发生氧化还原反应的操作和现象是______。实验1中未发生氧化还原反应的原因是______。
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:[Fe(C2O4)3]3?+H2O
FeC2O4?2H2O↓+
______
+______。_________
(实验2)通过比较H2O2与Fe2+、C2O42?反应的难易,判断二者还原性的强弱。
步骤
操作
现象
Ⅰ
向1
mL
0.5
mol·L?1
FeSO4溶液中加入1
mL
0.5
mol·L?1
K2C2O4溶液,过滤
立即产生黄色沉淀
Ⅱ
洗涤Ⅰ中的黄色沉淀,向其中加入过量的
6%
H2O2溶液,振荡,静置
剧烈放热,产生大量的红褐色沉淀和无色气体
Ⅲ
待充分反应后,向其中加入稀硫酸,调节pH约为4
得到翠绿色溶液
(5)证明Fe2+被氧化的实验现象是______。
(6)以上现象能否说明C2O42?没有被氧化。请判断并说明理由:______。
(实验3)通过其他实验方案比较Fe2+和C2O42?的还原性强弱。
(7)用FeCl3溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42?的还原性强弱。画出装置图并描述预期现象:______。
五、计算题
23.在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
参考答案
1.A
2.D
3.B
4.C
5.B
6.A
7.A
8.A
9.D
10.D
11.C
12.B
13.A
14.A
15.B
16.①
③
④
②
原电池
Zn
Zn
Cu
17.<
硅原子之间通过共价键结合,形成空间立体网状结构的原子晶体
18.是
b
1.5×10-3mol?L-1?s-1
a、d
19.第2周期、第VA族
共价键
电子层数O与N相同,核电荷数O大于N,原子半径O小于N
①
③
20.3A2B
0.1mol/(L·min)
>
BD
21.O
极性
NH4NO3
NaH+H2O=NaOH+H2↑
NH5+HCl=NH4Cl+H2↑
22.+3
溶液中存在平衡:[Fe(C2O4)3]3-Fe3++3C2O42-,加入硫酸后,H+与C2O42-结合生成H2C2O4,使平衡正向移动,c(Fe3+)增大,遇KSCN溶液变红
取少量实验1中的翠绿色溶液,滴加K3Fe(CN)6溶液,不出现蓝色沉淀
Fe3+与C2O42-生成稳定的[Fe(C2O4)]3-,浓度降低,Fe3+的氧化性和C2O42-的还原性减弱
2;4;2
;3C2O42-
;
2CO2
Ⅱ中产生大量红褐色沉淀或Ⅲ中得到翠绿色溶液
不能说明。有+4价碳的化合物生成,才能说明C2O42-被氧化,以上现象无法判断是否生成了+4价碳的化合物,因此不能说明C2O42-没有被氧化
电流计的指针偏转,电池工作一段时间后,取少量左侧烧杯中的溶液,滴加K3Fe(CN)6溶液,出现蓝色沉淀
23.0.0010mol?L-1?s-1
大于
1.3mol/L
