2021浙教版科学“中考二轮专题突破”讲义(一):化学工艺流程【word,含答案】
文档属性
| 名称 | 2021浙教版科学“中考二轮专题突破”讲义(一):化学工艺流程【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 642.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-04-27 19:59:29 | ||
图片预览


文档简介
【题型特点】
1. 考查内容
(1)涉及操作名称:煅烧、溶解、过滤、蒸发等。
(2)操作目的:粉碎(或研磨)的目的是增大反应物之间的接触面积;加入过量试剂的目的是将原物质中的杂质完全反应。
(3)可循环利用的物质:根据流程图中涉及物质及图示中显示的箭头方向进行判断,一般为辅助试剂、母液,一定不会是目标产物和杂质。
(4)化学方程式书写:根据箭头方向,箭头进入的是投料即反应物,出去的是生成物(包括主产物和副产物);或根据题中信息给出的反应物和生成物,若不满足质量守恒定律,可以在反应物或生成物中加上水,进行书写、配平,注意反应条件的有关信息;若在空气中煅烧或通入空气则需要考虑氧气是否参与反应。
2. 涉及图示的关注重点
(1)关注“箭头”:箭头进入的是投料即反应物,出去的是生成物(包括主产物和副产物)。
(2)关注流程“三线”和“核心”。
三线:出线和进线均表示物料流向或操作流程,可逆线表示物质可循环使用。
【解题技巧】
(1)根据题干提取有用信息,确定流程图中的第一种物质(原材料)与最后一种物质(产品),从对比分析中找出原料与产品之间的关系。
(2)从以下几个方面分析流程图中的每一个步骤:
①反应物及生成物是什么;
②发生了什么反应;
③该反应对最终生成目标产物起到什么作用,反应是否符合绿色化学思想。
(3)弄清生产流程过程中原料转化为产品的基本原理和除杂、分离提纯产品的化工工艺,然后再结合题设的问题,逐一推敲解答。当把生产的主线弄清楚了,围绕生产主线所设计的系列问题也就可解答了。
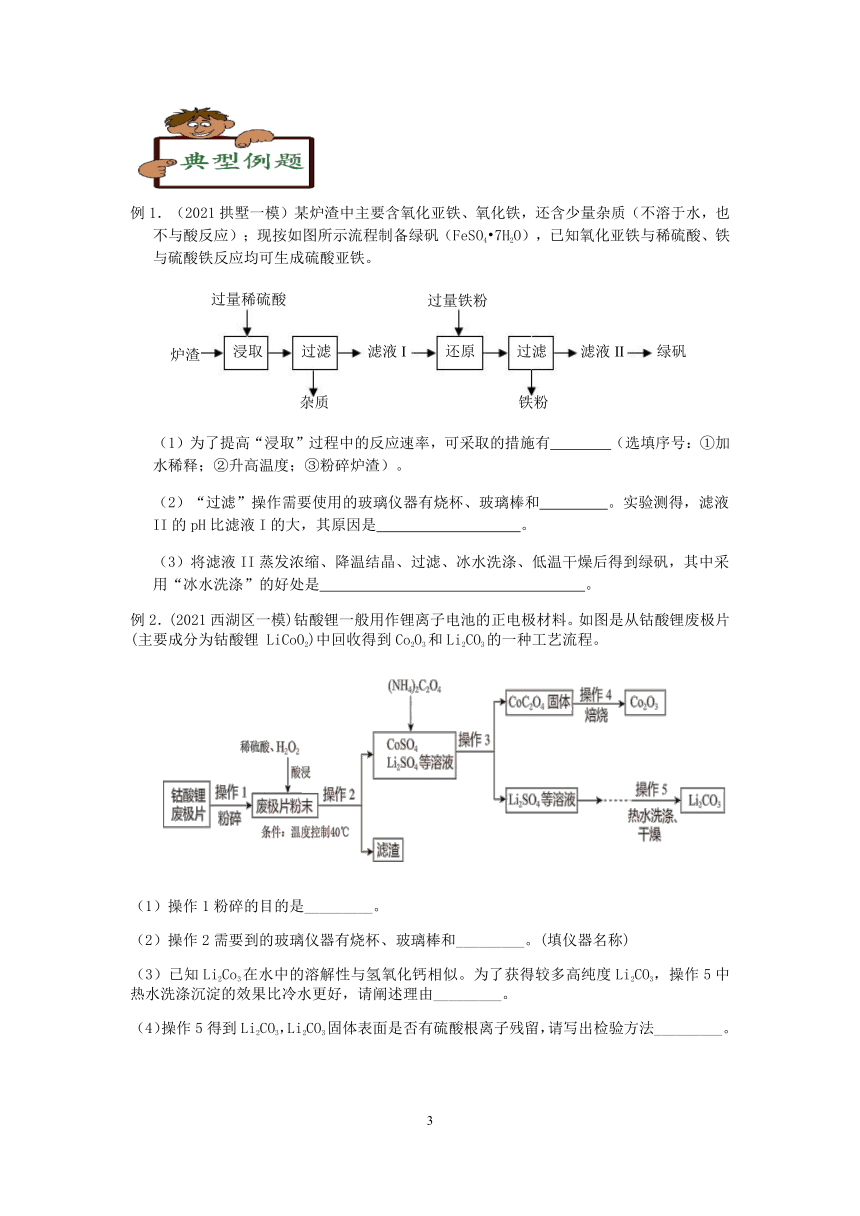
例1.(2021拱墅一模)某炉渣中主要含氧化亚铁、氧化铁,还含少量杂质(不溶于水,也不与酸反应);现按如图所示流程制备绿矾(FeSO4?7H2O),已知氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)为了提高“浸取”过程中的反应速率,可采取的措施有 (选填序号:①加水稀释;②升高温度;③粉碎炉渣)。
(2)“过滤”操作需要使用的玻璃仪器有烧杯、玻璃棒和 。实验测得,滤液II的pH比滤液I的大,其原因是 。
(3)将滤液II蒸发浓缩、降温结晶、过滤、冰水洗涤、低温干燥后得到绿矾,其中采用“冰水洗涤”的好处是 。
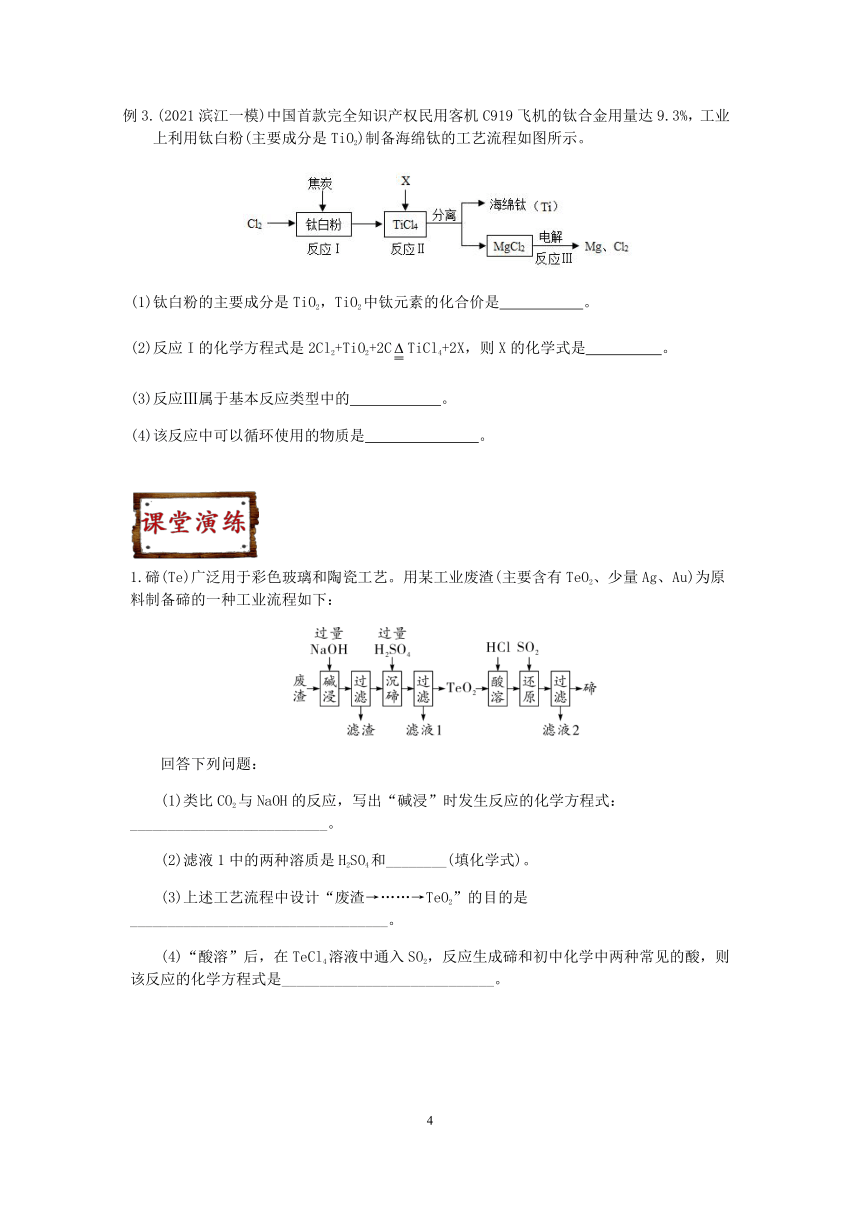
例2.(2021西湖区一模)钴酸锂一般用作锂离子电池的正电极材料。如图是从钴酸锂废极片(主要成分为钴酸锂 LiCoO2)中回收得到Co2O3和Li2CO3的一种工艺流程。
(1)操作1粉碎的目的是_________。
(2)操作2需要到的玻璃仪器有烧杯、玻璃棒和_________。(填仪器名称)
(3)已知Li2Co3在水中的溶解性与氢氧化钙相似。为了获得较多高纯度Li2CO3,操作5中热水洗涤沉淀的效果比冷水更好,请阐述理由_________。
(4)操作5得到Li2CO3,Li2CO3固体表面是否有硫酸根离子残留,请写出检验方法_________。
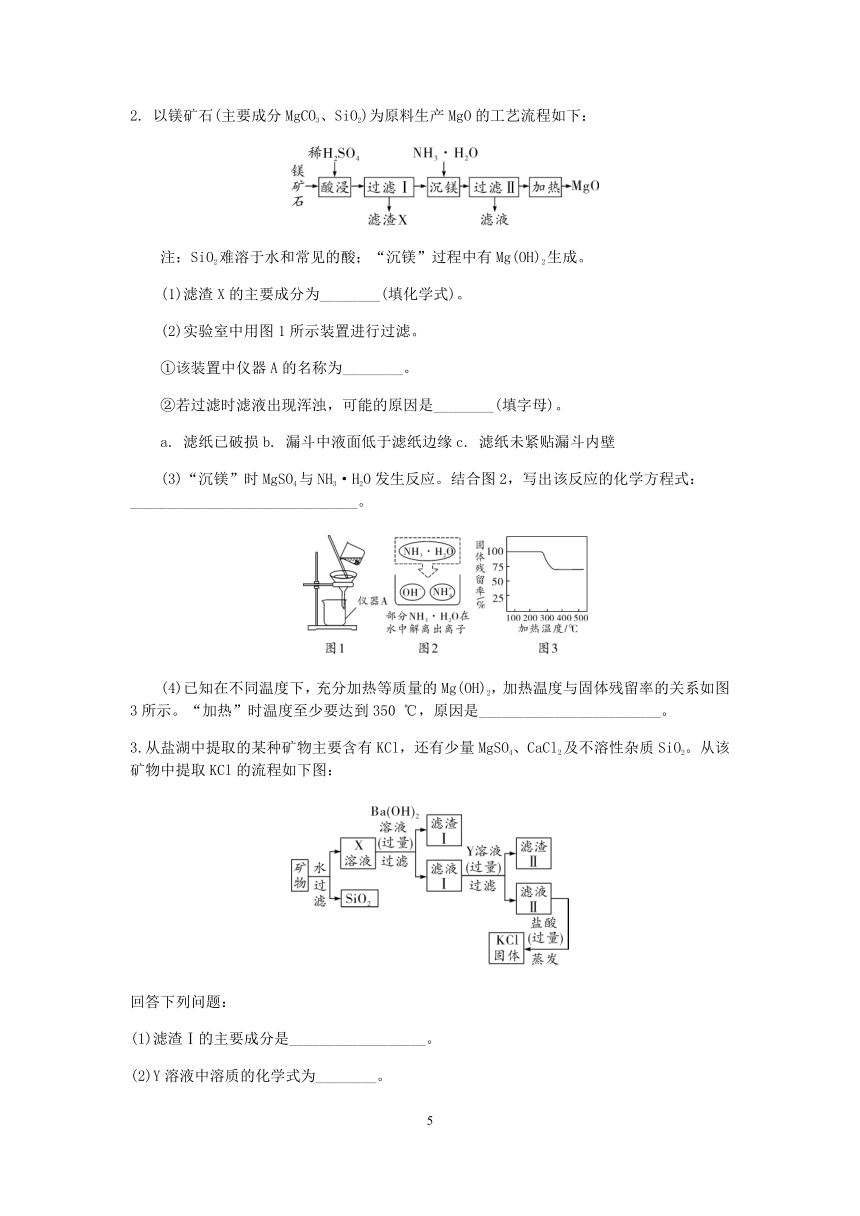
例3.(2021滨江一模)中国首款完全知识产权民用客机C919飞机的钛合金用量达9.3%,工业上利用钛白粉(主要成分是TiO2)制备海绵钛的工艺流程如图所示。
(1)钛白粉的主要成分是TiO2,TiO2中钛元素的化合价是 。
(2)反应I的化学方程式是2Cl2+TiO2+2CTiCl4+2X,则X的化学式是 。
(3)反应Ⅲ属于基本反应类型中的 。
(4)该反应中可以循环使用的物质是 。
1.碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲的一种工业流程如下:
回答下列问题:
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式:__________________________。
(2)滤液1中的两种溶质是H2SO4和________(填化学式)。
(3)上述工艺流程中设计“废渣→……→TeO2”的目的是__________________________________。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是____________________________。
2. 以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如下:
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为________(填化学式)。
(2)实验室中用图1所示装置进行过滤。
①该装置中仪器A的名称为________。
②若过滤时滤液出现浑浊,可能的原因是________(填字母)。
a. 滤纸已破损b. 漏斗中液面低于滤纸边缘c. 滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3·H2O发生反应。结合图2,写出该反应的化学方程式:______________________________。
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如图3所示。“加热”时温度至少要达到350 ℃,原因是________________________。
3.从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2。从该矿物中提取KCl的流程如下图:
回答下列问题:
(1)滤渣Ⅰ的主要成分是__________________。
(2)Y溶液中溶质的化学式为________。
(3)向滤液Ⅱ中加入过量盐酸的目的是________________________________。
(4)蒸发溶液得到KCl固体的过程中,要用玻璃棒不断搅拌,目的是______________________。
4.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:
(1)过滤操作中用到的所有玻璃仪器为______________________。
(2)Ⅰ中有关反应的化学方程式_____________________。
(3)溶液B中所含的溶质是________________;固体A的成分是________(均填化学式)。
(4)Ⅱ中加入过量的稀硫酸的目的是______________________。
5. 某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如下:
回答下列问题:
(1)溶液A中所含的阳离子有Fe3+、Cu2+、 Mg2+和________(填离子符号)。
(2)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 Fe3+ Cu2+ Mg2+
开始沉淀时的pH 1.9 4.2 9.1
完全沉淀时的pH 3.2 6.7 11.1
步骤②加入熟石灰,调节溶液的pH范围为________________,固体C中所含成分的化学式为________________________。
(3)步骤③制得Mg(OH)2的化学方程式为_______________________________。
1、氧化锌(ZnO)是一种重要而且使用广泛的物理防晒剂,还有抗菌和抗炎的作用,是目前防晒剂评价中最安全有效的成分,其生产工艺如下。
(1)气体B在点燃前必须进行的操作是________。
(2)步骤Ⅱ需要进行一种操作将ZnC2O4和溶液C分离,该操作的名称是 ,在实验室进行该操作时,用到的玻璃仪器是烧杯、玻璃棒和 。
(3)已知ZnC2O4是一种沉淀,请写出步骤Ⅱ发生反应的化学方程式_____________。
(4)请写出溶液C的一种用途________________________________。
(5)气体D中是两种氧化物,一种是二氧化碳,另一种是 。(写化学式)
2.利用电石渣[主要成分为Ca(OH)2、MgO]制备硫酸钙的主要工艺流程如下:
已知:MgO难溶于水;MgSO4易溶于水;CaSO4微溶于水。
(1)反应器中搅拌的目的是__________________。
(2)反应器中发生的反应主要有MgO+H2SO4===MgSO4+H2O和______________________。
(3)上述流程中,用于分离提纯的设备有__________。
3.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣Ⅰ中一定有________。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是____________________________。此过程中Zn还能起到除铜作用,除铜的化学方程式为____________________,此反应属________(填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是__________________________________________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为____________________________。
4.做完木炭还原氧化铁实验后的混合物中含有铁、氧化铁和木炭粉,某化学兴趣小组同学对该混合物进行如下实验,以获得FeSO4晶体。
已知:Fe2(SO4)3+Fe === 3FeSO4
请回答:(1)操作Ⅰ的名称是________。
(2)步骤①中发生复分解反应的化学方程式是_________________________。
(3)步骤②中加入过量铁粉的目的是______________________________。
参考答案
(1) ②③。(2)漏斗。滤液I中稀硫酸过量,而滤液II中稀硫酸已转化为硫酸亚铁(合理即可)。(3)可减少绿矾的溶解损失。
例2.(1)增大钴酸锂废极片和稀硫酸、H2O2 的接触面积,使反应更加充分;(2)漏斗;
(3)温度高,Li2CO3 的溶解度小,用热水洗涤可以减少 Li2CO3 的损失,得到较多高纯度 Li2CO3;(4)取最后一次洗涤液于试管中,加入足量稀硝酸,再加入少量 Ba(NO3)2,若出现白色沉淀,则未洗涤干净.
例3.(1)+4;(2)CO;(3)分解反应;(4)Cl2、Mg。
1.(1)TeO2+2NaOH === Na2TeO3+H2O (2)Na2SO4 (3)提纯TeO2(或除去Ag、Au等合理即可) (4)2SO2+TeCl4+4H2O === 4HCl+2H2SO4+Te↓
2. (1)SiO2 (2)①烧杯 ②a (3)MgSO4+2NH3·H2O === (NH4)2SO4+Mg(OH)2↓ (4)低于350 ℃时Mg(OH)2未完全分解,所得的MgO不纯
3.(1)氢氧化镁、硫酸钡 (2)K2CO3 (3)除去溶液中的碳酸钾和氢氧化钾 (4)防止因局部温度过高,造成液滴飞溅
4.(1)烧杯、漏斗、玻璃棒 (2)Fe+CuSO4=== FeSO4+Cu (3)Al2(SO4)3、FeSO4 Fe、Cu (4)除去固体A中的铁
5.(1)H+ (2)6.7~9.1 Fe(OH)3和Cu(OH)2
(3)MgCl2+Ca(OH)2 === Mg(OH)2↓+CaCl2
1、检验气体纯度 (2)过滤 漏斗 (3)ZnCl2+(NH4)2C2O4=== ZnC2O4↓+2NH4Cl (4)用作化肥(合理即可) (5)CO
2. (1)使反应物充分接触,反应更充分,加快反应速率 (2)H2SO4+Ca(OH)2 === CaSO4+ 2H2O (3)过滤器和洗涤槽
3.(1)Cu(或铜) (2)溶解过程会产生氢气,氢气不纯遇明火会爆炸 CuSO4+Zn=== Cu+ZnSO4 置换反应 (3)NaOH会与Zn(OH)2反应生成可溶性盐,导致产率降低 (4)Zn(OH)2 ZnO+H2O↑
4. (1)过滤 (2)Fe2O3 +3H2SO4=== Fe2(SO4)3 + 3H2O
(3)将过量的稀硫酸和Fe2(SO4)3全部转化为FeSO4
1. 考查内容
(1)涉及操作名称:煅烧、溶解、过滤、蒸发等。
(2)操作目的:粉碎(或研磨)的目的是增大反应物之间的接触面积;加入过量试剂的目的是将原物质中的杂质完全反应。
(3)可循环利用的物质:根据流程图中涉及物质及图示中显示的箭头方向进行判断,一般为辅助试剂、母液,一定不会是目标产物和杂质。
(4)化学方程式书写:根据箭头方向,箭头进入的是投料即反应物,出去的是生成物(包括主产物和副产物);或根据题中信息给出的反应物和生成物,若不满足质量守恒定律,可以在反应物或生成物中加上水,进行书写、配平,注意反应条件的有关信息;若在空气中煅烧或通入空气则需要考虑氧气是否参与反应。
2. 涉及图示的关注重点
(1)关注“箭头”:箭头进入的是投料即反应物,出去的是生成物(包括主产物和副产物)。
(2)关注流程“三线”和“核心”。
三线:出线和进线均表示物料流向或操作流程,可逆线表示物质可循环使用。
【解题技巧】
(1)根据题干提取有用信息,确定流程图中的第一种物质(原材料)与最后一种物质(产品),从对比分析中找出原料与产品之间的关系。
(2)从以下几个方面分析流程图中的每一个步骤:
①反应物及生成物是什么;
②发生了什么反应;
③该反应对最终生成目标产物起到什么作用,反应是否符合绿色化学思想。
(3)弄清生产流程过程中原料转化为产品的基本原理和除杂、分离提纯产品的化工工艺,然后再结合题设的问题,逐一推敲解答。当把生产的主线弄清楚了,围绕生产主线所设计的系列问题也就可解答了。
例1.(2021拱墅一模)某炉渣中主要含氧化亚铁、氧化铁,还含少量杂质(不溶于水,也不与酸反应);现按如图所示流程制备绿矾(FeSO4?7H2O),已知氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)为了提高“浸取”过程中的反应速率,可采取的措施有 (选填序号:①加水稀释;②升高温度;③粉碎炉渣)。
(2)“过滤”操作需要使用的玻璃仪器有烧杯、玻璃棒和 。实验测得,滤液II的pH比滤液I的大,其原因是 。
(3)将滤液II蒸发浓缩、降温结晶、过滤、冰水洗涤、低温干燥后得到绿矾,其中采用“冰水洗涤”的好处是 。
例2.(2021西湖区一模)钴酸锂一般用作锂离子电池的正电极材料。如图是从钴酸锂废极片(主要成分为钴酸锂 LiCoO2)中回收得到Co2O3和Li2CO3的一种工艺流程。
(1)操作1粉碎的目的是_________。
(2)操作2需要到的玻璃仪器有烧杯、玻璃棒和_________。(填仪器名称)
(3)已知Li2Co3在水中的溶解性与氢氧化钙相似。为了获得较多高纯度Li2CO3,操作5中热水洗涤沉淀的效果比冷水更好,请阐述理由_________。
(4)操作5得到Li2CO3,Li2CO3固体表面是否有硫酸根离子残留,请写出检验方法_________。
例3.(2021滨江一模)中国首款完全知识产权民用客机C919飞机的钛合金用量达9.3%,工业上利用钛白粉(主要成分是TiO2)制备海绵钛的工艺流程如图所示。
(1)钛白粉的主要成分是TiO2,TiO2中钛元素的化合价是 。
(2)反应I的化学方程式是2Cl2+TiO2+2CTiCl4+2X,则X的化学式是 。
(3)反应Ⅲ属于基本反应类型中的 。
(4)该反应中可以循环使用的物质是 。
1.碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲的一种工业流程如下:
回答下列问题:
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式:__________________________。
(2)滤液1中的两种溶质是H2SO4和________(填化学式)。
(3)上述工艺流程中设计“废渣→……→TeO2”的目的是__________________________________。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是____________________________。
2. 以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如下:
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为________(填化学式)。
(2)实验室中用图1所示装置进行过滤。
①该装置中仪器A的名称为________。
②若过滤时滤液出现浑浊,可能的原因是________(填字母)。
a. 滤纸已破损b. 漏斗中液面低于滤纸边缘c. 滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3·H2O发生反应。结合图2,写出该反应的化学方程式:______________________________。
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如图3所示。“加热”时温度至少要达到350 ℃,原因是________________________。
3.从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2。从该矿物中提取KCl的流程如下图:
回答下列问题:
(1)滤渣Ⅰ的主要成分是__________________。
(2)Y溶液中溶质的化学式为________。
(3)向滤液Ⅱ中加入过量盐酸的目的是________________________________。
(4)蒸发溶液得到KCl固体的过程中,要用玻璃棒不断搅拌,目的是______________________。
4.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:
(1)过滤操作中用到的所有玻璃仪器为______________________。
(2)Ⅰ中有关反应的化学方程式_____________________。
(3)溶液B中所含的溶质是________________;固体A的成分是________(均填化学式)。
(4)Ⅱ中加入过量的稀硫酸的目的是______________________。
5. 某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如下:
回答下列问题:
(1)溶液A中所含的阳离子有Fe3+、Cu2+、 Mg2+和________(填离子符号)。
(2)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 Fe3+ Cu2+ Mg2+
开始沉淀时的pH 1.9 4.2 9.1
完全沉淀时的pH 3.2 6.7 11.1
步骤②加入熟石灰,调节溶液的pH范围为________________,固体C中所含成分的化学式为________________________。
(3)步骤③制得Mg(OH)2的化学方程式为_______________________________。
1、氧化锌(ZnO)是一种重要而且使用广泛的物理防晒剂,还有抗菌和抗炎的作用,是目前防晒剂评价中最安全有效的成分,其生产工艺如下。
(1)气体B在点燃前必须进行的操作是________。
(2)步骤Ⅱ需要进行一种操作将ZnC2O4和溶液C分离,该操作的名称是 ,在实验室进行该操作时,用到的玻璃仪器是烧杯、玻璃棒和 。
(3)已知ZnC2O4是一种沉淀,请写出步骤Ⅱ发生反应的化学方程式_____________。
(4)请写出溶液C的一种用途________________________________。
(5)气体D中是两种氧化物,一种是二氧化碳,另一种是 。(写化学式)
2.利用电石渣[主要成分为Ca(OH)2、MgO]制备硫酸钙的主要工艺流程如下:
已知:MgO难溶于水;MgSO4易溶于水;CaSO4微溶于水。
(1)反应器中搅拌的目的是__________________。
(2)反应器中发生的反应主要有MgO+H2SO4===MgSO4+H2O和______________________。
(3)上述流程中,用于分离提纯的设备有__________。
3.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣Ⅰ中一定有________。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是____________________________。此过程中Zn还能起到除铜作用,除铜的化学方程式为____________________,此反应属________(填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是__________________________________________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为____________________________。
4.做完木炭还原氧化铁实验后的混合物中含有铁、氧化铁和木炭粉,某化学兴趣小组同学对该混合物进行如下实验,以获得FeSO4晶体。
已知:Fe2(SO4)3+Fe === 3FeSO4
请回答:(1)操作Ⅰ的名称是________。
(2)步骤①中发生复分解反应的化学方程式是_________________________。
(3)步骤②中加入过量铁粉的目的是______________________________。
参考答案
(1) ②③。(2)漏斗。滤液I中稀硫酸过量,而滤液II中稀硫酸已转化为硫酸亚铁(合理即可)。(3)可减少绿矾的溶解损失。
例2.(1)增大钴酸锂废极片和稀硫酸、H2O2 的接触面积,使反应更加充分;(2)漏斗;
(3)温度高,Li2CO3 的溶解度小,用热水洗涤可以减少 Li2CO3 的损失,得到较多高纯度 Li2CO3;(4)取最后一次洗涤液于试管中,加入足量稀硝酸,再加入少量 Ba(NO3)2,若出现白色沉淀,则未洗涤干净.
例3.(1)+4;(2)CO;(3)分解反应;(4)Cl2、Mg。
1.(1)TeO2+2NaOH === Na2TeO3+H2O (2)Na2SO4 (3)提纯TeO2(或除去Ag、Au等合理即可) (4)2SO2+TeCl4+4H2O === 4HCl+2H2SO4+Te↓
2. (1)SiO2 (2)①烧杯 ②a (3)MgSO4+2NH3·H2O === (NH4)2SO4+Mg(OH)2↓ (4)低于350 ℃时Mg(OH)2未完全分解,所得的MgO不纯
3.(1)氢氧化镁、硫酸钡 (2)K2CO3 (3)除去溶液中的碳酸钾和氢氧化钾 (4)防止因局部温度过高,造成液滴飞溅
4.(1)烧杯、漏斗、玻璃棒 (2)Fe+CuSO4=== FeSO4+Cu (3)Al2(SO4)3、FeSO4 Fe、Cu (4)除去固体A中的铁
5.(1)H+ (2)6.7~9.1 Fe(OH)3和Cu(OH)2
(3)MgCl2+Ca(OH)2 === Mg(OH)2↓+CaCl2
1、检验气体纯度 (2)过滤 漏斗 (3)ZnCl2+(NH4)2C2O4=== ZnC2O4↓+2NH4Cl (4)用作化肥(合理即可) (5)CO
2. (1)使反应物充分接触,反应更充分,加快反应速率 (2)H2SO4+Ca(OH)2 === CaSO4+ 2H2O (3)过滤器和洗涤槽
3.(1)Cu(或铜) (2)溶解过程会产生氢气,氢气不纯遇明火会爆炸 CuSO4+Zn=== Cu+ZnSO4 置换反应 (3)NaOH会与Zn(OH)2反应生成可溶性盐,导致产率降低 (4)Zn(OH)2 ZnO+H2O↑
4. (1)过滤 (2)Fe2O3 +3H2SO4=== Fe2(SO4)3 + 3H2O
(3)将过量的稀硫酸和Fe2(SO4)3全部转化为FeSO4
