2021年中考复习溶解度曲线图像问题
图片预览
文档简介
溶解度曲线的图像问题
回顾复习
固体物质溶解度定义:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。若不指名溶剂,通常所说的溶解度是指物质在水里的溶解度。
溶解度曲线
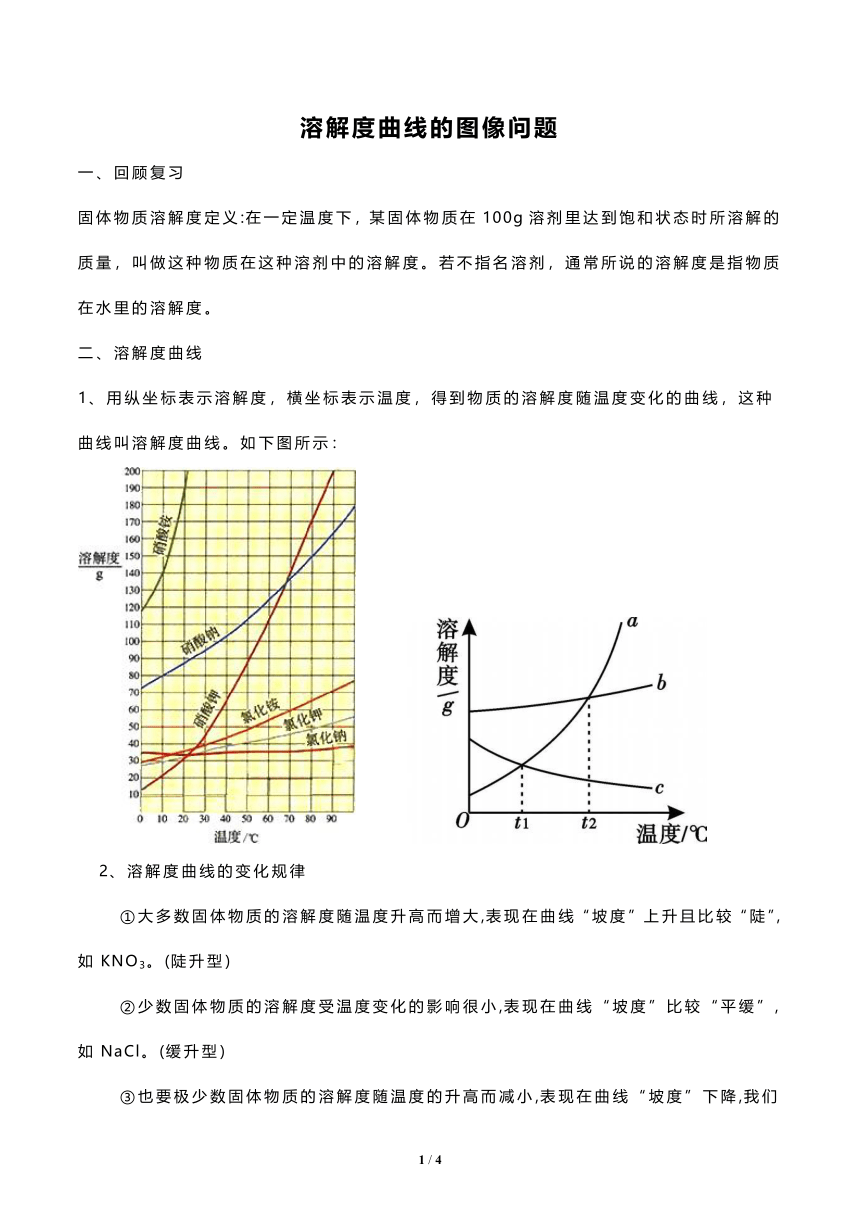
1、用纵坐标表示溶解度,横坐标表示温度,得到物质的溶解度随温度变化的曲线,这种曲线叫溶解度曲线。如下图所示:
2、溶解度曲线的变化规律
①大多数固体物质的溶解度随温度升高而增大,表现在曲线“坡度”上升且比较“陡”,如KNO3。(陡升型)
②少数固体物质的溶解度受温度变化的影响很小,表现在曲线“坡度”比较“平缓”,如NaCl。(缓升型)
③也要极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,我们需要特殊记忆如Ca(OH)2。(下降型)
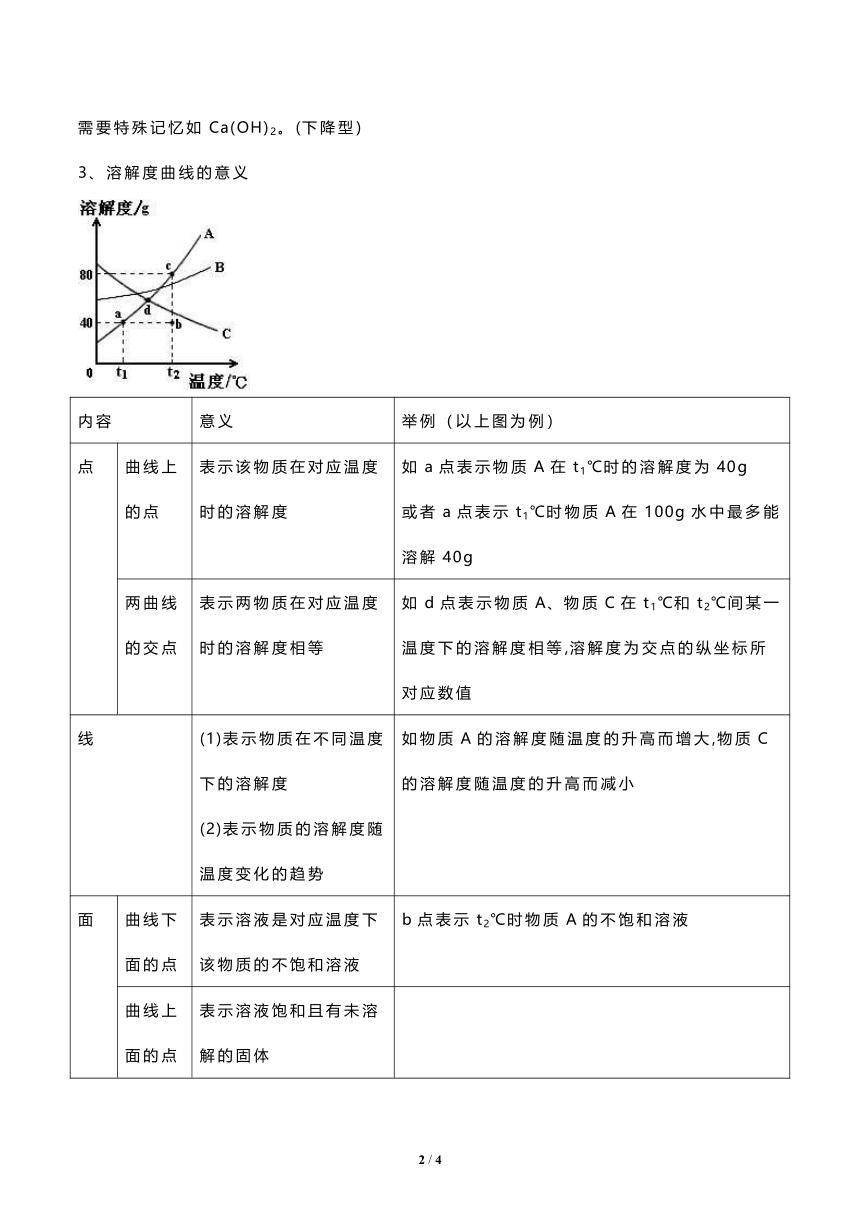
溶解度曲线的意义
内容 意义 举例(以上图为例)
点 曲线上的点 表示该物质在对应温度时的溶解度 如a点表示物质A在t1℃时的溶解度为40g
或者a点表示t1℃时物质A在100g水中最多能溶解40g
两曲线的交点 表示两物质在对应温度时的溶解度相等 如d点表示物质A、物质C在t1℃和t2℃间某一温度下的溶解度相等,溶解度为交点的纵坐标所对应数值
线 (1)表示物质在不同温度下的溶解度
(2)表示物质的溶解度随温度变化的趋势 如物质A的溶解度随温度的升高而增大,物质C的溶解度随温度的升高而减小
面 曲线下面的点 表示溶液是对应温度下该物质的不饱和溶液 b点表示t2℃时物质A的不饱和溶液
曲线上面的点 表示溶液饱和且有未溶解的固体
按此配成的溶液中固体物质有剩余
溶解度曲线的应用
①查出某种物质在某温度时的溶解度。
②可以看出物质的溶解度随温度变化的规律。
③比较不同物质在同一温度时的溶解度大小。
④可以比较不同物质的溶解度受温度变化影响的大小。
⑤根据溶解度曲线确定如何制得某温度时的该物质的饱和溶液⑥由溶解度曲线可确定从溶液中析出晶体的方法。
例题
1、如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.甲的溶解度等于乙的溶解度
B.升高温度可将甲的不饱和溶液变为饱和溶液
C.20℃时,100g乙的饱和溶液中溶质质量是30g
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是
A. 甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B. 将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C. 甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D. t1℃时,30g丙物质加入到50g水中形成溶液的质量为80g
答案:1.A、由溶解度曲线图可看出,当温度高于20℃时,甲物质的溶解度大于乙物质的溶解度,当温度低于20℃时,甲物质的溶解度小于乙物质的溶解度,故A错误;
B、由溶解度曲线不难看出,甲物质的溶解度随温度的升高而逐渐增大,所以要将其不饱和溶液变为饱和溶液应该降低温度,故错误;
C、20℃时乙物质的溶解度为30g,即30g乙溶于100g水中所得溶液为饱和溶液,所得饱和溶液的质量是130g,故100g乙的饱和溶液中溶质质量要小于30g,故C错误;
D、观溶解度曲线可知:40℃时,甲物质的溶解度大于乙物质的溶解度;所以用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量,故D正确;
故选D.
2.A. 甲和乙两物质的饱和溶液的质量不能确定,所以温度从t3℃降至t2℃时,析出晶体质量也不能确定,故A错误;
B. 丙物质的溶解度随温度的升高而减小,所以将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法,故B正确;
C. 甲物质的溶解度受温度变化影响较大,所以甲中含少量乙时,采用降温结晶的方法提纯甲,故C错误;
D. t1℃时,丙物质的溶解度是40g,所以30g丙物质加入到50g水中形成溶液的质量为70g,故D错误。
故选:B。
2 / 4
回顾复习
固体物质溶解度定义:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。若不指名溶剂,通常所说的溶解度是指物质在水里的溶解度。
溶解度曲线
1、用纵坐标表示溶解度,横坐标表示温度,得到物质的溶解度随温度变化的曲线,这种曲线叫溶解度曲线。如下图所示:
2、溶解度曲线的变化规律
①大多数固体物质的溶解度随温度升高而增大,表现在曲线“坡度”上升且比较“陡”,如KNO3。(陡升型)
②少数固体物质的溶解度受温度变化的影响很小,表现在曲线“坡度”比较“平缓”,如NaCl。(缓升型)
③也要极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,我们需要特殊记忆如Ca(OH)2。(下降型)
溶解度曲线的意义
内容 意义 举例(以上图为例)
点 曲线上的点 表示该物质在对应温度时的溶解度 如a点表示物质A在t1℃时的溶解度为40g
或者a点表示t1℃时物质A在100g水中最多能溶解40g
两曲线的交点 表示两物质在对应温度时的溶解度相等 如d点表示物质A、物质C在t1℃和t2℃间某一温度下的溶解度相等,溶解度为交点的纵坐标所对应数值
线 (1)表示物质在不同温度下的溶解度
(2)表示物质的溶解度随温度变化的趋势 如物质A的溶解度随温度的升高而增大,物质C的溶解度随温度的升高而减小
面 曲线下面的点 表示溶液是对应温度下该物质的不饱和溶液 b点表示t2℃时物质A的不饱和溶液
曲线上面的点 表示溶液饱和且有未溶解的固体
按此配成的溶液中固体物质有剩余
溶解度曲线的应用
①查出某种物质在某温度时的溶解度。
②可以看出物质的溶解度随温度变化的规律。
③比较不同物质在同一温度时的溶解度大小。
④可以比较不同物质的溶解度受温度变化影响的大小。
⑤根据溶解度曲线确定如何制得某温度时的该物质的饱和溶液⑥由溶解度曲线可确定从溶液中析出晶体的方法。
例题
1、如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.甲的溶解度等于乙的溶解度
B.升高温度可将甲的不饱和溶液变为饱和溶液
C.20℃时,100g乙的饱和溶液中溶质质量是30g
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是
A. 甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B. 将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C. 甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D. t1℃时,30g丙物质加入到50g水中形成溶液的质量为80g
答案:1.A、由溶解度曲线图可看出,当温度高于20℃时,甲物质的溶解度大于乙物质的溶解度,当温度低于20℃时,甲物质的溶解度小于乙物质的溶解度,故A错误;
B、由溶解度曲线不难看出,甲物质的溶解度随温度的升高而逐渐增大,所以要将其不饱和溶液变为饱和溶液应该降低温度,故错误;
C、20℃时乙物质的溶解度为30g,即30g乙溶于100g水中所得溶液为饱和溶液,所得饱和溶液的质量是130g,故100g乙的饱和溶液中溶质质量要小于30g,故C错误;
D、观溶解度曲线可知:40℃时,甲物质的溶解度大于乙物质的溶解度;所以用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量,故D正确;
故选D.
2.A. 甲和乙两物质的饱和溶液的质量不能确定,所以温度从t3℃降至t2℃时,析出晶体质量也不能确定,故A错误;
B. 丙物质的溶解度随温度的升高而减小,所以将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法,故B正确;
C. 甲物质的溶解度受温度变化影响较大,所以甲中含少量乙时,采用降温结晶的方法提纯甲,故C错误;
D. t1℃时,丙物质的溶解度是40g,所以30g丙物质加入到50g水中形成溶液的质量为70g,故D错误。
故选:B。
2 / 4
同课章节目录
