新疆乌市第四高中2020-2021学年高一年级下学期期中考试化学试卷 Word版含答案
文档属性
| 名称 | 新疆乌市第四高中2020-2021学年高一年级下学期期中考试化学试卷 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 393.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-27 21:44:35 | ||
图片预览



文档简介
第四中学2020~2021学年下学期期中阶段性诊断测试
高一《 化学 》试卷
考试时间 80分钟 试题分数:100分 用钢笔或中性笔答卷,不许用铅笔答卷;只交答题卷。
可能用到的相对原子质量:H-1 O-16 S-32 Na-23? Mn-55? Ag-108
Ⅰ卷(选择题 共50分)
一、选择题(每小题只一个选项符合题意)
1、下列说法正确的是
A.流水、风力、蒸汽是一次能源,电力是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.铅蓄电池是二次电池,氢氧燃料电池的活性物质储存在电池内部
D.废旧电池的集中处理的主要目的是防止电池中的重金属污染水源及土壤
2、下列不能作为判断金属性强弱依据的是
A.金属元素单质的沸点高低 B.金属活动性顺序表中金属的位置
C.金属与水反应置换出氢气的难易程度 D.最高价氧化物对应水化物的碱性强弱
3、理想中的新能源应具有资源丰富、可以再生、对环境无污染等特点。下列属于理想中的新能源的是
①太阳能 ②风能 ③地热能 ④海洋能 ⑤天然气 ⑥石油
A.①②③④ B.③④⑤⑥ C.①②③⑥ D.①②④⑤
15652752825754、下列电子式书写不正确的是
A.false的电子式: B.false的电子式:false
419036560325C.false的电子式:false D.false的电子式:
5、falseU是重要的核工业原料,在自然界的丰度很低。falseU的浓缩一直为国际社会所关注。下列有关falseU的说法中正确的是
A.falseU原子核中含有92个中子 B.falseU原子核外有143个电子
C.falseU与falseU互为同位素 D.falseU与falseU互为同素异形体
6、下列说法正确的是
A.短周期共有18种核素 B.随着元素的原子序数的递增,元素的最高正价从+1到+7
C.可以在周期表中金属与非金属的分界处寻找半导体材料
D.false和false分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
7、已知某离子的结构示意图为,下列说法正确的是( )
A.该元素位于第二周期ⅡA族 B.该元素位于第二周期Ⅶ族
C.该元素位于第三周期ⅡA族 D.该元素位于第二周期0族
8、中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
化学键
H2O中H-O键
O2中O=O 键
H2中H-H键
H2O2中O-O键
H2O2中O-H键
键能kJ/mol
463
496
436
138
463
若反应过程中分解了2 mol水,则下列说法不正确的是
A.总反应为2H2Ofalse2H2↑+O2↑ B.过程I吸收了926 kJ能量
C.过程II放出了574 kJ能量 D.过程Ⅲ属于放热反应
9、下列对卤素的说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱 B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序,颜色逐渐变浅,密度逐渐增大
10、下列叙述中,正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
11、四种短周期主族元素false的原子序数依次增大,false的简单离子具有相同电子层结构,W原子的L层电子数是K层的三倍,X的原子半径是短周期主族元素原子中最大的,Y与W同族。下列说法正确的是
A.简单离子半径:false B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:false D.最高价氧化物的水化物的酸性:false
12、下列递变情况中,正确的是
A.Na、Mg、Al原子最外层电子数依次减少 B.P、S、Cl元素非金属性依次减弱
C.Li、Na、K的金属性依次增强 D.C、N、O元素最高正价依次增大
13、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
A.原子序数为34 B.还原性:H2SeC.酸性:H2SeO414、下列有关离子键和离子化合物的说法中正确的是( )
A.凡含离子键的化合物,一定含金属元素 B.强碱、盐、活泼金属氧化物不属于离子化合物
C.离子化合物一定能电离
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
15、下列物质中,含有离子键的是
A.CO2 B.KCl C.NH3 D.CH4
16、下列叙述正确的是
A.离子化合物熔融状态下一定能导电 B.金属元素与非金属元素化合时都能形成离子键
C.离子化合物中的酸根离子中不能含有金属元素 D.离子化合物中不一定含有离子键
470662011239517、下列反应中能量变化趋势与下图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合
B.中和反应
C.木炭在氧气中发生不完全燃烧
D.生石灰和水的反应
18、下列选项描述的过程能实现化学能转化为热能的是 ( )
A.汽油燃烧 B.光合作用 C.潮汐发电 D.电解水
19、某氯原子的质量为a g,12C的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量为 B.氯元素的摩尔质量为aNA
C.m g该氯原子的物质的量为 D.n g该氯原子所含的电子数为
460502026924020、N2(g)与H2(g)在一定条件下经历如下,过程生成NH3(g),下列说法正确的是( )
A.I中破坏了离子键 B.II、III、IV均为放热过程
C.IV中表示NH2与H2生成NH3 D.N2(g)+3H2(g)2NH3(g)是吸热反应
21、“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
A.③⑤⑦ B.③④⑤ C.④⑤⑦ D.②⑤⑥
22、化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:向Cu电极方向移动 B.乙:正极的电极反应式为Ag2O+2e?+H2O=2Ag+2OH?
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:电池放电过程中,硫酸浓度不断减少
445960524193523、氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是( )
A.该电池中电极a是正极
B.外电路中电子由电极a通过导线流向电极b
C.该电池的正极反应为:O2+4H++4e-=2H2O
D.该电池的总反应为:2H2+O2=2H2O
331660524130024、2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
25、液晶显示器是日常生产生活中常用的电子产品的部件之一,生产液晶显示器过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的倍,在大气中的寿命可长达740年。在和条件下,断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,而形成中的化学键要释放的能量。下列说法中正确的是
A.过程吸收能量 B.反应为放热反应
C.液态的与气态的所具有的能量相同
D.吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
Ⅱ卷(非选择题 共50分)
26、A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是_______,E2D2的电子式为_______。
(2) 元素D、E、F形成的简单离子的半径由大到小为_______(用离子符号表示)。
(3) B、D的最简单气态氢化物的稳定性:_______(用化学式表示)。
(4) 设计一个简单的实验证明F和B的非金属性强弱:_______(用化学方程式表示)。
27、依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·mol-1,下列叙述正确的是_______(填字母,下同)。
A.每生成1 mol H-Cl键放出431 kJ能量 B.每生成1 mol H-Cl键吸收431 kJ能量
C.每拆开1 mol H-Cl键放出431 kJ能量 D.每拆开1 mol H-Cl键吸收431 kJ能量
(2)已知键能:H-H键为436 kJ·mol-1;H-F键为565 kJ·mol-1;H-Cl键为431 kJ·mol-1;H-Br键为366 kJ·mol-1。则下列分子受热时最稳定的是_______。
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是_______。
A.氮气的化学性质比氧气稳定 B.常温常压下溴呈液态,碘呈固态
3886200421005C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 mol N原子和3 mol H原子生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
(2)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
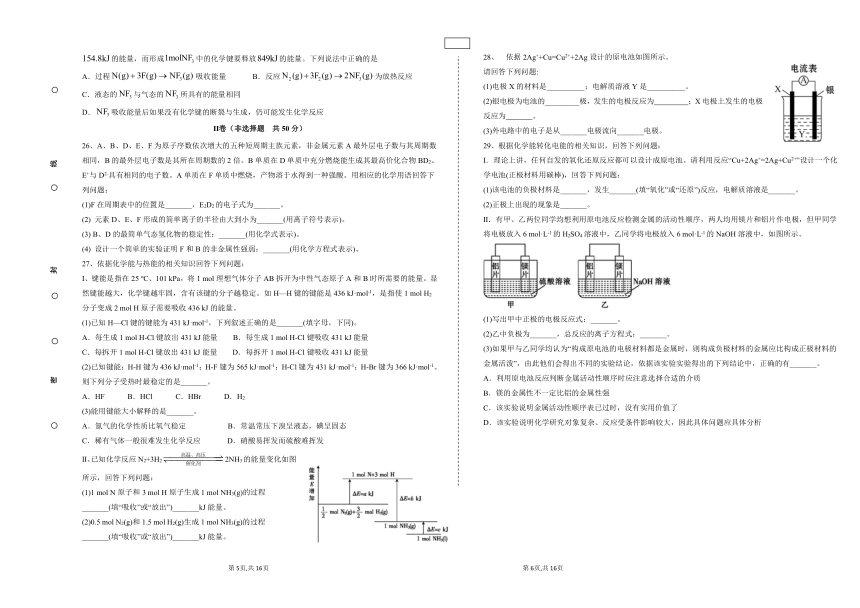
right15811528、 依据2Ag++Cu=Cu2++2Ag设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是__________。
(2)银电极为电池的_________极,发生的电极反应为 ;X电极上发生的电极反应为 。
(3)外电路中的电子是从_______电极流向_______电极。
29、根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(2)正极上出现的现象是_______。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式:_______。
(2)乙中负极为_______,总反应的离子方程式:_______。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有_______。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
第四中学2020~2021学年高一第二学期期中阶段性测试
《 化学 》试卷 答案版
考试时间 80分钟 试题分数:100分
用钢笔或中性笔答卷,不许用铅笔答卷;只交答题卷。
可能用到的相对原子质量:H-1 O-16 S-32 Na-23? Mn-55? Zn-65
Ⅰ卷(选择题 共50分)
一、选择题(每小题只一个选项符合题意)
1、下列说法正确的是
A.流水、风力、蒸汽是一次能源,电力是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.铅蓄电池是二次电池,氢氧燃料电池的活性物质储存在电池内部
D.废旧电池的集中处理的主要目的是防止电池中的重金属污染水源及土壤
【答案】D
2、下列不能作为判断金属性强弱依据的是
A.金属元素单质的沸点高低
B.金属活动性顺序表中金属的位置
C.金属与水反应置换出氢气的难易程度
D.最高价氧化物对应水化物的碱性强弱
【答案】A
3、理想中的新能源应具有资源丰富、可以再生、对环境无污染等特点。下列属于理想中的新能源的是
①太阳能 ②风能 ③地热能 ④海洋能 ⑤天然气 ⑥石油
A.①②③④ B.③④⑤⑥ C.①②③⑥ D.①②④⑤
【答案】A
4、下列电子式书写不正确的是
A.false的电子式:false B.false的电子式:false
C.false的电子式:false D.false的电子式:false
【答案】B
5、falseU是重要的核工业原料,在自然界的丰度很低。falseU的浓缩一直为国际社会所关注。下列有关falseU的说法中正确的是
A.falseU原子核中含有92个中子 B.falseU原子核外有143个电子
C.falseU与falseU互为同位素 D.falseU与falseU互为同素异形体
【答案】C
6、下列说法正确的是
A.短周期共有18种核素
B.随着元素的原子序数的递增,元素的最高正价从+1到+7
C.可以在周期表中金属与非金属的分界处寻找半导体材料
D.false和false分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
【答案】C
7、已知某离子的结构示意图为,下列说法正确的是( )
A.该元素位于第二周期ⅡA族
B.该元素位于第二周期Ⅶ族
C.该元素位于第三周期ⅡA族
D.该元素位于第二周期0族
【答案】C
8、中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
化学键
H2O中H-O键
O2中O=O 键
H2中H-H键
H2O2中O-O键
H2O2中O-H键
键能kJ/mol
463
496
436
138
463
若反应过程中分解了2 mol水,则下列说法不正确的是
A.总反应为2H2Ofalse2H2↑+O2↑ B.过程I吸收了926 kJ能量
C.过程II放出了574 kJ能量 D.过程Ⅲ属于放热反应
【答案】D
9、下列对卤素的说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序,颜色逐渐变浅,密度逐渐增大
【答案】D
10、下列叙述中,正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
【答案】B
11、四种短周期主族元素false的原子序数依次增大,false的简单离子具有相同电子层结构,W原子的L层电子数是K层的三倍,X的原子半径是短周期主族元素原子中最大的,Y与W同族。下列说法正确的是
A.简单离子半径:false B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:false D.最高价氧化物的水化物的酸性:false
【答案】B
12、下列递变情况中,正确的是
A.Na、Mg、Al原子最外层电子数依次减少
B.P、S、Cl元素非金属性依次减弱
C.Li、Na、K的金属性依次增强
D.C、N、O元素最高正价依次增大
【答案】C
13、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
A.原子序数为34
B.还原性:H2SeC.酸性:H2SeO4D.稳定性:H2Se【答案】B
14、下列有关离子键和离子化合物的说法中正确的是( )
A.凡含离子键的化合物,一定含金属元素
B.强碱、盐、活泼金属氧化物不属于离子化合物
C.离子化合物一定能电离
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
【答案】D
15、下列物质中,含有离子键的是
A.CO2 B.KCl C.NH3 D.CH4
【答案】B
16、下列叙述正确的是
A.离子化合物熔融状态下一定能导电
B.金属元素与非金属元素化合时都能形成离子键
C.离子化合物中的酸根离子中不能含有金属元素
D.离子化合物中不一定含有离子键
【答案】A
17、下列反应中能量变化趋势与下图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合
B.中和反应
C.木炭在氧气中发生不完全燃烧
D.生石灰和水的反应
【答案】A
18、下列选项描述的过程能实现化学能转化为热能的是 ( )
A.汽油燃烧 B.光合作用 C.潮汐发电 D.电解水
【答案】A
19、某氯原子的质量为a g,12C的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量为 B.氯元素的摩尔质量为aNA
C.m g该氯原子的物质的量为 D.n g该氯原子所含的电子数为
【答案】C
20、N2(g)与H2(g)在一定条件下经历如下,过程生成NH3(g),下列说法正确的是( )
A.I中破坏了离子键 B.II、III、IV均为放热过程
C.IV中表示NH2与H2生成NH3 D.N2(g)+3H2(g)2NH3(g)是吸热反应
【答案】B
21、“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
A.③⑤⑦ B.③④⑤ C.④⑤⑦ D.②⑤⑥
【答案】A
22、化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:向Cu电极方向移动
B.乙:正极的电极反应式为Ag2O+2e?+H2O=2Ag+2OH?
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:电池放电过程中,硫酸浓度不断减少
【答案】A
23、氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是( )
A.该电池中电极a是正极
B.外电路中电子由电极a通过导线流向电极b
C.该电池的正极反应为:O2+4H++4e-=2H2O
D.该电池的总反应为:2H2+O2=2H2O
【答案】A
24、2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
【答案】B
25、液晶显示器是日常生产生活中常用的电子产品的部件之一,生产液晶显示器过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的倍,在大气中的寿命可长达740年。在和条件下,断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,而形成中的化学键要释放的能量。下列说法中正确的是
A.过程吸收能量
B.反应为放热反应
C.液态的与气态的所具有的能量相同
D.吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【答案】B
Ⅱ卷(非选择题 共50分)
26、A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是_______,E2D2的电子式为_______。
(2) 元素D、E、F形成的简单离子的半径由大到小为_______(用离子符号表示)。
(3) B、D的最简单气态氢化物的稳定性:_______(用化学式表示)。
(4) 设计一个简单的实验证明F和B的非金属性强弱:_______(用化学方程式表示)。
【答案】第三周期ⅦA族 Cl->O2->Na+ H2O>CH4 Na2CO3+2HClO4=2NaClO4+CO2↑+H2O
27、依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·mol-1,下列叙述正确的是_______(填字母,下同)。
A.每生成1 mol H-Cl键放出431 kJ能量
B.每生成1 mol H-Cl键吸收431 kJ能量
C.每拆开1 mol H-Cl键放出431 kJ能量
D.每拆开1 mol H-Cl键吸收431 kJ能量
(2)已知键能:H-H键为436 kJ·mol-1;H-F键为565 kJ·mol-1;H-Cl键为431 kJ·mol-1;H-Br键为366 kJ·mol-1。则下列分子受热时最稳定的是_______。
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是_______。
A.氮气的化学性质比氧气稳定
B.常温常压下溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 mol N原子和3 mol H原子生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
(2)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
【答案】AD A A 放出 b 放出 b-a
28、 依据2Ag++Cu=Cu2++2Ag设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是__________。
(2)银电极为电池的_________极,发生的电极反应为 ;X电极上发生的电极反应为 。
(3)外电路中的电子是从_______电极流向_______电极。
【答案】铜 AgNO3 正 2Ag++2e-=2Ag Cu-2e-=Cu2+ 铜 银
29、根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(2)正极上出现的现象是_______。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式:_______。
(2)乙中负极为_______,总反应的离子方程式:_______。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有_______。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
【答案】Cu 氧化 AgNO3溶液 碳棒上出现银白色物质 2H++2e-=H2↑ Al 2Al+2OH-+2H2O=2+3H2↑ AD
高一《 化学 》试卷
考试时间 80分钟 试题分数:100分 用钢笔或中性笔答卷,不许用铅笔答卷;只交答题卷。
可能用到的相对原子质量:H-1 O-16 S-32 Na-23? Mn-55? Ag-108
Ⅰ卷(选择题 共50分)
一、选择题(每小题只一个选项符合题意)
1、下列说法正确的是
A.流水、风力、蒸汽是一次能源,电力是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.铅蓄电池是二次电池,氢氧燃料电池的活性物质储存在电池内部
D.废旧电池的集中处理的主要目的是防止电池中的重金属污染水源及土壤
2、下列不能作为判断金属性强弱依据的是
A.金属元素单质的沸点高低 B.金属活动性顺序表中金属的位置
C.金属与水反应置换出氢气的难易程度 D.最高价氧化物对应水化物的碱性强弱
3、理想中的新能源应具有资源丰富、可以再生、对环境无污染等特点。下列属于理想中的新能源的是
①太阳能 ②风能 ③地热能 ④海洋能 ⑤天然气 ⑥石油
A.①②③④ B.③④⑤⑥ C.①②③⑥ D.①②④⑤
15652752825754、下列电子式书写不正确的是
A.false的电子式: B.false的电子式:false
419036560325C.false的电子式:false D.false的电子式:
5、falseU是重要的核工业原料,在自然界的丰度很低。falseU的浓缩一直为国际社会所关注。下列有关falseU的说法中正确的是
A.falseU原子核中含有92个中子 B.falseU原子核外有143个电子
C.falseU与falseU互为同位素 D.falseU与falseU互为同素异形体
6、下列说法正确的是
A.短周期共有18种核素 B.随着元素的原子序数的递增,元素的最高正价从+1到+7
C.可以在周期表中金属与非金属的分界处寻找半导体材料
D.false和false分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
7、已知某离子的结构示意图为,下列说法正确的是( )
A.该元素位于第二周期ⅡA族 B.该元素位于第二周期Ⅶ族
C.该元素位于第三周期ⅡA族 D.该元素位于第二周期0族
8、中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
化学键
H2O中H-O键
O2中O=O 键
H2中H-H键
H2O2中O-O键
H2O2中O-H键
键能kJ/mol
463
496
436
138
463
若反应过程中分解了2 mol水,则下列说法不正确的是
A.总反应为2H2Ofalse2H2↑+O2↑ B.过程I吸收了926 kJ能量
C.过程II放出了574 kJ能量 D.过程Ⅲ属于放热反应
9、下列对卤素的说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱 B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序,颜色逐渐变浅,密度逐渐增大
10、下列叙述中,正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
11、四种短周期主族元素false的原子序数依次增大,false的简单离子具有相同电子层结构,W原子的L层电子数是K层的三倍,X的原子半径是短周期主族元素原子中最大的,Y与W同族。下列说法正确的是
A.简单离子半径:false B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:false D.最高价氧化物的水化物的酸性:false
12、下列递变情况中,正确的是
A.Na、Mg、Al原子最外层电子数依次减少 B.P、S、Cl元素非金属性依次减弱
C.Li、Na、K的金属性依次增强 D.C、N、O元素最高正价依次增大
13、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
A.原子序数为34 B.还原性:H2Se
A.凡含离子键的化合物,一定含金属元素 B.强碱、盐、活泼金属氧化物不属于离子化合物
C.离子化合物一定能电离
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
15、下列物质中,含有离子键的是
A.CO2 B.KCl C.NH3 D.CH4
16、下列叙述正确的是
A.离子化合物熔融状态下一定能导电 B.金属元素与非金属元素化合时都能形成离子键
C.离子化合物中的酸根离子中不能含有金属元素 D.离子化合物中不一定含有离子键
470662011239517、下列反应中能量变化趋势与下图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合
B.中和反应
C.木炭在氧气中发生不完全燃烧
D.生石灰和水的反应
18、下列选项描述的过程能实现化学能转化为热能的是 ( )
A.汽油燃烧 B.光合作用 C.潮汐发电 D.电解水
19、某氯原子的质量为a g,12C的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量为 B.氯元素的摩尔质量为aNA
C.m g该氯原子的物质的量为 D.n g该氯原子所含的电子数为
460502026924020、N2(g)与H2(g)在一定条件下经历如下,过程生成NH3(g),下列说法正确的是( )
A.I中破坏了离子键 B.II、III、IV均为放热过程
C.IV中表示NH2与H2生成NH3 D.N2(g)+3H2(g)2NH3(g)是吸热反应
21、“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
A.③⑤⑦ B.③④⑤ C.④⑤⑦ D.②⑤⑥
22、化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:向Cu电极方向移动 B.乙:正极的电极反应式为Ag2O+2e?+H2O=2Ag+2OH?
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:电池放电过程中,硫酸浓度不断减少
445960524193523、氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是( )
A.该电池中电极a是正极
B.外电路中电子由电极a通过导线流向电极b
C.该电池的正极反应为:O2+4H++4e-=2H2O
D.该电池的总反应为:2H2+O2=2H2O
331660524130024、2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
25、液晶显示器是日常生产生活中常用的电子产品的部件之一,生产液晶显示器过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的倍,在大气中的寿命可长达740年。在和条件下,断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,而形成中的化学键要释放的能量。下列说法中正确的是
A.过程吸收能量 B.反应为放热反应
C.液态的与气态的所具有的能量相同
D.吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
Ⅱ卷(非选择题 共50分)
26、A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是_______,E2D2的电子式为_______。
(2) 元素D、E、F形成的简单离子的半径由大到小为_______(用离子符号表示)。
(3) B、D的最简单气态氢化物的稳定性:_______(用化学式表示)。
(4) 设计一个简单的实验证明F和B的非金属性强弱:_______(用化学方程式表示)。
27、依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·mol-1,下列叙述正确的是_______(填字母,下同)。
A.每生成1 mol H-Cl键放出431 kJ能量 B.每生成1 mol H-Cl键吸收431 kJ能量
C.每拆开1 mol H-Cl键放出431 kJ能量 D.每拆开1 mol H-Cl键吸收431 kJ能量
(2)已知键能:H-H键为436 kJ·mol-1;H-F键为565 kJ·mol-1;H-Cl键为431 kJ·mol-1;H-Br键为366 kJ·mol-1。则下列分子受热时最稳定的是_______。
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是_______。
A.氮气的化学性质比氧气稳定 B.常温常压下溴呈液态,碘呈固态
3886200421005C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 mol N原子和3 mol H原子生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
(2)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
right15811528、 依据2Ag++Cu=Cu2++2Ag设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是__________。
(2)银电极为电池的_________极,发生的电极反应为 ;X电极上发生的电极反应为 。
(3)外电路中的电子是从_______电极流向_______电极。
29、根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(2)正极上出现的现象是_______。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式:_______。
(2)乙中负极为_______,总反应的离子方程式:_______。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有_______。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
第四中学2020~2021学年高一第二学期期中阶段性测试
《 化学 》试卷 答案版
考试时间 80分钟 试题分数:100分
用钢笔或中性笔答卷,不许用铅笔答卷;只交答题卷。
可能用到的相对原子质量:H-1 O-16 S-32 Na-23? Mn-55? Zn-65
Ⅰ卷(选择题 共50分)
一、选择题(每小题只一个选项符合题意)
1、下列说法正确的是
A.流水、风力、蒸汽是一次能源,电力是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.铅蓄电池是二次电池,氢氧燃料电池的活性物质储存在电池内部
D.废旧电池的集中处理的主要目的是防止电池中的重金属污染水源及土壤
【答案】D
2、下列不能作为判断金属性强弱依据的是
A.金属元素单质的沸点高低
B.金属活动性顺序表中金属的位置
C.金属与水反应置换出氢气的难易程度
D.最高价氧化物对应水化物的碱性强弱
【答案】A
3、理想中的新能源应具有资源丰富、可以再生、对环境无污染等特点。下列属于理想中的新能源的是
①太阳能 ②风能 ③地热能 ④海洋能 ⑤天然气 ⑥石油
A.①②③④ B.③④⑤⑥ C.①②③⑥ D.①②④⑤
【答案】A
4、下列电子式书写不正确的是
A.false的电子式:false B.false的电子式:false
C.false的电子式:false D.false的电子式:false
【答案】B
5、falseU是重要的核工业原料,在自然界的丰度很低。falseU的浓缩一直为国际社会所关注。下列有关falseU的说法中正确的是
A.falseU原子核中含有92个中子 B.falseU原子核外有143个电子
C.falseU与falseU互为同位素 D.falseU与falseU互为同素异形体
【答案】C
6、下列说法正确的是
A.短周期共有18种核素
B.随着元素的原子序数的递增,元素的最高正价从+1到+7
C.可以在周期表中金属与非金属的分界处寻找半导体材料
D.false和false分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
【答案】C
7、已知某离子的结构示意图为,下列说法正确的是( )
A.该元素位于第二周期ⅡA族
B.该元素位于第二周期Ⅶ族
C.该元素位于第三周期ⅡA族
D.该元素位于第二周期0族
【答案】C
8、中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
化学键
H2O中H-O键
O2中O=O 键
H2中H-H键
H2O2中O-O键
H2O2中O-H键
键能kJ/mol
463
496
436
138
463
若反应过程中分解了2 mol水,则下列说法不正确的是
A.总反应为2H2Ofalse2H2↑+O2↑ B.过程I吸收了926 kJ能量
C.过程II放出了574 kJ能量 D.过程Ⅲ属于放热反应
【答案】D
9、下列对卤素的说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序,颜色逐渐变浅,密度逐渐增大
【答案】D
10、下列叙述中,正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
【答案】B
11、四种短周期主族元素false的原子序数依次增大,false的简单离子具有相同电子层结构,W原子的L层电子数是K层的三倍,X的原子半径是短周期主族元素原子中最大的,Y与W同族。下列说法正确的是
A.简单离子半径:false B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:false D.最高价氧化物的水化物的酸性:false
【答案】B
12、下列递变情况中,正确的是
A.Na、Mg、Al原子最外层电子数依次减少
B.P、S、Cl元素非金属性依次减弱
C.Li、Na、K的金属性依次增强
D.C、N、O元素最高正价依次增大
【答案】C
13、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
A.原子序数为34
B.还原性:H2Se
14、下列有关离子键和离子化合物的说法中正确的是( )
A.凡含离子键的化合物,一定含金属元素
B.强碱、盐、活泼金属氧化物不属于离子化合物
C.离子化合物一定能电离
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
【答案】D
15、下列物质中,含有离子键的是
A.CO2 B.KCl C.NH3 D.CH4
【答案】B
16、下列叙述正确的是
A.离子化合物熔融状态下一定能导电
B.金属元素与非金属元素化合时都能形成离子键
C.离子化合物中的酸根离子中不能含有金属元素
D.离子化合物中不一定含有离子键
【答案】A
17、下列反应中能量变化趋势与下图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合
B.中和反应
C.木炭在氧气中发生不完全燃烧
D.生石灰和水的反应
【答案】A
18、下列选项描述的过程能实现化学能转化为热能的是 ( )
A.汽油燃烧 B.光合作用 C.潮汐发电 D.电解水
【答案】A
19、某氯原子的质量为a g,12C的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量为 B.氯元素的摩尔质量为aNA
C.m g该氯原子的物质的量为 D.n g该氯原子所含的电子数为
【答案】C
20、N2(g)与H2(g)在一定条件下经历如下,过程生成NH3(g),下列说法正确的是( )
A.I中破坏了离子键 B.II、III、IV均为放热过程
C.IV中表示NH2与H2生成NH3 D.N2(g)+3H2(g)2NH3(g)是吸热反应
【答案】B
21、“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
A.③⑤⑦ B.③④⑤ C.④⑤⑦ D.②⑤⑥
【答案】A
22、化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:向Cu电极方向移动
B.乙:正极的电极反应式为Ag2O+2e?+H2O=2Ag+2OH?
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:电池放电过程中,硫酸浓度不断减少
【答案】A
23、氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是( )
A.该电池中电极a是正极
B.外电路中电子由电极a通过导线流向电极b
C.该电池的正极反应为:O2+4H++4e-=2H2O
D.该电池的总反应为:2H2+O2=2H2O
【答案】A
24、2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
【答案】B
25、液晶显示器是日常生产生活中常用的电子产品的部件之一,生产液晶显示器过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的倍,在大气中的寿命可长达740年。在和条件下,断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,而形成中的化学键要释放的能量。下列说法中正确的是
A.过程吸收能量
B.反应为放热反应
C.液态的与气态的所具有的能量相同
D.吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【答案】B
Ⅱ卷(非选择题 共50分)
26、A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是_______,E2D2的电子式为_______。
(2) 元素D、E、F形成的简单离子的半径由大到小为_______(用离子符号表示)。
(3) B、D的最简单气态氢化物的稳定性:_______(用化学式表示)。
(4) 设计一个简单的实验证明F和B的非金属性强弱:_______(用化学方程式表示)。
【答案】第三周期ⅦA族 Cl->O2->Na+ H2O>CH4 Na2CO3+2HClO4=2NaClO4+CO2↑+H2O
27、依据化学能与热能的相关知识回答下列问题:
Ⅰ、键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H原子需要吸收436 kJ的能量。
(1)已知H—Cl键的键能为431 kJ·mol-1,下列叙述正确的是_______(填字母,下同)。
A.每生成1 mol H-Cl键放出431 kJ能量
B.每生成1 mol H-Cl键吸收431 kJ能量
C.每拆开1 mol H-Cl键放出431 kJ能量
D.每拆开1 mol H-Cl键吸收431 kJ能量
(2)已知键能:H-H键为436 kJ·mol-1;H-F键为565 kJ·mol-1;H-Cl键为431 kJ·mol-1;H-Br键为366 kJ·mol-1。则下列分子受热时最稳定的是_______。
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是_______。
A.氮气的化学性质比氧气稳定
B.常温常压下溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
Ⅱ、已知化学反应N2+3H22NH3的能量变化如图所示,回答下列问题:
(1)1 mol N原子和3 mol H原子生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
(2)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程_______(填“吸收”或“放出”)_______kJ能量。
【答案】AD A A 放出 b 放出 b-a
28、 依据2Ag++Cu=Cu2++2Ag设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是__________。
(2)银电极为电池的_________极,发生的电极反应为 ;X电极上发生的电极反应为 。
(3)外电路中的电子是从_______电极流向_______电极。
【答案】铜 AgNO3 正 2Ag++2e-=2Ag Cu-2e-=Cu2+ 铜 银
29、根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(2)正极上出现的现象是_______。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式:_______。
(2)乙中负极为_______,总反应的离子方程式:_______。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有_______。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
【答案】Cu 氧化 AgNO3溶液 碳棒上出现银白色物质 2H++2e-=H2↑ Al 2Al+2OH-+2H2O=2+3H2↑ AD
同课章节目录
