四川省阆中市高中2020-2021学年高一下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 四川省阆中市高中2020-2021学年高一下学期期中考试化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 395.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 12:28:03 | ||
图片预览



文档简介
阆中市高中12090400117475002021年春高2020级期中教学质量检测
化学试题
一、选择题(每个5分,共计50分)
1.习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受
生活。”下列做法与此不相符合的是( )
A.将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
B.将废旧电池进行直接填埋,减少对环境的污染
C.开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
2. 下列各组化合物中化学键类型不同的是( )
A. NaCl和HNO3 B. H2O和 NH3 C.CaF2和 CsCl D. CCl4和H2S
3.下列关于硫的化合物的叙述正确的是( )
A.铁槽车常用于贮运浓硫酸,是因为常温下铁与浓硫酸不反应
B.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可作干燥剂,但不能干燥H2S等还原性物质
4.下列离子方程式书写正确的是( )
A.铁片插入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙溶于稀盐酸中:COfalse+2H+=H2O+CO2 ↑
C.向H2SO4溶液中滴入Ba(OH)2溶液:H+ +SOfalse+Ba2++OH-=BaSO4↓+H2O
D.向澄清石灰水中滴加过量NaHCO3溶液:2HCOfalse+Ca2++2OH- =CaCO3↓+COfalse+2H2O
5.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y
元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素
的原子最外层电子数比次外层少一个。下列说法错误的是( )
原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y>M
C.ZX3极易溶于水,其水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
6.化学能可与热能、电能等相互转化。下列表述不正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.false晶体与false晶体的反应,反应物的总能量比生成物的总能量
高
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
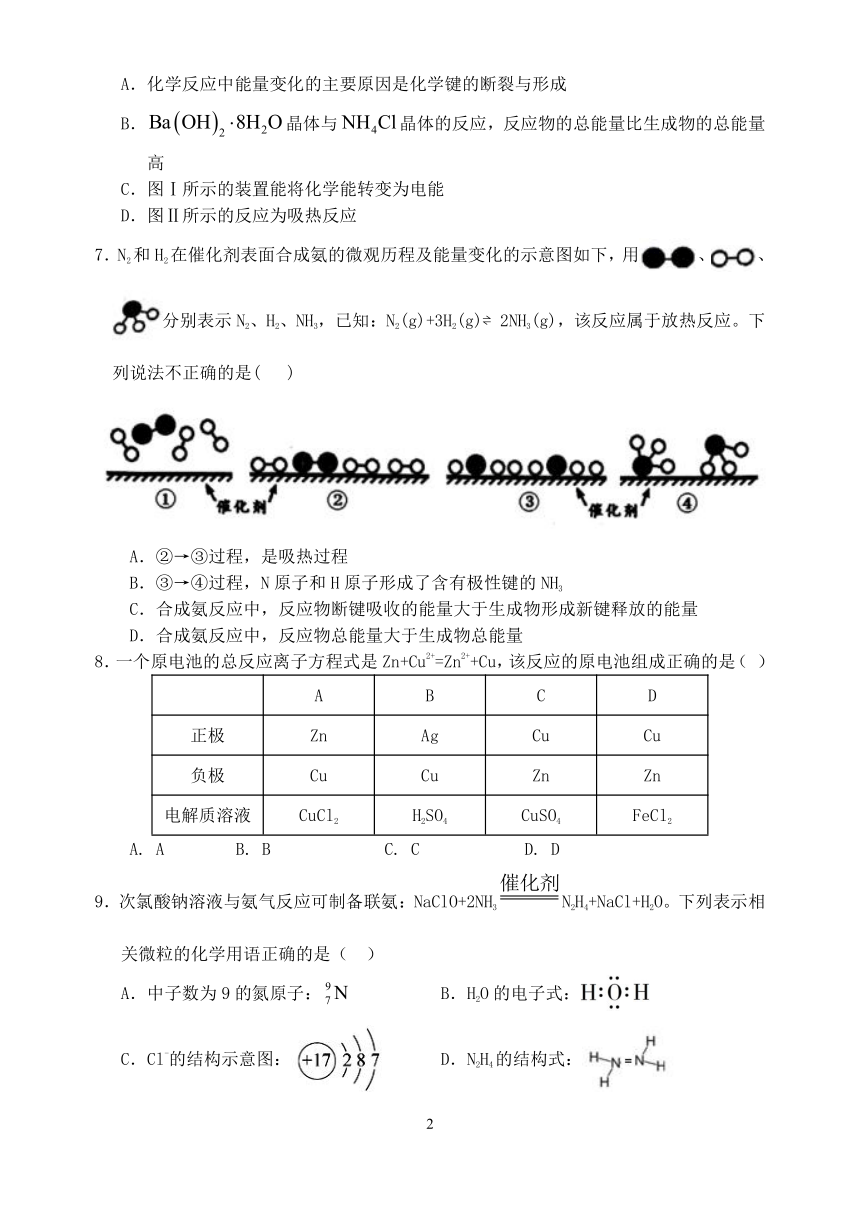
7.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),该反应属于放热反应。下列说法不正确的是( )
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
8.一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确的是( )
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
A. A B. B C. C D. D
9.次氯酸钠溶液与氨气反应可制备联氨:NaClO+2NH3falseN2H4+NaCl+H2O。下列表示相
关微粒的化学用语正确的是( )
A.中子数为9的氮原子:false B.H2O的电子式:
C.Cl-的结构示意图: D.N2H4的结构式:
10.如图为某课外小组自制的氢氧燃料电池,a、b均为石墨。下列叙述不正确的是( )
3632835127635A.a电极是负极,该电极上发生氧化反应
B.总反应方程式为2H2 + O2 = 2H2O
C.b极反应是O2 + 4H+ + 4e? = 4H2O
D.氢氧燃料电池是一种具有应用前景的绿色能源
二、填空题(每空2分,共计50分)
11.化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1 ,
N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_____。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) =CH3OH(g),反
338518570485应过程中的能量变化情况如图所示。
曲线I和曲线II分别表示不使用催化剂和使用
催化剂的两种情况。该反应是___________(填
“吸热”或“放热”)反应。计算当反应生成
1.5molCH3OH(g)时,能量变化值是___kJ。
选择适宜的催化剂___________(填“能”或“不
能”)改变该反应的反应热。
推测反应CH3OH(g) =CO(g)+2H2(g)是______(填
“吸热”或“放热”)反应。
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、
946kJ,则1molH2与足量N2反应生成NH3需___________(填“吸收”或“放出”)
能量___________kJ。(小数点后保留两位数字),事实上,反应的热量总小于理
论值,理由是___________。
短周期元素d、e、f、g、h、x都可能存在于某些食品添
2840990104775加剂中,其最高正化合价或最低负化合价
与原子序数的关系如图所示:
由x、e、d三种元素组成的离子化合
物的电子式为_______。
d、e、f、g元素形成的简单离子中半
径由大到小顺序是_________(用化学
式离子符号表示),其中原子半径最大
的元素的原子结构示意图为_______。
(3)d和g 形成的简单氢化物中,沸点较高的是:_______,原因是:_______。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是_______(填
化学式),此化合物可将碱性工业废水中的false氧化,生成碳酸盐和氨气,相应
的离子方程式为_______。
任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、
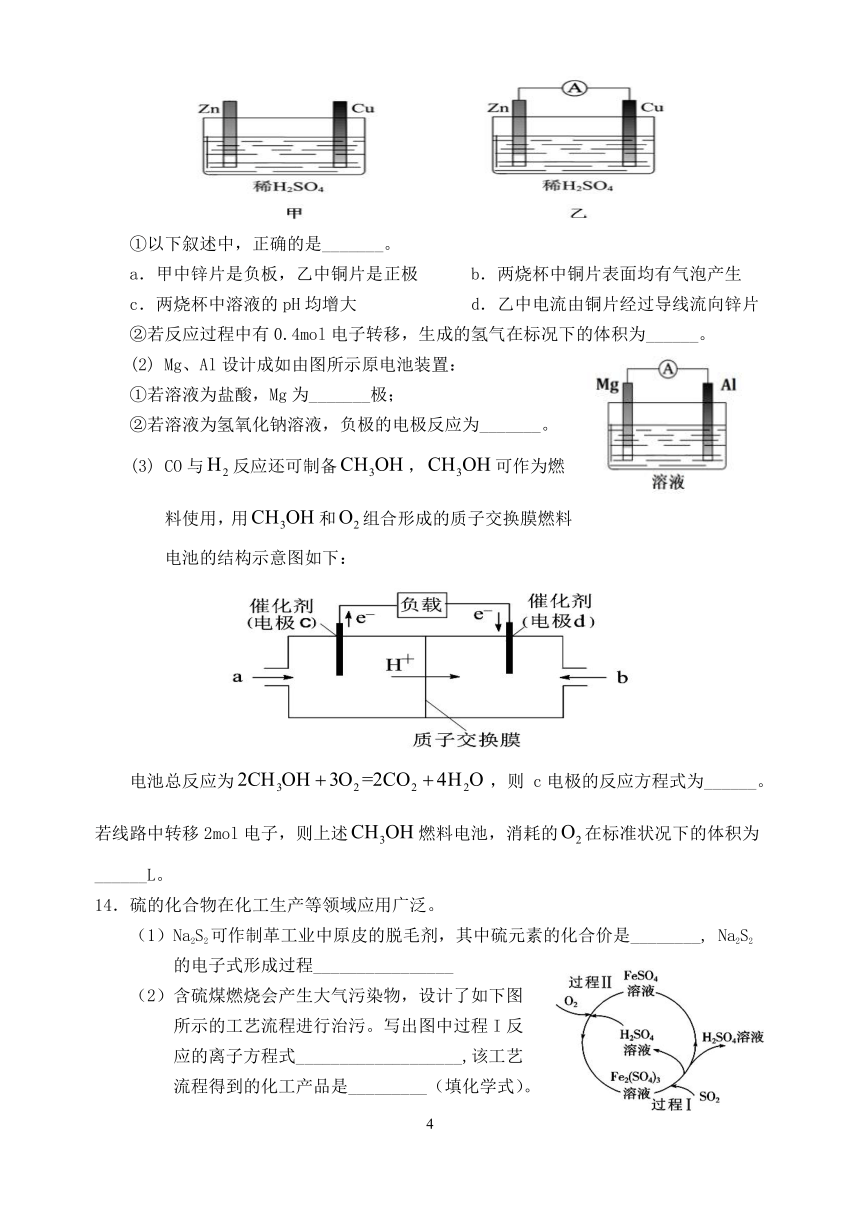
电能等不同形式的能量。(1)用图甲、乙所示装置进行实验,请回答下列问题:
①以下叙述中,正确的是_______。
a.甲中锌片是负板,乙中铜片是正极 b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的pH均增大 d.乙中电流由铜片经过导线流向锌片
②若反应过程中有0.4mol电子转移,生成的氢气在标况下的体积为______。
375539055245(2) Mg、Al设计成如由图所示原电池装置:
①若溶液为盐酸,Mg为_______极;
②若溶液为氢氧化钠溶液,负极的电极反应为_______。
CO与false反应还可制备false,false可作为燃
料使用,用false和false组合形成的质子交换膜燃料
电池的结构示意图如下:
电池总反应为false,则 c电极的反应方程式为______。若线路中转移2mol电子,则上述false燃料电池,消耗的false在标准状况下的体积为______L。
14.硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是________, Na2S2
3381375100330的电子式形成过程________________
含硫煤燃烧会产生大气污染物,设计了如下图
所示的工艺流程进行治污。写出图中过程I反
应的离子方程式___________________,该工艺
流程得到的化工产品是_________(填化学式)。
阆中市高中12090400117475002021年春高2020级期中教学质量检测
化学试题
选择题答案
B A D D D B C C B C
二.填空题(每空2分,共计50分)
11. 【答案】-1034.9kJ·mol-1 放热 136.5 不能 吸热 放出 30.67 该反应是可逆反应
12. 【答案】 S2->O2->Na+>Al3+ H2O 水分子间有氢键 H2O2 H2O2+CN-+OH-=COfalse+NH3↑
13. 【答案】cd false 负 false H2O+CH3OH-6e-=CO2 +6H+
11.2
14.【答案】-1 Na2S2的电子式形成过程 2Fe3++SO2+2H2O=2Fe2++4H++SOfalse H2SO4
一.选择题(每个5分,共计50分)
1.习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受生活。”下列做法与此不相符合的是
A.将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
B.将废旧电池进行直接填埋,减少对环境的污染
C.开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
【答案】B
【详解】
A.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料,提高煤的使用率,减少污染性气体的排放,减少酸雨的危害,A项正确;
B.废旧电池中含有重金属离子,如果直接填埋,会对土壤造成污染,B项错误;
C.开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖,符合“促进低碳经济”宗旨,C项正确;
D.推广利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气以替代液化石油气,减少污染性气体的排放,D项正确;
答案选B。
2 . 下列各组化合物中化学键类型不同的是()
A. NaCl和HNO3 B. H2O和 NH3
C. CaF2和 CsCl D. CCl4和H2S
【答案】A
【解析】A、NaCl为离子化合物且只含有离子键,而HNO3为共价化合物,含有共价键,化学键类型不同,选项A正确;B、H2O和NH3均为共价化合物,化学键类型相同,选项B错误;C、CaF2和 CsCl均为离子化合物,化学键类型相同,选项C错误;D、CCl4和H2S均为共价化合物,化学键类型相同,选项D错误。答案选A。
3.下列关于硫的化合物的叙述正确的是( )
A.铁槽车常用于贮运浓硫酸,是因为常温下铁与浓硫酸不反应
B.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可作干燥剂,但不能干燥H2S等还原性物质
【答案】D
【详解】
常温下,铁与浓硫酸发生钝化,在表面生成一层致密的氧化膜,阻止反应进行,因此铁槽车常用于贮运浓硫酸,但钝化是化学变化,故A错误;硫在纯氧中燃烧也生成二氧化疏而不是三氧化硫,故B错误;二氧化硫的漂白性是利用有色物质和二氧化硫反应生成无色物质,二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其酸性氧化物的性质,二氧化硫不能漂白酸碱指示剂,故C错误;浓硫酸具有酸性和强氧化性,所以浓硫酸不能干燥碱性及还原性气体,碱性气体如氨气,还原性气体如硫化氢,故D正确。
4.下列离子方程式书写正确的是
A.铁片插入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙溶于稀盐酸中:COfalse+2H+=H2O+CO2 ↑
C.向H2SO4溶液中滴入Ba(OH)2溶液:H+ +SOfalse+Ba2++OH-=BaSO4↓+H2O
D.向澄清石灰水中滴加过量NaHCO3溶液:2HCOfalse+Ca2++2OH- =CaCO3↓+COfalse+2H2O
【答案】D
【详解】
A.铁与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+═Fe2++H2↑,故A错误;
B.碳酸钙难溶于水,用化学式表示,溶于稀盐酸中的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故B错误;
C.向H2SO4溶液中滴入Ba(OH)2溶液,反应的离子方程式为2H++SOfalse+Ba2++2OH-═BaSO4↓+H2O,故C错误;
D.澄清石灰水中滴加过量的NaHCO3溶液反应生成碳酸钙沉淀和碳酸钠,反应的离子方程式为Ca2++2OH-+2HCOfalse=CaCO3↓+COfalse+2H2O,故D正确;
故选D。
5.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个。下列说法错误的是
A.原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y>M
C.ZX3极易溶于水,其水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
【答案】D
【分析】
X、Y、Z、M、Q为五种短周期元素,原子序数依次增大,Y元素的最高正价为+4价,则该元素为第IVA族元素,又知Y元素与Z、M元素相邻,且与M同族,则Y为C元素,Z为N元素,M为Si元素;化合物Z2X4的电子总数为18,则X的电子数为false X为H,该化合物为N2H4;?Q元素的原子最外层电子总数比次外层电子数少一个电子,Q为第三周期元素,最外层电子数为7,Q为Cl元素,以此来解答。
【详解】
由上述分析可知,X为H,Y为C元素,Z为N元素,M为Si元素,Q为Cl元素。
A.同周期元素从左到右原子半径依次减小;同主族元素从上到下原子半径依次增大;则原子半径比较:Z(N)?<Y(C) <M(Si)?,A正确;
B.同周期元素从左到右元素非金属性依次增强;同主族元素从上到下元素非金属性依次减弱。元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,由于非金属性:Z(N)>Y(C)>M?(Si),所以最高价氧化物对应水化物的酸性:Z(N)>Y(C)>M?(Si),B正确;
C.ZX3是NH3,极易溶于水,与水反应产生NH3·H2O,电离产生OH-使溶液显碱性,C正确;
D.X、Z和Q三种元素组成的化合物有很多,不一定都是共价化合物,如NH4Cl属于铵盐,为离子化合物,D错误;
故合理选项是D。
6.化学能可与热能、电能等相互转化。下列表述不正确的是
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.false晶体与false晶体的反应,反应物的总能量比生成物的总能量高
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
【答案】B
【详解】
A.化学反应总是伴随着能量变化,断键需要吸收能量,成键放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故A正确;
B.false晶体与false晶体的反应是吸热反应,反应物的总能量比生成物的总能量低,故B错误;
C.该装置中含有不同的电极、电解质溶液、构成了闭合回路,形成原电池,能将化学能转变为电能,故C正确;
D.根据图象Ⅱ知,反应物总能量小于生成物总能量,则该反应是吸热反应,故D正确;
故选B。
7.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),该反应属于放热反应。下列说法不正确的是
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
【答案】C
【详解】
A.②→③过程是化学键断裂的过程,是吸热过程,A正确;
B.③→④过程,N原子和H原子形成了含有极性键的NH3,B正确;
C.合成氨反应是放热非农业,反应物断键吸收的能量小于生成物形成新键释放的能量,C错误;
D.合成氨反应是放热反应,说明反应物总能量大于生成物总能量,D正确;
故选C。
8.一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确的是()
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
A. A B. B C. C D. D
【答案】C
【解析】根据电池反应式知,Zn失电子化合价升高作负极,不如锌活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液.A.应该是Zn作负极、Cu作正极,故A错误;B.应该是Cu作负极、Ag作正极,电解质溶液为硫酸,无法发生自发的氧化还原反应,不能构成原电池,故B错误;C.Zn作负极、Cu作正极、硫酸铜溶液作电解质溶液可以实现该原电池反应,故C正确;D.电解质溶液不是硫酸铜,用是FeCl3,形成的原电池不吻合,故D错误;故选C。
9.次氯酸钠溶液与氨气反应可制备联氨:NaClO+2NH3falseN2H4+NaCl+H2O。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:false B.H2O的电子式:
C.Cl-的结构示意图: D.N2H4的结构式:
【答案】B
【详解】
A.中子数为9的氮原子的质量数是7+9?=16,原子符号可表示为:falseN?,故A错误;
B.H2O是含有共价键的共价化合物,电子式为:,故B正确;
C.Cl-的质子数是17,其结构示意图为:,故C?错误;
D.N2H4的电子式为,其结构式:?,故D错误;
故选B。
10.如图为某课外小组自制的氢氧燃料电池,a、b均为石墨。
下列叙述不正确的是( )
A.a电极是负极,该电极上发生氧化反应
B.总反应方程式为2H2 + O2 = 2H2O
C.b极反应是O2 + 4H+ + 4e? = 4H2O
D.氢氧燃料电池是一种具有应用前景的绿色能源
【答案】C
【详解】
由图可知,氢氧燃料电池中通入氢气的电极为负极、通入氧气的电极为正极。A. a电极是负极,该电极上发生氧化反应,选项A正确;
B. 总反应方程式为2H2 + O2 = 2H2O,选项B正确;
C. b极反应是O2 +2H2O + 4e? = 4OH?,选项C不正确;
D. 氢氧燃料电池是一种具有应用前景的绿色能源,选项D正确。
答案选C。
二.填空题(每空2分,共计50分)
11.化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_____。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是___________(填“吸热”或“放热”)反应。计算当反应生成1.5molCH3OH(g)时,能量变化值是___________kJ。
(2)选择适宜的催化剂___________(填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)?CO(g)+2H2(g)是___________(填“吸热”或“放热”)反应。
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需___________(填“吸收”或“放出”)能量___________kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是___________。
【答案】-1034.9kJ·mol-1 放热 136.5 不能 吸热 放出 30.67 该反应是可逆反应
【详解】
Ⅰ.将两个热化学方程式依次标注为①、②,依据盖斯定律,由①×2-②即得,4H2(g)+2NO2(g)=N2(g)+4H2O(g)ΔΗ=-483.6 kJ·mol-1×2-(+67.7 kJ·mol-1)=-1034.9 kJ·mol-1,故答案为:-1034.9kJ·mol-1;
Ⅱ.(1)根据图像可知,该反应的生成物的总能量低于反应物的总能量,属于放热反应,每生成1molCH3OH放出的热量为510-419=91kJ,因此当反应生成1.5molCH3OH时,能量的变化值为1.5×91=136.5kJ,故答案为:放热;136.5;
(2)催化剂只能改变反应速率,不能改变该反应的反应热,故答案为:不能;
(3)由(1)可知,反应CO(g)+2H2(g)?CH3OH(g)放热,则反应CH3OH(g)?CO(g)+2H2(g)吸热,故答案为:吸热;
Ⅲ.已知断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则生成1mollN—H键需要释放391kJ能量,又3H2+N2false2NH3,则1molH2与falsemolN2反应生成falseNH3,吸收的能量为436kJ+false×946kJ≈751.33kJ,放出的能量为false×3×391kJ=782kJ,因此1molH2与足量N2反应生成NH3需放出能量782kJ-751.33kJ=30.67kJ,又由于该反应是可逆反应,因此反应的热量总小于理论值,故答案为:放出;30.67;该反应是可逆反应。
8.短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
由x、e、d三种元素组成的离子化合物的电子式为_______。
(2) 元素f在周期表________________________位置
(3)d、e、f、g元素形成的简单离子中半径由大到小顺序最小的是_______(用化学式离子符号表示),其中原子半径最大的元素的原子结构示意图为_______。
(4)d和g 形成的简单氢化物中,沸点较高的是:_______,原因是:_______。
(5)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是_______(填化学式),此化合物可将碱性工业废水中的false氧化,生成碳酸盐和氨气,相应的离子方程式为_______。
【答案】 S2->O2->Na+>Al3+ H2O 水分子间有氢键 H2O2 H2O2+CN-+OH-=COfalse+NH3↑
【分析】
短周期元素d、e、f、g、h、x的最高正化合价或最低负化合价与原子序数的关系如图所示,其中x的原子序数最小,其化合价为+1,与e同主族;d化合价为-2,g的化合价为+6,二者位于ⅥA族,则d为O,g为S;e的化合价为+1,其原子序数大于O,则e为Na,则x为H或Li,又因为x、e、d三种元素可组成的离子化合物,则x是H;f的化合价为+3,其原子序数大于Na,则f为Al;h的化合价为-1,其原子序数最大,则h为Cl元素,以此分析解答。
【详解】
根据以上分析可知d、e、f、g、h、x分别是O、Na、Al、S、Cl、H。
(1)由x、e、d三种元素组成的离子化合物是氢氧化钠,电子式为。
(2)核外电子层数越多半径越大,核外电子排布相同时半径随原子序数的增大而减小,则d、e、f、g元素形成的简单离子中半径由大到小顺序最小的是S2->O2->Na+>Al3+,其中原子半径最大的元素是Na,原子结构示意图为。
(3)由于水分子间有氢键,硫化氢不能形成氢键,则d和g形成的简单氢化物中,沸点较高的是H2O。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是双氧水,化学式为H2O2,此化合物可将碱性工业废水中的false氧化,生成碳酸盐和氨气,反应中碳元素化合价从+2价升高到+4价失去2个电子,氧元素化合价从-1价降低到-2价,则根据电子得失守恒可知转移2个电子,相应的离子方程式为H2O2+CN-+OH-=COfalse+NH3↑。
9.任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、电能等不同形式的能量。
(1)用图甲、乙所示装置进行实验,请回答下列问题:
①以下叙述中,正确的是_______。
a.甲中锌片是负板,乙中铜片是正极
b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的pH均增大
d.乙中电流由铜片经过导线流向锌片
②若反应过程中有0.4mol电子转移,生成的氢气在标况下的体积为_______。
(2) Mg、Al设计成如由图所示原电池装置:
①若溶液为盐酸,Mg为_______极;
②若溶液为氢氧化钠溶液,负极的电极反应为_______。
(3) CO与false反应还可制备false,false可作为燃料使用,用false和false组合形成的质子交换膜燃料电池的结构示意图如下:
电池总反应为false,则c电极是______(填“正极”或“负极”),c电极的反应方程式为______。若线路中转移2mol电子,则上述false燃料电池,消耗的false在标准状况下的体积为______L。
【答案】cd false 负 false H2O+CH3OH-6e-=CO2 +6H+
11.2
14.硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是________,电子式________________
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式___________________________,该工艺流程得到的化工产品是____________(填化学式)。
【答案】-1 2Fe3++SO2+2H2O=2Fe2++4H++SOfalse H2SO4
【分析】
根据流程箭头分析反应产物和反应物,在水溶液中根据分步电离公式和电离常数公式计算氢离子浓度,进而计算pH值。
【详解】
(1)Na2S2可作制革工业中原皮的脱毛剂,根据化合价构成规律,其中硫元素的化合价是-1。
(2)含硫煤燃烧会产生大气污染物,设计工艺流程进行治污,根据箭头指示,过程I反应的离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SOfalse,该工艺流程得到的化工产品是H2SO4。
(3) SO2
化学试题
一、选择题(每个5分,共计50分)
1.习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受
生活。”下列做法与此不相符合的是( )
A.将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
B.将废旧电池进行直接填埋,减少对环境的污染
C.开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
2. 下列各组化合物中化学键类型不同的是( )
A. NaCl和HNO3 B. H2O和 NH3 C.CaF2和 CsCl D. CCl4和H2S
3.下列关于硫的化合物的叙述正确的是( )
A.铁槽车常用于贮运浓硫酸,是因为常温下铁与浓硫酸不反应
B.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可作干燥剂,但不能干燥H2S等还原性物质
4.下列离子方程式书写正确的是( )
A.铁片插入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙溶于稀盐酸中:COfalse+2H+=H2O+CO2 ↑
C.向H2SO4溶液中滴入Ba(OH)2溶液:H+ +SOfalse+Ba2++OH-=BaSO4↓+H2O
D.向澄清石灰水中滴加过量NaHCO3溶液:2HCOfalse+Ca2++2OH- =CaCO3↓+COfalse+2H2O
5.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y
元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素
的原子最外层电子数比次外层少一个。下列说法错误的是( )
原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y>M
C.ZX3极易溶于水,其水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
6.化学能可与热能、电能等相互转化。下列表述不正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.false晶体与false晶体的反应,反应物的总能量比生成物的总能量
高
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
7.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),该反应属于放热反应。下列说法不正确的是( )
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
8.一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确的是( )
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
A. A B. B C. C D. D
9.次氯酸钠溶液与氨气反应可制备联氨:NaClO+2NH3falseN2H4+NaCl+H2O。下列表示相
关微粒的化学用语正确的是( )
A.中子数为9的氮原子:false B.H2O的电子式:
C.Cl-的结构示意图: D.N2H4的结构式:
10.如图为某课外小组自制的氢氧燃料电池,a、b均为石墨。下列叙述不正确的是( )
3632835127635A.a电极是负极,该电极上发生氧化反应
B.总反应方程式为2H2 + O2 = 2H2O
C.b极反应是O2 + 4H+ + 4e? = 4H2O
D.氢氧燃料电池是一种具有应用前景的绿色能源
二、填空题(每空2分,共计50分)
11.化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1 ,
N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_____。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) =CH3OH(g),反
338518570485应过程中的能量变化情况如图所示。
曲线I和曲线II分别表示不使用催化剂和使用
催化剂的两种情况。该反应是___________(填
“吸热”或“放热”)反应。计算当反应生成
1.5molCH3OH(g)时,能量变化值是___kJ。
选择适宜的催化剂___________(填“能”或“不
能”)改变该反应的反应热。
推测反应CH3OH(g) =CO(g)+2H2(g)是______(填
“吸热”或“放热”)反应。
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、
946kJ,则1molH2与足量N2反应生成NH3需___________(填“吸收”或“放出”)
能量___________kJ。(小数点后保留两位数字),事实上,反应的热量总小于理
论值,理由是___________。
短周期元素d、e、f、g、h、x都可能存在于某些食品添
2840990104775加剂中,其最高正化合价或最低负化合价
与原子序数的关系如图所示:
由x、e、d三种元素组成的离子化合
物的电子式为_______。
d、e、f、g元素形成的简单离子中半
径由大到小顺序是_________(用化学
式离子符号表示),其中原子半径最大
的元素的原子结构示意图为_______。
(3)d和g 形成的简单氢化物中,沸点较高的是:_______,原因是:_______。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是_______(填
化学式),此化合物可将碱性工业废水中的false氧化,生成碳酸盐和氨气,相应
的离子方程式为_______。
任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、
电能等不同形式的能量。(1)用图甲、乙所示装置进行实验,请回答下列问题:
①以下叙述中,正确的是_______。
a.甲中锌片是负板,乙中铜片是正极 b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的pH均增大 d.乙中电流由铜片经过导线流向锌片
②若反应过程中有0.4mol电子转移,生成的氢气在标况下的体积为______。
375539055245(2) Mg、Al设计成如由图所示原电池装置:
①若溶液为盐酸,Mg为_______极;
②若溶液为氢氧化钠溶液,负极的电极反应为_______。
CO与false反应还可制备false,false可作为燃
料使用,用false和false组合形成的质子交换膜燃料
电池的结构示意图如下:
电池总反应为false,则 c电极的反应方程式为______。若线路中转移2mol电子,则上述false燃料电池,消耗的false在标准状况下的体积为______L。
14.硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是________, Na2S2
3381375100330的电子式形成过程________________
含硫煤燃烧会产生大气污染物,设计了如下图
所示的工艺流程进行治污。写出图中过程I反
应的离子方程式___________________,该工艺
流程得到的化工产品是_________(填化学式)。
阆中市高中12090400117475002021年春高2020级期中教学质量检测
化学试题
选择题答案
B A D D D B C C B C
二.填空题(每空2分,共计50分)
11. 【答案】-1034.9kJ·mol-1 放热 136.5 不能 吸热 放出 30.67 该反应是可逆反应
12. 【答案】 S2->O2->Na+>Al3+ H2O 水分子间有氢键 H2O2 H2O2+CN-+OH-=COfalse+NH3↑
13. 【答案】cd false 负 false H2O+CH3OH-6e-=CO2 +6H+
11.2
14.【答案】-1 Na2S2的电子式形成过程 2Fe3++SO2+2H2O=2Fe2++4H++SOfalse H2SO4
一.选择题(每个5分,共计50分)
1.习总书记强调“要建设天蓝、地绿、水清的美丽中国,让老百姓在宜居的环境中享受生活。”下列做法与此不相符合的是
A.将煤进行气化处理,既提高煤的综合利用效率,又可减少酸雨的危害
B.将废旧电池进行直接填埋,减少对环境的污染
C.开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
D.利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
【答案】B
【详解】
A.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料,提高煤的使用率,减少污染性气体的排放,减少酸雨的危害,A项正确;
B.废旧电池中含有重金属离子,如果直接填埋,会对土壤造成污染,B项错误;
C.开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖,符合“促进低碳经济”宗旨,C项正确;
D.推广利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气以替代液化石油气,减少污染性气体的排放,D项正确;
答案选B。
2 . 下列各组化合物中化学键类型不同的是()
A. NaCl和HNO3 B. H2O和 NH3
C. CaF2和 CsCl D. CCl4和H2S
【答案】A
【解析】A、NaCl为离子化合物且只含有离子键,而HNO3为共价化合物,含有共价键,化学键类型不同,选项A正确;B、H2O和NH3均为共价化合物,化学键类型相同,选项B错误;C、CaF2和 CsCl均为离子化合物,化学键类型相同,选项C错误;D、CCl4和H2S均为共价化合物,化学键类型相同,选项D错误。答案选A。
3.下列关于硫的化合物的叙述正确的是( )
A.铁槽车常用于贮运浓硫酸,是因为常温下铁与浓硫酸不反应
B.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可作干燥剂,但不能干燥H2S等还原性物质
【答案】D
【详解】
常温下,铁与浓硫酸发生钝化,在表面生成一层致密的氧化膜,阻止反应进行,因此铁槽车常用于贮运浓硫酸,但钝化是化学变化,故A错误;硫在纯氧中燃烧也生成二氧化疏而不是三氧化硫,故B错误;二氧化硫的漂白性是利用有色物质和二氧化硫反应生成无色物质,二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其酸性氧化物的性质,二氧化硫不能漂白酸碱指示剂,故C错误;浓硫酸具有酸性和强氧化性,所以浓硫酸不能干燥碱性及还原性气体,碱性气体如氨气,还原性气体如硫化氢,故D正确。
4.下列离子方程式书写正确的是
A.铁片插入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙溶于稀盐酸中:COfalse+2H+=H2O+CO2 ↑
C.向H2SO4溶液中滴入Ba(OH)2溶液:H+ +SOfalse+Ba2++OH-=BaSO4↓+H2O
D.向澄清石灰水中滴加过量NaHCO3溶液:2HCOfalse+Ca2++2OH- =CaCO3↓+COfalse+2H2O
【答案】D
【详解】
A.铁与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+═Fe2++H2↑,故A错误;
B.碳酸钙难溶于水,用化学式表示,溶于稀盐酸中的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故B错误;
C.向H2SO4溶液中滴入Ba(OH)2溶液,反应的离子方程式为2H++SOfalse+Ba2++2OH-═BaSO4↓+H2O,故C错误;
D.澄清石灰水中滴加过量的NaHCO3溶液反应生成碳酸钙沉淀和碳酸钠,反应的离子方程式为Ca2++2OH-+2HCOfalse=CaCO3↓+COfalse+2H2O,故D正确;
故选D。
5.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个。下列说法错误的是
A.原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y>M
C.ZX3极易溶于水,其水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
【答案】D
【分析】
X、Y、Z、M、Q为五种短周期元素,原子序数依次增大,Y元素的最高正价为+4价,则该元素为第IVA族元素,又知Y元素与Z、M元素相邻,且与M同族,则Y为C元素,Z为N元素,M为Si元素;化合物Z2X4的电子总数为18,则X的电子数为false X为H,该化合物为N2H4;?Q元素的原子最外层电子总数比次外层电子数少一个电子,Q为第三周期元素,最外层电子数为7,Q为Cl元素,以此来解答。
【详解】
由上述分析可知,X为H,Y为C元素,Z为N元素,M为Si元素,Q为Cl元素。
A.同周期元素从左到右原子半径依次减小;同主族元素从上到下原子半径依次增大;则原子半径比较:Z(N)?<Y(C) <M(Si)?,A正确;
B.同周期元素从左到右元素非金属性依次增强;同主族元素从上到下元素非金属性依次减弱。元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,由于非金属性:Z(N)>Y(C)>M?(Si),所以最高价氧化物对应水化物的酸性:Z(N)>Y(C)>M?(Si),B正确;
C.ZX3是NH3,极易溶于水,与水反应产生NH3·H2O,电离产生OH-使溶液显碱性,C正确;
D.X、Z和Q三种元素组成的化合物有很多,不一定都是共价化合物,如NH4Cl属于铵盐,为离子化合物,D错误;
故合理选项是D。
6.化学能可与热能、电能等相互转化。下列表述不正确的是
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.false晶体与false晶体的反应,反应物的总能量比生成物的总能量高
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
【答案】B
【详解】
A.化学反应总是伴随着能量变化,断键需要吸收能量,成键放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故A正确;
B.false晶体与false晶体的反应是吸热反应,反应物的总能量比生成物的总能量低,故B错误;
C.该装置中含有不同的电极、电解质溶液、构成了闭合回路,形成原电池,能将化学能转变为电能,故C正确;
D.根据图象Ⅱ知,反应物总能量小于生成物总能量,则该反应是吸热反应,故D正确;
故选B。
7.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),该反应属于放热反应。下列说法不正确的是
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
【答案】C
【详解】
A.②→③过程是化学键断裂的过程,是吸热过程,A正确;
B.③→④过程,N原子和H原子形成了含有极性键的NH3,B正确;
C.合成氨反应是放热非农业,反应物断键吸收的能量小于生成物形成新键释放的能量,C错误;
D.合成氨反应是放热反应,说明反应物总能量大于生成物总能量,D正确;
故选C。
8.一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确的是()
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
A. A B. B C. C D. D
【答案】C
【解析】根据电池反应式知,Zn失电子化合价升高作负极,不如锌活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液.A.应该是Zn作负极、Cu作正极,故A错误;B.应该是Cu作负极、Ag作正极,电解质溶液为硫酸,无法发生自发的氧化还原反应,不能构成原电池,故B错误;C.Zn作负极、Cu作正极、硫酸铜溶液作电解质溶液可以实现该原电池反应,故C正确;D.电解质溶液不是硫酸铜,用是FeCl3,形成的原电池不吻合,故D错误;故选C。
9.次氯酸钠溶液与氨气反应可制备联氨:NaClO+2NH3falseN2H4+NaCl+H2O。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:false B.H2O的电子式:
C.Cl-的结构示意图: D.N2H4的结构式:
【答案】B
【详解】
A.中子数为9的氮原子的质量数是7+9?=16,原子符号可表示为:falseN?,故A错误;
B.H2O是含有共价键的共价化合物,电子式为:,故B正确;
C.Cl-的质子数是17,其结构示意图为:,故C?错误;
D.N2H4的电子式为,其结构式:?,故D错误;
故选B。
10.如图为某课外小组自制的氢氧燃料电池,a、b均为石墨。
下列叙述不正确的是( )
A.a电极是负极,该电极上发生氧化反应
B.总反应方程式为2H2 + O2 = 2H2O
C.b极反应是O2 + 4H+ + 4e? = 4H2O
D.氢氧燃料电池是一种具有应用前景的绿色能源
【答案】C
【详解】
由图可知,氢氧燃料电池中通入氢气的电极为负极、通入氧气的电极为正极。A. a电极是负极,该电极上发生氧化反应,选项A正确;
B. 总反应方程式为2H2 + O2 = 2H2O,选项B正确;
C. b极反应是O2 +2H2O + 4e? = 4OH?,选项C不正确;
D. 氢氧燃料电池是一种具有应用前景的绿色能源,选项D正确。
答案选C。
二.填空题(每空2分,共计50分)
11.化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_____。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是___________(填“吸热”或“放热”)反应。计算当反应生成1.5molCH3OH(g)时,能量变化值是___________kJ。
(2)选择适宜的催化剂___________(填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)?CO(g)+2H2(g)是___________(填“吸热”或“放热”)反应。
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需___________(填“吸收”或“放出”)能量___________kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是___________。
【答案】-1034.9kJ·mol-1 放热 136.5 不能 吸热 放出 30.67 该反应是可逆反应
【详解】
Ⅰ.将两个热化学方程式依次标注为①、②,依据盖斯定律,由①×2-②即得,4H2(g)+2NO2(g)=N2(g)+4H2O(g)ΔΗ=-483.6 kJ·mol-1×2-(+67.7 kJ·mol-1)=-1034.9 kJ·mol-1,故答案为:-1034.9kJ·mol-1;
Ⅱ.(1)根据图像可知,该反应的生成物的总能量低于反应物的总能量,属于放热反应,每生成1molCH3OH放出的热量为510-419=91kJ,因此当反应生成1.5molCH3OH时,能量的变化值为1.5×91=136.5kJ,故答案为:放热;136.5;
(2)催化剂只能改变反应速率,不能改变该反应的反应热,故答案为:不能;
(3)由(1)可知,反应CO(g)+2H2(g)?CH3OH(g)放热,则反应CH3OH(g)?CO(g)+2H2(g)吸热,故答案为:吸热;
Ⅲ.已知断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则生成1mollN—H键需要释放391kJ能量,又3H2+N2false2NH3,则1molH2与falsemolN2反应生成falseNH3,吸收的能量为436kJ+false×946kJ≈751.33kJ,放出的能量为false×3×391kJ=782kJ,因此1molH2与足量N2反应生成NH3需放出能量782kJ-751.33kJ=30.67kJ,又由于该反应是可逆反应,因此反应的热量总小于理论值,故答案为:放出;30.67;该反应是可逆反应。
8.短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
由x、e、d三种元素组成的离子化合物的电子式为_______。
(2) 元素f在周期表________________________位置
(3)d、e、f、g元素形成的简单离子中半径由大到小顺序最小的是_______(用化学式离子符号表示),其中原子半径最大的元素的原子结构示意图为_______。
(4)d和g 形成的简单氢化物中,沸点较高的是:_______,原因是:_______。
(5)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是_______(填化学式),此化合物可将碱性工业废水中的false氧化,生成碳酸盐和氨气,相应的离子方程式为_______。
【答案】 S2->O2->Na+>Al3+ H2O 水分子间有氢键 H2O2 H2O2+CN-+OH-=COfalse+NH3↑
【分析】
短周期元素d、e、f、g、h、x的最高正化合价或最低负化合价与原子序数的关系如图所示,其中x的原子序数最小,其化合价为+1,与e同主族;d化合价为-2,g的化合价为+6,二者位于ⅥA族,则d为O,g为S;e的化合价为+1,其原子序数大于O,则e为Na,则x为H或Li,又因为x、e、d三种元素可组成的离子化合物,则x是H;f的化合价为+3,其原子序数大于Na,则f为Al;h的化合价为-1,其原子序数最大,则h为Cl元素,以此分析解答。
【详解】
根据以上分析可知d、e、f、g、h、x分别是O、Na、Al、S、Cl、H。
(1)由x、e、d三种元素组成的离子化合物是氢氧化钠,电子式为。
(2)核外电子层数越多半径越大,核外电子排布相同时半径随原子序数的增大而减小,则d、e、f、g元素形成的简单离子中半径由大到小顺序最小的是S2->O2->Na+>Al3+,其中原子半径最大的元素是Na,原子结构示意图为。
(3)由于水分子间有氢键,硫化氢不能形成氢键,则d和g形成的简单氢化物中,沸点较高的是H2O。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是双氧水,化学式为H2O2,此化合物可将碱性工业废水中的false氧化,生成碳酸盐和氨气,反应中碳元素化合价从+2价升高到+4价失去2个电子,氧元素化合价从-1价降低到-2价,则根据电子得失守恒可知转移2个电子,相应的离子方程式为H2O2+CN-+OH-=COfalse+NH3↑。
9.任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、电能等不同形式的能量。
(1)用图甲、乙所示装置进行实验,请回答下列问题:
①以下叙述中,正确的是_______。
a.甲中锌片是负板,乙中铜片是正极
b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的pH均增大
d.乙中电流由铜片经过导线流向锌片
②若反应过程中有0.4mol电子转移,生成的氢气在标况下的体积为_______。
(2) Mg、Al设计成如由图所示原电池装置:
①若溶液为盐酸,Mg为_______极;
②若溶液为氢氧化钠溶液,负极的电极反应为_______。
(3) CO与false反应还可制备false,false可作为燃料使用,用false和false组合形成的质子交换膜燃料电池的结构示意图如下:
电池总反应为false,则c电极是______(填“正极”或“负极”),c电极的反应方程式为______。若线路中转移2mol电子,则上述false燃料电池,消耗的false在标准状况下的体积为______L。
【答案】cd false 负 false H2O+CH3OH-6e-=CO2 +6H+
11.2
14.硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是________,电子式________________
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式___________________________,该工艺流程得到的化工产品是____________(填化学式)。
【答案】-1 2Fe3++SO2+2H2O=2Fe2++4H++SOfalse H2SO4
【分析】
根据流程箭头分析反应产物和反应物,在水溶液中根据分步电离公式和电离常数公式计算氢离子浓度,进而计算pH值。
【详解】
(1)Na2S2可作制革工业中原皮的脱毛剂,根据化合价构成规律,其中硫元素的化合价是-1。
(2)含硫煤燃烧会产生大气污染物,设计工艺流程进行治污,根据箭头指示,过程I反应的离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SOfalse,该工艺流程得到的化工产品是H2SO4。
(3) SO2
同课章节目录
