鲁教版化学九年级下学期第七单元 常见的酸和碱单元测试卷有答案
文档属性
| 名称 | 鲁教版化学九年级下学期第七单元 常见的酸和碱单元测试卷有答案 |  | |
| 格式 | doc | ||
| 文件大小 | 151.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 11:03:19 | ||
图片预览


文档简介
2020-2021年鲁教版化学九年级下学期第7单元《常见的酸和碱》单元测试卷+答案
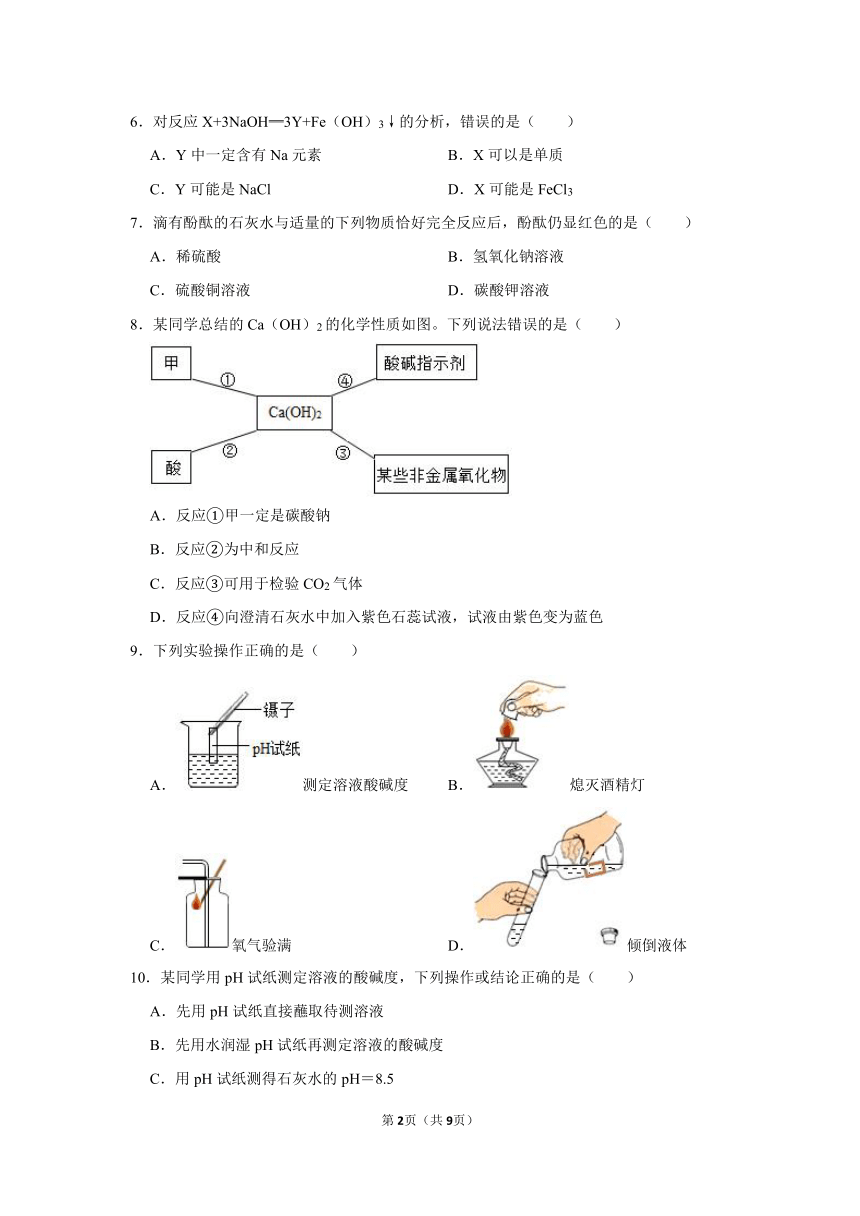
一.选择题(共17小题)
1.能使无色酚酞试液变红色的溶液是( )
A.氯化钠溶液 B.盐酸
C.氯化铵溶液 D.氢氧化钠溶液
2.把质量相同的浓盐酸和浓硫酸,分别敞口置于天平的左右盘上,一段时间后指针( )
A.指向左边 B.指向右边 C.仍然平衡 D.无法判断
3.下列四组实验中,不能体现酸的通性的是( )
A. B.
C. D.
4.逻辑推理是化学学习中常用的思维方法。以下推理正确的是( )
A.碳酸钙能与盐酸反应产生气体,能与盐酸反应产生气体的固体物质一定是碳酸盐
B.水是氧化物,其中含有氧元素,但是含有氧元素的物质不一定都是氧化物
C.有机物中含有碳元素,所以含有碳元素的化合物一定是有机物
D.化学反应前后原子种类不变,化学反应前后分子种类也一定不变
5.下列不是氢氧化钠俗称的是( )
A.火碱 B.烧碱 C.苛性钠 D.纯碱
6.对反应X+3NaOH═3Y+Fe(OH)3↓的分析,错误的是( )
A.Y中一定含有Na元素 B.X可以是单质
C.Y可能是NaCl D.X可能是FeCl3
7.滴有酚酞的石灰水与适量的下列物质恰好完全反应后,酚酞仍显红色的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.碳酸钾溶液
8.某同学总结的Ca(OH)2的化学性质如图。下列说法错误的是( )
A.反应①甲一定是碳酸钠
B.反应②为中和反应
C.反应③可用于检验CO2气体
D.反应④向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
9.下列实验操作正确的是( )
A.测定溶液酸碱度 B.熄灭酒精灯
C.氧气验满 D.倾倒液体
10.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是( )
A.先用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用pH试纸测得石灰水的pH=8.5
D.用pH试纸测得盐酸的pH=1
11.生活中一些物质的pH如下:
物质 白醋 橙子汁 牛奶 厨房油污清洗剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.牛奶 B.厨房油污清洗剂
C.白醋 D.橙子汁
12.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.常温下,测得溶液的pH<7
B.溶液中滴入酚酞不显色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞显红色
13.下表是部分农作物生长对土壤pH的要求.如果某地区经常降酸雨,则该地区最不适合种植的农作物是( )
农作物 大豆 茶 玉米 马铃薯
pH 6.0~7.0 5.0~5.5 7.0~8.1 4.8~5.5
A.大豆 B.茶 C.玉米 D.马铃薯
14.下列生活经验没有应用酸碱反应原理的是( )
A.用熟石灰改良酸性土壤
B.用氢氧化钠溶液洗涤石油产品中的残留硫酸
C.用氢氧化铝治疗胃酸过多
D.用生石灰作干燥剂
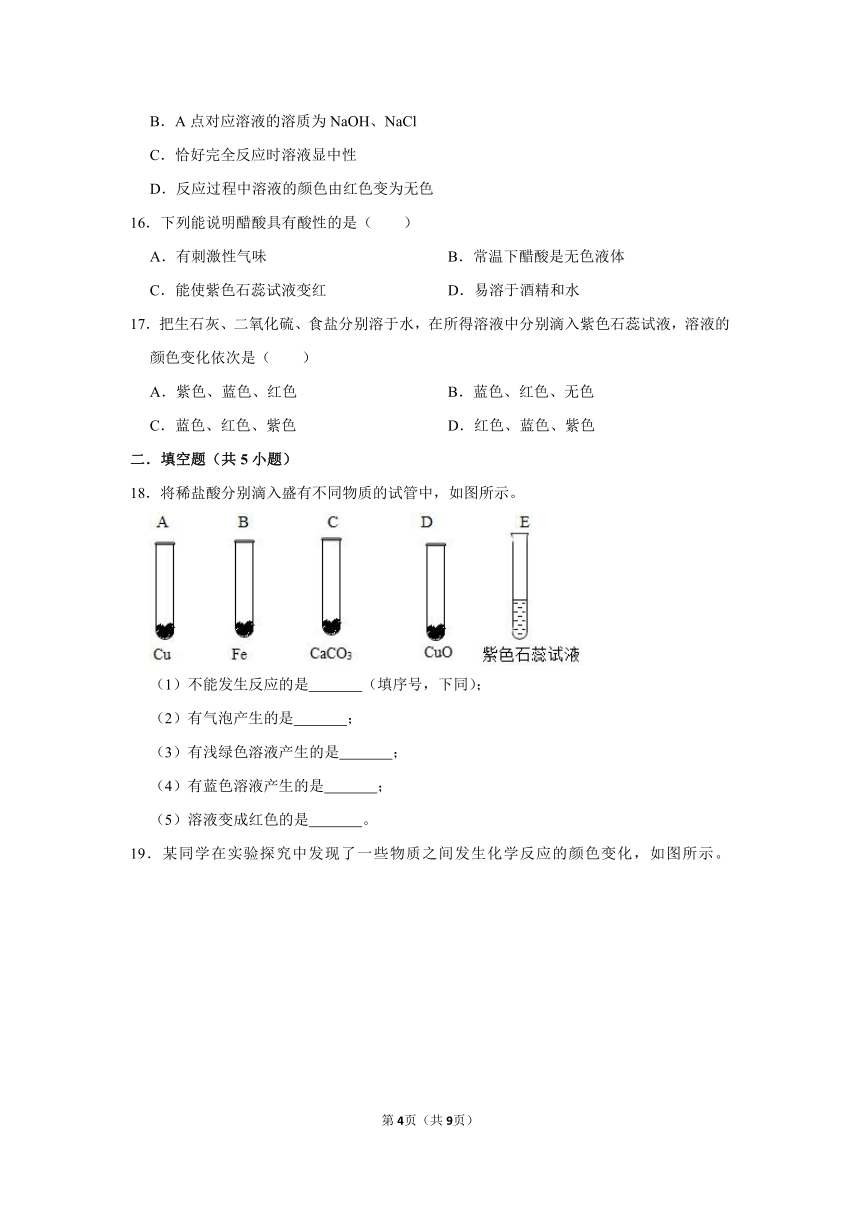
15.向滴有酚酞的盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的pH与加入溶液体积关系如图所示。下列说法正确的是( )
A.反应过程中溶液温度降低
B.A点对应溶液的溶质为NaOH、NaCl
C.恰好完全反应时溶液显中性
D.反应过程中溶液的颜色由红色变为无色
16.下列能说明醋酸具有酸性的是( )
A.有刺激性气味 B.常温下醋酸是无色液体
C.能使紫色石蕊试液变红 D.易溶于酒精和水
17.把生石灰、二氧化硫、食盐分别溶于水,在所得溶液中分别滴入紫色石蕊试液,溶液的颜色变化依次是( )
A.紫色、蓝色、红色 B.蓝色、红色、无色
C.蓝色、红色、紫色 D.红色、蓝色、紫色
二.填空题(共5小题)
18.将稀盐酸分别滴入盛有不同物质的试管中,如图所示。
(1)不能发生反应的是 (填序号,下同);
(2)有气泡产生的是 ;
(3)有浅绿色溶液产生的是 ;
(4)有蓝色溶液产生的是 ;
(5)溶液变成红色的是 。
19.某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是 ;编号②反应的金属单质是 。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是 反应。
(3)请你写出符合编号③反应的化学方程式 。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是 。
20.如图所示是Ca(OH)2的部分性质实验,回答有关问题。
(1)实验B的现象是 ;实验C的现象是: 。
(2)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀,取少量上层溶液与足量稀盐酸混合,无明显现象,综合分析可知:上层溶液中一定含有的溶质是酚酞和 ,可能含有的溶质是 。
21.同学们在整理实验室时,发现一瓶盛石灰水的试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
白色粉末的成分 形成的原因
可能是 CaCO3 石灰水与空气中CO2反应;
化学方程式为:__________________________________
可能是 ________ 暑假气温较高,溶质的溶解度降低或溶剂蒸发,
石灰水中的溶质结晶析出
经过反复思考,同学们认为白色粉末还可能是 CaCO3和Ca(OH)2的混合物
的混合物;
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是: ;
OH﹣ Cl﹣ CO32﹣ NO3﹣
Ca2+ 微 溶 不 溶
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤 可能观察到的现象 结论
取上述试管中的上层清液, 滴加1~2滴无色酚酞试液
往上述试管内残留的固体中加入稀盐酸
白色粉末中______(选填“有”或“无”)CaCO3
由上述实验可知白色粉末的成分是:____________________________________________________.
(3)实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可): ;
(4)质疑与反思: .
22.用“>”“=”或“<”填空
(1)有机物中,油脂中的元素种类 淀粉中的元素种类;
(2)家庭厨房用品中,纯碱溶液的pH 食醋的pH;
(3)电解水时与电源相连的试管内产生的气体体积,正极 负极;
(4)50mL水和50mL质量分数为98%浓硫酸混合,所得溶液质量分数 49%.
三.实验探究题(共4小题)
23.阿依、阿卓、阿牛春游时,发现了一株被太阳晒成紫红色的蒲公英,他们将其带回家洗净、捣碎,用阿达喝的老白干浸泡,再用纱布过滤,取其汁液,将其分成两份。已知紫红色蒲公英汁与紫色石蕊性质相同,请您预测:向一份中滴入食醋,会显 色,向另一份中滴加餐具洗洁精,会显 色。
24.氢氧化钠溶液和二氧化碳反应无明显现象,为验证CO2与NaOH能够发生反应,某同学用如图组装实验装置,并进行实验。
(1)先向瓶中逐滴加入氢氧化钠溶液,将观察到瓶中气球的现象是 。
(2)产生以上现象所发生的化学方程式为 。
(3)然后再向瓶中逐滴加入盐酸,将观察到瓶中气球的现象是 。
(4)写出(3)所发生的化学方程式 。
25.根据如图所示的回答问题。
(1)在白色点滴板1~6的孔穴中分别滴加2滴紫色石蕊溶液,溶液变为红色的孔穴有(填孔穴序号) 。再向孔穴4中滴加氢氧化钠溶液,溶液变为紫色,用化学方程式解释其原因: 。
(2)将试管①和②的现象相比较得到的结论是 。
(3)丙实验①是稀释浓硫酸的正确操作,M烧杯中的物质应是 。丙实验②电子秤上的量筒中盛有浓硫酸,放置一段时间,电子秤示数发生的变化及其原因是 。
26.根据如图所示的实验回答问题。
(1)甲实验中加入酚酞试液的目的是 ;
(2)乙实验利用控制变量法进行了对比,排除了水对实验的干扰,若观察到U形管左端的液面 (填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应,其反应的化学方程式为 ;
(3)实验丙中,在试管①、②中均可观察到的现象是 。试管①中发生反应的化学方程式是 。
四.计算题(共1小题)
27.实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液加入,溶液液的pH的变化如图所示。试回答:
(1)该反应实质是 ,a点溶液中含有的离子有 。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为 。
(3)计算稀H2SO4的溶质质量分数。
参考答案
一.选择题(共17小题)
1.D; 2.B; 3.C; 4.B; 5.D; 6.B; 7.D; 8.A; 9.B; 10.D; 11.B; 12.D; 13.C; 14.D; 15.C; 16.C; 17.C;
二.填空题(共5小题)
18.A;BC;B;D;E; 19.紫色石蕊溶液;铁;置换;Fe2O3+6HCl═2FeCl3+3H2O;产生白色沉淀; 20.溶液由红色变为无色;产生白色沉淀;NaCl;CaCl2; 21.Ca(OH)2微溶于水;CaCO3+2HCl═CaCl2+H2O+CO2↑;探究问题要严谨,不能想当然,要通过严密的实验得出结论.; 22.=;>;<;>;
三.实验探究题(共4小题)
23.红;蓝; 24.膨胀;2NaOH+CO2═Na2CO3+H2O;缩小;Na2CO3+2HCl═2NaCl+H2O+CO2↑; 25.1、4、6;2NaOH+H2SO4=Na2SO4+2H2O;相同温度下,不同物质在同种溶剂里的溶解性不同;浓硫酸;示数变大,浓硫酸具有吸水性; 26.指示盐酸与氢氧化钠溶液恰好完全反应;升高;2NaOH+CO2=Na2CO3+H2O;固体逐渐溶解,溶液变为黄色;Fe2O3+6HCl═2FeCl3+3H2O;
四.计算题(共1小题)
27.氢离子和氢氧根离子反应生成水;Na+、H+、SO42﹣;0.8g;
第1页(共4页)
一.选择题(共17小题)
1.能使无色酚酞试液变红色的溶液是( )
A.氯化钠溶液 B.盐酸
C.氯化铵溶液 D.氢氧化钠溶液
2.把质量相同的浓盐酸和浓硫酸,分别敞口置于天平的左右盘上,一段时间后指针( )
A.指向左边 B.指向右边 C.仍然平衡 D.无法判断
3.下列四组实验中,不能体现酸的通性的是( )
A. B.
C. D.
4.逻辑推理是化学学习中常用的思维方法。以下推理正确的是( )
A.碳酸钙能与盐酸反应产生气体,能与盐酸反应产生气体的固体物质一定是碳酸盐
B.水是氧化物,其中含有氧元素,但是含有氧元素的物质不一定都是氧化物
C.有机物中含有碳元素,所以含有碳元素的化合物一定是有机物
D.化学反应前后原子种类不变,化学反应前后分子种类也一定不变
5.下列不是氢氧化钠俗称的是( )
A.火碱 B.烧碱 C.苛性钠 D.纯碱
6.对反应X+3NaOH═3Y+Fe(OH)3↓的分析,错误的是( )
A.Y中一定含有Na元素 B.X可以是单质
C.Y可能是NaCl D.X可能是FeCl3
7.滴有酚酞的石灰水与适量的下列物质恰好完全反应后,酚酞仍显红色的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.碳酸钾溶液
8.某同学总结的Ca(OH)2的化学性质如图。下列说法错误的是( )
A.反应①甲一定是碳酸钠
B.反应②为中和反应
C.反应③可用于检验CO2气体
D.反应④向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
9.下列实验操作正确的是( )
A.测定溶液酸碱度 B.熄灭酒精灯
C.氧气验满 D.倾倒液体
10.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是( )
A.先用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用pH试纸测得石灰水的pH=8.5
D.用pH试纸测得盐酸的pH=1
11.生活中一些物质的pH如下:
物质 白醋 橙子汁 牛奶 厨房油污清洗剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.牛奶 B.厨房油污清洗剂
C.白醋 D.橙子汁
12.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.常温下,测得溶液的pH<7
B.溶液中滴入酚酞不显色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞显红色
13.下表是部分农作物生长对土壤pH的要求.如果某地区经常降酸雨,则该地区最不适合种植的农作物是( )
农作物 大豆 茶 玉米 马铃薯
pH 6.0~7.0 5.0~5.5 7.0~8.1 4.8~5.5
A.大豆 B.茶 C.玉米 D.马铃薯
14.下列生活经验没有应用酸碱反应原理的是( )
A.用熟石灰改良酸性土壤
B.用氢氧化钠溶液洗涤石油产品中的残留硫酸
C.用氢氧化铝治疗胃酸过多
D.用生石灰作干燥剂
15.向滴有酚酞的盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的pH与加入溶液体积关系如图所示。下列说法正确的是( )
A.反应过程中溶液温度降低
B.A点对应溶液的溶质为NaOH、NaCl
C.恰好完全反应时溶液显中性
D.反应过程中溶液的颜色由红色变为无色
16.下列能说明醋酸具有酸性的是( )
A.有刺激性气味 B.常温下醋酸是无色液体
C.能使紫色石蕊试液变红 D.易溶于酒精和水
17.把生石灰、二氧化硫、食盐分别溶于水,在所得溶液中分别滴入紫色石蕊试液,溶液的颜色变化依次是( )
A.紫色、蓝色、红色 B.蓝色、红色、无色
C.蓝色、红色、紫色 D.红色、蓝色、紫色
二.填空题(共5小题)
18.将稀盐酸分别滴入盛有不同物质的试管中,如图所示。
(1)不能发生反应的是 (填序号,下同);
(2)有气泡产生的是 ;
(3)有浅绿色溶液产生的是 ;
(4)有蓝色溶液产生的是 ;
(5)溶液变成红色的是 。
19.某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是 ;编号②反应的金属单质是 。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是 反应。
(3)请你写出符合编号③反应的化学方程式 。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是 。
20.如图所示是Ca(OH)2的部分性质实验,回答有关问题。
(1)实验B的现象是 ;实验C的现象是: 。
(2)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀,取少量上层溶液与足量稀盐酸混合,无明显现象,综合分析可知:上层溶液中一定含有的溶质是酚酞和 ,可能含有的溶质是 。
21.同学们在整理实验室时,发现一瓶盛石灰水的试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
白色粉末的成分 形成的原因
可能是 CaCO3 石灰水与空气中CO2反应;
化学方程式为:__________________________________
可能是 ________ 暑假气温较高,溶质的溶解度降低或溶剂蒸发,
石灰水中的溶质结晶析出
经过反复思考,同学们认为白色粉末还可能是 CaCO3和Ca(OH)2的混合物
的混合物;
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是: ;
OH﹣ Cl﹣ CO32﹣ NO3﹣
Ca2+ 微 溶 不 溶
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤 可能观察到的现象 结论
取上述试管中的上层清液, 滴加1~2滴无色酚酞试液
往上述试管内残留的固体中加入稀盐酸
白色粉末中______(选填“有”或“无”)CaCO3
由上述实验可知白色粉末的成分是:____________________________________________________.
(3)实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可): ;
(4)质疑与反思: .
22.用“>”“=”或“<”填空
(1)有机物中,油脂中的元素种类 淀粉中的元素种类;
(2)家庭厨房用品中,纯碱溶液的pH 食醋的pH;
(3)电解水时与电源相连的试管内产生的气体体积,正极 负极;
(4)50mL水和50mL质量分数为98%浓硫酸混合,所得溶液质量分数 49%.
三.实验探究题(共4小题)
23.阿依、阿卓、阿牛春游时,发现了一株被太阳晒成紫红色的蒲公英,他们将其带回家洗净、捣碎,用阿达喝的老白干浸泡,再用纱布过滤,取其汁液,将其分成两份。已知紫红色蒲公英汁与紫色石蕊性质相同,请您预测:向一份中滴入食醋,会显 色,向另一份中滴加餐具洗洁精,会显 色。
24.氢氧化钠溶液和二氧化碳反应无明显现象,为验证CO2与NaOH能够发生反应,某同学用如图组装实验装置,并进行实验。
(1)先向瓶中逐滴加入氢氧化钠溶液,将观察到瓶中气球的现象是 。
(2)产生以上现象所发生的化学方程式为 。
(3)然后再向瓶中逐滴加入盐酸,将观察到瓶中气球的现象是 。
(4)写出(3)所发生的化学方程式 。
25.根据如图所示的回答问题。
(1)在白色点滴板1~6的孔穴中分别滴加2滴紫色石蕊溶液,溶液变为红色的孔穴有(填孔穴序号) 。再向孔穴4中滴加氢氧化钠溶液,溶液变为紫色,用化学方程式解释其原因: 。
(2)将试管①和②的现象相比较得到的结论是 。
(3)丙实验①是稀释浓硫酸的正确操作,M烧杯中的物质应是 。丙实验②电子秤上的量筒中盛有浓硫酸,放置一段时间,电子秤示数发生的变化及其原因是 。
26.根据如图所示的实验回答问题。
(1)甲实验中加入酚酞试液的目的是 ;
(2)乙实验利用控制变量法进行了对比,排除了水对实验的干扰,若观察到U形管左端的液面 (填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应,其反应的化学方程式为 ;
(3)实验丙中,在试管①、②中均可观察到的现象是 。试管①中发生反应的化学方程式是 。
四.计算题(共1小题)
27.实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液加入,溶液液的pH的变化如图所示。试回答:
(1)该反应实质是 ,a点溶液中含有的离子有 。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为 。
(3)计算稀H2SO4的溶质质量分数。
参考答案
一.选择题(共17小题)
1.D; 2.B; 3.C; 4.B; 5.D; 6.B; 7.D; 8.A; 9.B; 10.D; 11.B; 12.D; 13.C; 14.D; 15.C; 16.C; 17.C;
二.填空题(共5小题)
18.A;BC;B;D;E; 19.紫色石蕊溶液;铁;置换;Fe2O3+6HCl═2FeCl3+3H2O;产生白色沉淀; 20.溶液由红色变为无色;产生白色沉淀;NaCl;CaCl2; 21.Ca(OH)2微溶于水;CaCO3+2HCl═CaCl2+H2O+CO2↑;探究问题要严谨,不能想当然,要通过严密的实验得出结论.; 22.=;>;<;>;
三.实验探究题(共4小题)
23.红;蓝; 24.膨胀;2NaOH+CO2═Na2CO3+H2O;缩小;Na2CO3+2HCl═2NaCl+H2O+CO2↑; 25.1、4、6;2NaOH+H2SO4=Na2SO4+2H2O;相同温度下,不同物质在同种溶剂里的溶解性不同;浓硫酸;示数变大,浓硫酸具有吸水性; 26.指示盐酸与氢氧化钠溶液恰好完全反应;升高;2NaOH+CO2=Na2CO3+H2O;固体逐渐溶解,溶液变为黄色;Fe2O3+6HCl═2FeCl3+3H2O;
四.计算题(共1小题)
27.氢离子和氢氧根离子反应生成水;Na+、H+、SO42﹣;0.8g;
第1页(共4页)
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
