新教材高中化学合格性考试(广东)-模拟测试卷(三) 原卷版+解析版
文档属性
| 名称 | 新教材高中化学合格性考试(广东)-模拟测试卷(三) 原卷版+解析版 |  | |
| 格式 | doc | ||
| 文件大小 | 742.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 22:11:28 | ||
图片预览




文档简介
高中学业水平合格性考试模拟测试卷(三)
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
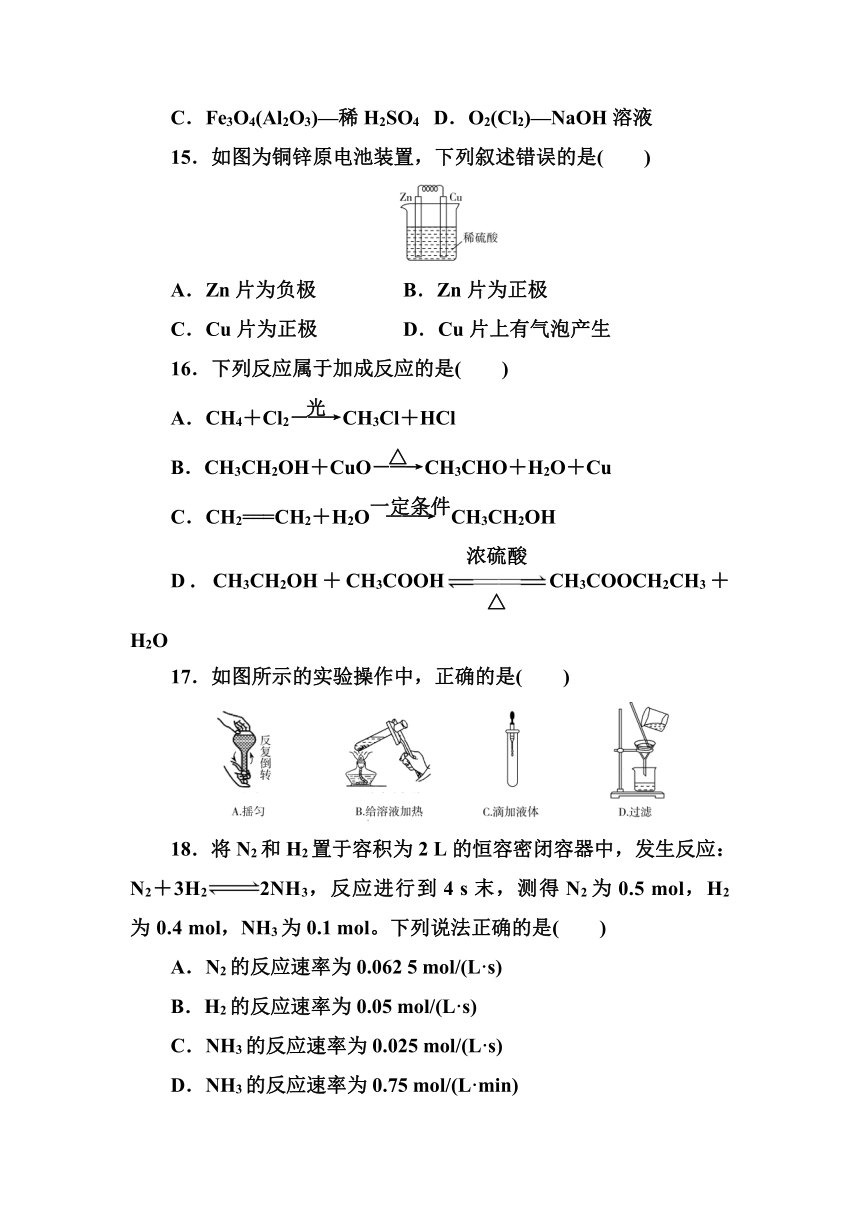
1.下列物质中属于重要的抗生素、消炎药的是( )
A.青霉素 B.水
C.酱油 D.纤维素
2.下列物质属于混合物的是( )
A.氨水 B.冰醋酸
C.液氯 D.碳酸钠
3.氢有三种同位素H、H和H,它们之间不同的是( )
A.质量数 B.电子数
C.原子序数 D.质子数
4.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中( )
A.饱和食盐水 B.饱和纯碱溶液
C.饱和小苏打溶液 D.浓硫酸
5.下列我国古代发明或技术中,主要原理不是化学变化的是( )
A.炭黑制墨 B.粮食酿酒
C.胆矾炼铜 D.燃放烟火
6.下列有关乙烯的叙述错误的是( )
A.比空气的密度大
B.可用作植物生长调节剂
C.可以使溴的CCl4溶液褪色
D.点燃的条件下可以在空气中燃烧
7.下列物质中,含有极性共价键的离子化合物是( )
A.HF B.Ba(OH)2
C.NaCl D.Cl2
8.下列反应中,氯元素失去电子的是( )
A.2KClO32KCl+3O2↑
B.2P+5Cl22PCl5
C.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
D.H2+Cl22HCl
9.下列离子方程式书写正确的是( )
A.碳酸钠与足量盐酸反应:CO+2H+===H2O+CO2↑
B.铁粉与稀硫酸反应:Fe+6H+===2Fe3++3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl+OH-===H2O+Cl-
D.稀硝酸滴在石灰石上:CO+2H+===H2O+CO2↑
10.下列物质中含有两种官能团的是( )
A.乳酸
B.苯乙烯
C.丙三醇
D.甲苯
11.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.常温下,淀粉遇碘单质变蓝
B.蔗糖水解的最终产物只有葡萄糖
C.植物油不能发生水解反应
D.蛋白质由C、H、O三种元素组成
12.下列有关材料的说法正确的是( )
A.“神舟”飞船航天员穿的航天服使用的多种合成纤维是天然有机高分子材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
D.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
13.下列物质间的反应,其能量变化符合如图的是( )
A.碳酸钙的分解
B.灼热的炭与水蒸气反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.钠与水反应
14.下列除去括号中的杂质所用试剂正确的是( )
A.Al(Cu)—稀盐酸 B.Fe2(SO4)3[FeSO4]—Cl2
C.Fe3O4(Al2O3)—稀H2SO4 D.O2(Cl2)—NaOH溶液
15.如图为铜锌原电池装置,下列叙述错误的是( )
A.Zn片为负极 B.Zn片为正极
C.Cu片为正极 D.Cu片上有气泡产生
16.下列反应属于加成反应的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH3CH2OH+CuOCH3CHO+H2O+Cu
C.CH2===CH2+H2OCH3CH2OH
D.CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
17.如图所示的实验操作中,正确的是( )
18.将N2和H2置于容积为2 L的恒容密闭容器中,发生反应:N2+3H22NH3,反应进行到4 s末,测得N2为0.5 mol,H2为0.4 mol,NH3为0.1 mol。下列说法正确的是( )
A.N2的反应速率为0.062 5 mol/(L·s)
B.H2的反应速率为0.05 mol/(L·s)
C.NH3的反应速率为0.025 mol/(L·s)
D.NH3的反应速率为0.75 mol/(L·min)
19.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为1 120 mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 L H2O含有的H2O分子数为0.1NA
20.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去。下列有关说法正确的是( )
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在常温下即可完全反应
C.若A为碳单质,C在常温下为气体,则将C通入少量的澄清石灰水中,一定能观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
① ② ③
3 ④
⑤
⑥ ⑦ ⑧
4 ⑨
(1)在这些元素中化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物是________,碱性最强的化合物是________。
(3)最高价氧化物是两性氧化物的元素是________。
(4)元素④与⑥形成的化合物属于____________(填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式__________________。
(6)写出⑥的原子结构示意图____________。
22.(13分)实验室制备并收集干燥、纯净氯气的装置如图所示。
请回答下列问题:
(1)写出实验室制备Cl2的化学方程式:___________________。
(2)写出指定试剂的名称:C____________,D____________。
(3)C的作用是____________________,D的作用是______________________,F的作用是______________________。
(4)检验氯气是否收集满的操作:______________________。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是_______________,若反应产生0.5 mol Cl2,则消耗的氧化剂的物质的量为________mol,反应转移的电子数是____________。
23.(14分)A、B、C、D、E、F、G均为常见的有机物,它们之间有如图1所示转化关系。已知:①A是一种植物生长调节剂,有催熟作用;②醛基在氧气中易被氧化成羧基。
图1
回答下列问题:
(1)A和B中官能团名称分别是____________和____________。
(2)在F的众多同系物中,最简单的同系物其空间构型为________________;含5个碳原子的同系物其同分异构体有________种,其中一氯代物种类最少的同系物的结构简式为____________。
(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应该选用反应________。
(4)反应①~⑦属取代反应的有________;反应②的化学方程式为_____________________________________________________。
(5)某同学欲用图2所示装置制备物质E,将试管Ⅱ中的物质E分离出来,用到的主要玻璃仪器有:烧杯、________,插入试管Ⅱ的导管接有一个球状物,其作用为____________________________。
高中学业水平合格性考试模拟测试卷(三)解析版
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质中属于重要的抗生素、消炎药的是( )
A.青霉素 B.水
C.酱油 D.纤维素
解析:英国细菌学家首先发现青霉素,青霉素是具有强大杀菌作用的药物,是最重要的抗生素,使用青霉素的主要不良反应是过敏反应,所以使用青霉素前使用者一定要进行皮肤敏感试验,答案选A。
答案:A
2.下列物质属于混合物的是( )
A.氨水 B.冰醋酸
C.液氯 D.碳酸钠
解析:氨气溶于水形成氨水,氨水属于混合物,故A项符合题意;冰醋酸由乙酸分子构成,属于纯净物,故B项不符合题意;液氯由氯分子构成,属于纯净物,故C项不符合题意;碳酸钠由一种物质组成,属于纯净物,故D项不符合题意。
答案:A
3.氢有三种同位素H、H和H,它们之间不同的是( )
A.质量数 B.电子数
C.原子序数 D.质子数
解析:H、H和H为氢元素的核素,具有相同的质子数,不同中子数,其质量数也不同。
答案:A
4.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中( )
A.饱和食盐水 B.饱和纯碱溶液
C.饱和小苏打溶液 D.浓硫酸
解析:饱和食盐水不与SO2反应,A项不符合题意;饱和纯碱溶液,既可与CO2反应生成碳酸氢钠,又可与二氧化硫反应生成硫酸钠,B项不符合题意;饱和小苏打溶液,只吸收二氧化硫不吸收二氧化碳,C项符合题意;浓硫酸,都不与两者反应,D项不符合题意。
答案:C
5.下列我国古代发明或技术中,主要原理不是化学变化的是( )
A.炭黑制墨 B.粮食酿酒
C.胆矾炼铜 D.燃放烟火
解析:炭黑制墨,没有新物质产生,是物理变化,A项符合题意;粮食酿酒,产生了新物质(如酒精),是化学变化,B项不符合题意;胆矾炼铜,产生新物质铜,是化学变化,C项不符合题意;燃放烟火,产生了新物质,是化学变化,D项不符合题意。
答案:A
6.下列有关乙烯的叙述错误的是( )
A.比空气的密度大
B.可用作植物生长调节剂
C.可以使溴的CCl4溶液褪色
D.点燃的条件下可以在空气中燃烧
解析:空气的平均相对分子质量为29,乙烯的相对分子质量为28,比空气的略小,则乙烯的密度比空气的密度略小,故A项错误;乙烯可用作植物生长调节剂,故B项正确;乙烯分子中含有碳碳双键,可以和溴的溶液发生加成反应,使溴的CCl4溶液褪色,故C项正确;乙烯在点燃的条件下可以在空气中燃烧,生成二氧化碳和水,故D项正确。
答案:A
7.下列物质中,含有极性共价键的离子化合物是( )
A.HF B.Ba(OH)2
C.NaCl D.Cl2
解析:HF为共价化合物,A项不符合题意;Ba(OH)2中氢氧根和钡离子之间形成离子键,氢氧根中氢原子和氧原子之间为极性共价键,B项符合题意;NaCl中只有钠离子与氯离子形成的离子键,C项不符合题意;Cl2中只有Cl—Cl非极性共价键,且属于单质,D项不符合题意。
答案:B
8.下列反应中,氯元素失去电子的是( )
A.2KClO32KCl+3O2↑
B.2P+5Cl22PCl5
C.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
D.H2+Cl22HCl
解析:氯元素失去电子的反应就是反应中的氯元素化合价升高的反应,C项中氯元素的化合价由-1价升高到0价。
答案:C
9.下列离子方程式书写正确的是( )
A.碳酸钠与足量盐酸反应:CO+2H+===H2O+CO2↑
B.铁粉与稀硫酸反应:Fe+6H+===2Fe3++3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl+OH-===H2O+Cl-
D.稀硝酸滴在石灰石上:CO+2H+===H2O+CO2↑
解析:Na2CO3和HCl均为强电解质,离子方程式中可以拆分;此外,足量的盐酸会与碳酸钠反应生成CO2气体,A项正确;稀硫酸与Fe反应只能生成Fe2+,B项错误;HCl为强电解质,离子方程式中需要拆分成离子,C项错误;石灰石的成分主要是CaCO3,是难溶物,离子方程式中不可以拆分,D项错误。
答案:A
10.下列物质中含有两种官能团的是( )
A.乳酸
B.苯乙烯
C.丙三醇
D.甲苯
解析:乳酸中含有羟基—OH和羧基—COOH两种官能团,A项正确;苯乙烯中含有碳碳双键一种官能团,B项错误;丙三醇中含有羟基—OH一种官能团,C项错误;甲苯中没有官能团,D项错误。
答案:A
11.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.常温下,淀粉遇碘单质变蓝
B.蔗糖水解的最终产物只有葡萄糖
C.植物油不能发生水解反应
D.蛋白质由C、H、O三种元素组成
解析:常温下,淀粉遇碘变蓝,指的是碘单质,A项正确;蔗糖水解的产物除了葡萄糖外还有果糖,麦芽糖水解的产物只有葡萄糖,B项错误;植物油属于酯类,酯类能发生水解,C项错误;组成蛋白质的元素一定有C、H、O、N,D项错误。
答案:A
12.下列有关材料的说法正确的是( )
A.“神舟”飞船航天员穿的航天服使用的多种合成纤维是天然有机高分子材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
D.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
解析:合成纤维属于人工合成的有机高分子,不是天然有机高分子,故A项错误;石墨烯属于碳的单质,是新型无机非金属材料,故B项正确;钢缆属于合金,故C项错误;太阳能电池板的主要材料是硅单质,故D项错误。
答案:B
13.下列物质间的反应,其能量变化符合如图的是( )
A.碳酸钙的分解
B.灼热的炭与水蒸气反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.钠与水反应
解析:碳酸钙的分解是吸热反应,故A项错误;灼热的炭与水蒸气反应是吸热反应,故B项错误;Ba(OH)2·8H2O晶体和NH4Cl晶体混合是吸热反应,故C项错误;钠与水反应是放热反应,故D项正确。
答案:D
14.下列除去括号中的杂质所用试剂正确的是( )
A.Al(Cu)—稀盐酸 B.Fe2(SO4)3[FeSO4]—Cl2
C.Fe3O4(Al2O3)—稀H2SO4 D.O2(Cl2)—NaOH溶液
解析:稀盐酸不能和Cu反应,能和Al反应,所以可以除去Cu中的Al,但不能除去Al中的Cu,A项错误;氯气虽然能将亚铁离子氧化,但同时会引入新的杂质氯离子,B项错误;Fe3O4和Al2O3都能与稀硫酸反应,C项错误;氯气可以和NaOH溶液反应,而氧气不反应,且难溶,故可以用NaOH溶液除去氧气中混有的氯气,D项正确。
答案:D
15.如图为铜锌原电池装置,下列叙述错误的是( )
A.Zn片为负极 B.Zn片为正极
C.Cu片为正极 D.Cu片上有气泡产生
解析:Zn比Cu活泼,Zn作负极,故A项正确;Zn作负极,故B项错误;Zn比Cu活泼,Cu片为正极,故C项正确;铜作正极,发生2H++2e-===H2↑,Cu片上有气泡产生,故D项正确。
答案:B
16.下列反应属于加成反应的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH3CH2OH+CuOCH3CHO+H2O+Cu
C.CH2===CH2+H2OCH3CH2OH
D.CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
解析:CH4+Cl2CH3Cl+HCl属于取代反应,故A项不符合题意;CH3CH2OH+CuOCH3CHO+H2O+Cu属于氧化反应,故B项不符合题意;CH2===CH2+H2OCH3CH2OH属于加成反应,故C项符合题意;CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O属于酯化反应,故D项不符合题意。
答案:C
17.如图所示的实验操作中,正确的是( )
解析:图示采用上、下颠倒振荡的方式将已配好的溶液摇匀,操作规范合理,故A项正确;给试管中的液体加热时,应使用酒精灯的外焰进行加热,且液体体积不超过试管体积的三分之一,且手持试管夹的方式错误,图中操作不合理,故B项错误;一般来说,用胶头滴管滴加液体时,滴管不能深入到试管中,否则可能会污染试剂,应该垂直悬空加入,图示操作不合理,故C项错误;过滤液体时,要注意“一贴、二低、三靠”的原则,图示装置中分液漏斗下端没有紧贴烧杯内壁,操作不合理,故D项错误。
答案:A
18.将N2和H2置于容积为2 L的恒容密闭容器中,发生反应:N2+3H22NH3,反应进行到4 s末,测得N2为0.5 mol,H2为0.4 mol,NH3为0.1 mol。下列说法正确的是( )
A.N2的反应速率为0.062 5 mol/(L·s)
B.H2的反应速率为0.05 mol/(L·s)
C.NH3的反应速率为0.025 mol/(L·s)
D.NH3的反应速率为0.75 mol/(L·min)
解析:v(NH3)==0.012 5 mol/(L·s)=0.75 mol/(L·min),则v(N2)=×v(NH3)=×0.012 5 mol/(L·s)=0.006 25 mol/(L·s),v(H2)=×v(NH3)=×0.012 5 mol/(L·s)=0.018 75 mol/(L·s),答案选D。
答案:D
19.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为1 120 mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 L H2O含有的H2O分子数为0.1NA
解析:没有告诉0.5 mol·L-1 MgCl2溶液的体积,无法计算溶液中氯离子的物质的量及数目,故A项错误;根据反应:Zn+2HCl===ZnCl2+H2↑可知,0.1 mol Zn与含0.1 mol HCl的盐酸充分反应时HCl不足,生成氢气的物质的量n(H2)=n(HCl)=0.1 mol×=0.05 mol,所制得的H2在标准状况下的体积0.05 mol×22.4 L/mol=1.12 L=1 120 mL,选项中没有说明是否是标准状况下,故B项错误;n(O2)==0.1 mol,氧气是双原子分子,则含有原子数为0.2NA,故C项正确;标准状况下,水不是气体,不能使用标准状况下的气体摩尔体积计算2.24 L水的物质的量,故D项错误。
答案:C
20.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去。下列有关说法正确的是( )
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在常温下即可完全反应
C.若A为碳单质,C在常温下为气体,则将C通入少量的澄清石灰水中,一定能观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
解析:浓硫酸使蔗糖变黑,主要体现了浓硫酸的脱水性,故A项错误;若A为铁,则常温下足量铁在浓硫酸中发生钝化,故B项错误;若A为碳单质,C在常温下为气体,则C为CO2,故将CO2通入少量的澄清石灰水中生成Ca(HCO3)2,在反应过程中很难观察到有白色沉淀生成,故C项错误;SO2转化为SO3的反应是工业制H2SO4过程中重要的一步反应,故D项正确。
答案:D
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
① ② ③
3 ④
⑤
⑥ ⑦ ⑧
4 ⑨
(1)在这些元素中化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物是________,碱性最强的化合物是________。
(3)最高价氧化物是两性氧化物的元素是________。
(4)元素④与⑥形成的化合物属于____________(填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式__________________。
(6)写出⑥的原子结构示意图____________。
解析:根据元素周期表,表中的①~⑨号元素分别是C、N、O、Na、Al、S、Cl、Ar、K。
(1)Ar最外层有8个电子,结构稳定,所以在这些元素中,化学性质最不活泼的是Ar。(2)非金属性越强,最高价氧化物的水化物酸性越强,酸性最强的化合物是HClO4;金属性越强,最高价氧化物的水化物的碱性越强,碱性最强的化合物是KOH。(3)氧化铝既能与酸反应又能与碱反应,所以最高价氧化物是两性氧化物的元素是Al。(4)Na元素是活泼金属,S元素是活泼非金属,形成的化合物是Na2S,Na2S属于离子化合物。(5)C与Cl形成的化合物的化学式是CCl4。(6)⑥是S元素,核外有3个电子层、最外层有6个电子,原子结构示意图是。
答案:(1)Ar HClO4 KOH (3)Al (4)离子 (5)CCl4 (6)
22.(13分)实验室制备并收集干燥、纯净氯气的装置如图所示。
请回答下列问题:
(1)写出实验室制备Cl2的化学方程式:___________________。
(2)写出指定试剂的名称:C____________,D____________。
(3)C的作用是____________________,D的作用是______________________,F的作用是______________________。
(4)检验氯气是否收集满的操作:______________________。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是_______________,若反应产生0.5 mol Cl2,则消耗的氧化剂的物质的量为________mol,反应转移的电子数是____________。
解析:(1)实验室用浓盐酸和二氧化锰共热来制取氯气。(2)氯气中杂质有挥发出来的氯化氢和水蒸气,C装饱和氯化钠溶液除去氯化氢,D中装浓硫酸进行干燥。(3)氯气中的杂质有挥发出来的氯化氢和水蒸气,C装饱和氯化钠溶液除去氯化氢,D中装浓硫酸进行干燥,氯气有毒,尾气需要处理,F中可用氢氧化钠溶液处理尾气。(4)氯气有强氧化性,可使湿润的淀粉碘化钾试纸变蓝。(5)题给反应中氯化氢中部分氯元素化合价降低;部分氯元素作盐中的阴离子,体现了还原性和酸性;反应中氯元素由-1价到0价,锰元素由+7价到+2价,降低5价,故生成1个氯气分子转移两个电子,消耗个氧化剂,所以产生0.5 mol Cl2,则消耗的氧化剂的物质的量为0.2 mol,反应转移的电子数是NA。
答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)饱和食盐水 浓硫酸
(3)除去氯气中混有的氯化氢气体 干燥氯气 吸收氯气,防止污染空气
(4)用湿润的淀粉碘化钾试纸靠近集气瓶口,若试纸变蓝,说明氯气已收集满
(5)还原性和酸性 0.2 mol NA
23.(14分)A、B、C、D、E、F、G均为常见的有机物,它们之间有如图1所示转化关系。已知:①A是一种植物生长调节剂,有催熟作用;②醛基在氧气中易被氧化成羧基。
图1
回答下列问题:
(1)A和B中官能团名称分别是____________和____________。
(2)在F的众多同系物中,最简单的同系物其空间构型为________________;含5个碳原子的同系物其同分异构体有________种,其中一氯代物种类最少的同系物的结构简式为____________。
(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应该选用反应________。
(4)反应①~⑦属取代反应的有________;反应②的化学方程式为_____________________________________________________。
(5)某同学欲用图2所示装置制备物质E,将试管Ⅱ中的物质E分离出来,用到的主要玻璃仪器有:烧杯、________,插入试管Ⅱ的导管接有一个球状物,其作用为____________________________。
解析:A是一种植物生长调节剂,有催熟作用,则A为CH2===CH2;乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,乙烯与氢气发生加成反应生成F为C2H6,乙烯与HCl发生生成G为CH3CH2Cl,乙烷与氯气发生取代反应生成氯乙烷,据此分析解答。(1)由上述分析可知,A为CH2===CH2,含有官能团为碳碳双键,B为CH3CH2OH,含有官能团为羟基。(2)由上述分析可知,F为C2H6,在F的同系物中,最简单的有机物为甲烷,空间构型为正四面体形,与F互为同系物的含5个碳原子的所有同分异构体的结构简式:CH3CH2CH2CH2CH3,CH3CH2CH(CH3)2,C(CH3)4,共3种,其中一氯代物种类最少的为C(CH3)4。(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应选择⑦,⑦为加成反应,产物较纯净。(4)由转化关系可知①⑤⑦为加成反应,②③为氧化反应,④⑥为取代反应,反应④中,浓硫酸的作用是催化剂和吸水剂。反应②的化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。(5)实验室制备物质E即CH3COOCH2CH3,由于CH3COOCH2CH3不溶于饱和碳酸钠溶液,将试管Ⅱ中的物质E分离出来采用分液法,故用到的主要玻璃仪器有烧杯、分液漏斗,由于试管Ⅰ有加热装置,故Ⅱ中易发生倒吸现象,引发事故,故插入试管Ⅱ的导管接有一个球状物,其作用为防止倒吸。
答案:(1)碳碳双键 羟基
(2)正四面体形 3 C(CH3)4
(3)⑦
(4)④⑥ 2CH3CH2OH+O22CH3CHO+2H2O
(5)分液漏斗 防倒吸
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质中属于重要的抗生素、消炎药的是( )
A.青霉素 B.水
C.酱油 D.纤维素
2.下列物质属于混合物的是( )
A.氨水 B.冰醋酸
C.液氯 D.碳酸钠
3.氢有三种同位素H、H和H,它们之间不同的是( )
A.质量数 B.电子数
C.原子序数 D.质子数
4.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中( )
A.饱和食盐水 B.饱和纯碱溶液
C.饱和小苏打溶液 D.浓硫酸
5.下列我国古代发明或技术中,主要原理不是化学变化的是( )
A.炭黑制墨 B.粮食酿酒
C.胆矾炼铜 D.燃放烟火
6.下列有关乙烯的叙述错误的是( )
A.比空气的密度大
B.可用作植物生长调节剂
C.可以使溴的CCl4溶液褪色
D.点燃的条件下可以在空气中燃烧
7.下列物质中,含有极性共价键的离子化合物是( )
A.HF B.Ba(OH)2
C.NaCl D.Cl2
8.下列反应中,氯元素失去电子的是( )
A.2KClO32KCl+3O2↑
B.2P+5Cl22PCl5
C.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
D.H2+Cl22HCl
9.下列离子方程式书写正确的是( )
A.碳酸钠与足量盐酸反应:CO+2H+===H2O+CO2↑
B.铁粉与稀硫酸反应:Fe+6H+===2Fe3++3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl+OH-===H2O+Cl-
D.稀硝酸滴在石灰石上:CO+2H+===H2O+CO2↑
10.下列物质中含有两种官能团的是( )
A.乳酸
B.苯乙烯
C.丙三醇
D.甲苯
11.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.常温下,淀粉遇碘单质变蓝
B.蔗糖水解的最终产物只有葡萄糖
C.植物油不能发生水解反应
D.蛋白质由C、H、O三种元素组成
12.下列有关材料的说法正确的是( )
A.“神舟”飞船航天员穿的航天服使用的多种合成纤维是天然有机高分子材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
D.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
13.下列物质间的反应,其能量变化符合如图的是( )
A.碳酸钙的分解
B.灼热的炭与水蒸气反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.钠与水反应
14.下列除去括号中的杂质所用试剂正确的是( )
A.Al(Cu)—稀盐酸 B.Fe2(SO4)3[FeSO4]—Cl2
C.Fe3O4(Al2O3)—稀H2SO4 D.O2(Cl2)—NaOH溶液
15.如图为铜锌原电池装置,下列叙述错误的是( )
A.Zn片为负极 B.Zn片为正极
C.Cu片为正极 D.Cu片上有气泡产生
16.下列反应属于加成反应的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH3CH2OH+CuOCH3CHO+H2O+Cu
C.CH2===CH2+H2OCH3CH2OH
D.CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
17.如图所示的实验操作中,正确的是( )
18.将N2和H2置于容积为2 L的恒容密闭容器中,发生反应:N2+3H22NH3,反应进行到4 s末,测得N2为0.5 mol,H2为0.4 mol,NH3为0.1 mol。下列说法正确的是( )
A.N2的反应速率为0.062 5 mol/(L·s)
B.H2的反应速率为0.05 mol/(L·s)
C.NH3的反应速率为0.025 mol/(L·s)
D.NH3的反应速率为0.75 mol/(L·min)
19.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为1 120 mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 L H2O含有的H2O分子数为0.1NA
20.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去。下列有关说法正确的是( )
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在常温下即可完全反应
C.若A为碳单质,C在常温下为气体,则将C通入少量的澄清石灰水中,一定能观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
① ② ③
3 ④
⑤
⑥ ⑦ ⑧
4 ⑨
(1)在这些元素中化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物是________,碱性最强的化合物是________。
(3)最高价氧化物是两性氧化物的元素是________。
(4)元素④与⑥形成的化合物属于____________(填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式__________________。
(6)写出⑥的原子结构示意图____________。
22.(13分)实验室制备并收集干燥、纯净氯气的装置如图所示。
请回答下列问题:
(1)写出实验室制备Cl2的化学方程式:___________________。
(2)写出指定试剂的名称:C____________,D____________。
(3)C的作用是____________________,D的作用是______________________,F的作用是______________________。
(4)检验氯气是否收集满的操作:______________________。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是_______________,若反应产生0.5 mol Cl2,则消耗的氧化剂的物质的量为________mol,反应转移的电子数是____________。
23.(14分)A、B、C、D、E、F、G均为常见的有机物,它们之间有如图1所示转化关系。已知:①A是一种植物生长调节剂,有催熟作用;②醛基在氧气中易被氧化成羧基。
图1
回答下列问题:
(1)A和B中官能团名称分别是____________和____________。
(2)在F的众多同系物中,最简单的同系物其空间构型为________________;含5个碳原子的同系物其同分异构体有________种,其中一氯代物种类最少的同系物的结构简式为____________。
(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应该选用反应________。
(4)反应①~⑦属取代反应的有________;反应②的化学方程式为_____________________________________________________。
(5)某同学欲用图2所示装置制备物质E,将试管Ⅱ中的物质E分离出来,用到的主要玻璃仪器有:烧杯、________,插入试管Ⅱ的导管接有一个球状物,其作用为____________________________。
高中学业水平合格性考试模拟测试卷(三)解析版
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质中属于重要的抗生素、消炎药的是( )
A.青霉素 B.水
C.酱油 D.纤维素
解析:英国细菌学家首先发现青霉素,青霉素是具有强大杀菌作用的药物,是最重要的抗生素,使用青霉素的主要不良反应是过敏反应,所以使用青霉素前使用者一定要进行皮肤敏感试验,答案选A。
答案:A
2.下列物质属于混合物的是( )
A.氨水 B.冰醋酸
C.液氯 D.碳酸钠
解析:氨气溶于水形成氨水,氨水属于混合物,故A项符合题意;冰醋酸由乙酸分子构成,属于纯净物,故B项不符合题意;液氯由氯分子构成,属于纯净物,故C项不符合题意;碳酸钠由一种物质组成,属于纯净物,故D项不符合题意。
答案:A
3.氢有三种同位素H、H和H,它们之间不同的是( )
A.质量数 B.电子数
C.原子序数 D.质子数
解析:H、H和H为氢元素的核素,具有相同的质子数,不同中子数,其质量数也不同。
答案:A
4.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中( )
A.饱和食盐水 B.饱和纯碱溶液
C.饱和小苏打溶液 D.浓硫酸
解析:饱和食盐水不与SO2反应,A项不符合题意;饱和纯碱溶液,既可与CO2反应生成碳酸氢钠,又可与二氧化硫反应生成硫酸钠,B项不符合题意;饱和小苏打溶液,只吸收二氧化硫不吸收二氧化碳,C项符合题意;浓硫酸,都不与两者反应,D项不符合题意。
答案:C
5.下列我国古代发明或技术中,主要原理不是化学变化的是( )
A.炭黑制墨 B.粮食酿酒
C.胆矾炼铜 D.燃放烟火
解析:炭黑制墨,没有新物质产生,是物理变化,A项符合题意;粮食酿酒,产生了新物质(如酒精),是化学变化,B项不符合题意;胆矾炼铜,产生新物质铜,是化学变化,C项不符合题意;燃放烟火,产生了新物质,是化学变化,D项不符合题意。
答案:A
6.下列有关乙烯的叙述错误的是( )
A.比空气的密度大
B.可用作植物生长调节剂
C.可以使溴的CCl4溶液褪色
D.点燃的条件下可以在空气中燃烧
解析:空气的平均相对分子质量为29,乙烯的相对分子质量为28,比空气的略小,则乙烯的密度比空气的密度略小,故A项错误;乙烯可用作植物生长调节剂,故B项正确;乙烯分子中含有碳碳双键,可以和溴的溶液发生加成反应,使溴的CCl4溶液褪色,故C项正确;乙烯在点燃的条件下可以在空气中燃烧,生成二氧化碳和水,故D项正确。
答案:A
7.下列物质中,含有极性共价键的离子化合物是( )
A.HF B.Ba(OH)2
C.NaCl D.Cl2
解析:HF为共价化合物,A项不符合题意;Ba(OH)2中氢氧根和钡离子之间形成离子键,氢氧根中氢原子和氧原子之间为极性共价键,B项符合题意;NaCl中只有钠离子与氯离子形成的离子键,C项不符合题意;Cl2中只有Cl—Cl非极性共价键,且属于单质,D项不符合题意。
答案:B
8.下列反应中,氯元素失去电子的是( )
A.2KClO32KCl+3O2↑
B.2P+5Cl22PCl5
C.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
D.H2+Cl22HCl
解析:氯元素失去电子的反应就是反应中的氯元素化合价升高的反应,C项中氯元素的化合价由-1价升高到0价。
答案:C
9.下列离子方程式书写正确的是( )
A.碳酸钠与足量盐酸反应:CO+2H+===H2O+CO2↑
B.铁粉与稀硫酸反应:Fe+6H+===2Fe3++3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl+OH-===H2O+Cl-
D.稀硝酸滴在石灰石上:CO+2H+===H2O+CO2↑
解析:Na2CO3和HCl均为强电解质,离子方程式中可以拆分;此外,足量的盐酸会与碳酸钠反应生成CO2气体,A项正确;稀硫酸与Fe反应只能生成Fe2+,B项错误;HCl为强电解质,离子方程式中需要拆分成离子,C项错误;石灰石的成分主要是CaCO3,是难溶物,离子方程式中不可以拆分,D项错误。
答案:A
10.下列物质中含有两种官能团的是( )
A.乳酸
B.苯乙烯
C.丙三醇
D.甲苯
解析:乳酸中含有羟基—OH和羧基—COOH两种官能团,A项正确;苯乙烯中含有碳碳双键一种官能团,B项错误;丙三醇中含有羟基—OH一种官能团,C项错误;甲苯中没有官能团,D项错误。
答案:A
11.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.常温下,淀粉遇碘单质变蓝
B.蔗糖水解的最终产物只有葡萄糖
C.植物油不能发生水解反应
D.蛋白质由C、H、O三种元素组成
解析:常温下,淀粉遇碘变蓝,指的是碘单质,A项正确;蔗糖水解的产物除了葡萄糖外还有果糖,麦芽糖水解的产物只有葡萄糖,B项错误;植物油属于酯类,酯类能发生水解,C项错误;组成蛋白质的元素一定有C、H、O、N,D项错误。
答案:A
12.下列有关材料的说法正确的是( )
A.“神舟”飞船航天员穿的航天服使用的多种合成纤维是天然有机高分子材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
D.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
解析:合成纤维属于人工合成的有机高分子,不是天然有机高分子,故A项错误;石墨烯属于碳的单质,是新型无机非金属材料,故B项正确;钢缆属于合金,故C项错误;太阳能电池板的主要材料是硅单质,故D项错误。
答案:B
13.下列物质间的反应,其能量变化符合如图的是( )
A.碳酸钙的分解
B.灼热的炭与水蒸气反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.钠与水反应
解析:碳酸钙的分解是吸热反应,故A项错误;灼热的炭与水蒸气反应是吸热反应,故B项错误;Ba(OH)2·8H2O晶体和NH4Cl晶体混合是吸热反应,故C项错误;钠与水反应是放热反应,故D项正确。
答案:D
14.下列除去括号中的杂质所用试剂正确的是( )
A.Al(Cu)—稀盐酸 B.Fe2(SO4)3[FeSO4]—Cl2
C.Fe3O4(Al2O3)—稀H2SO4 D.O2(Cl2)—NaOH溶液
解析:稀盐酸不能和Cu反应,能和Al反应,所以可以除去Cu中的Al,但不能除去Al中的Cu,A项错误;氯气虽然能将亚铁离子氧化,但同时会引入新的杂质氯离子,B项错误;Fe3O4和Al2O3都能与稀硫酸反应,C项错误;氯气可以和NaOH溶液反应,而氧气不反应,且难溶,故可以用NaOH溶液除去氧气中混有的氯气,D项正确。
答案:D
15.如图为铜锌原电池装置,下列叙述错误的是( )
A.Zn片为负极 B.Zn片为正极
C.Cu片为正极 D.Cu片上有气泡产生
解析:Zn比Cu活泼,Zn作负极,故A项正确;Zn作负极,故B项错误;Zn比Cu活泼,Cu片为正极,故C项正确;铜作正极,发生2H++2e-===H2↑,Cu片上有气泡产生,故D项正确。
答案:B
16.下列反应属于加成反应的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH3CH2OH+CuOCH3CHO+H2O+Cu
C.CH2===CH2+H2OCH3CH2OH
D.CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
解析:CH4+Cl2CH3Cl+HCl属于取代反应,故A项不符合题意;CH3CH2OH+CuOCH3CHO+H2O+Cu属于氧化反应,故B项不符合题意;CH2===CH2+H2OCH3CH2OH属于加成反应,故C项符合题意;CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O属于酯化反应,故D项不符合题意。
答案:C
17.如图所示的实验操作中,正确的是( )
解析:图示采用上、下颠倒振荡的方式将已配好的溶液摇匀,操作规范合理,故A项正确;给试管中的液体加热时,应使用酒精灯的外焰进行加热,且液体体积不超过试管体积的三分之一,且手持试管夹的方式错误,图中操作不合理,故B项错误;一般来说,用胶头滴管滴加液体时,滴管不能深入到试管中,否则可能会污染试剂,应该垂直悬空加入,图示操作不合理,故C项错误;过滤液体时,要注意“一贴、二低、三靠”的原则,图示装置中分液漏斗下端没有紧贴烧杯内壁,操作不合理,故D项错误。
答案:A
18.将N2和H2置于容积为2 L的恒容密闭容器中,发生反应:N2+3H22NH3,反应进行到4 s末,测得N2为0.5 mol,H2为0.4 mol,NH3为0.1 mol。下列说法正确的是( )
A.N2的反应速率为0.062 5 mol/(L·s)
B.H2的反应速率为0.05 mol/(L·s)
C.NH3的反应速率为0.025 mol/(L·s)
D.NH3的反应速率为0.75 mol/(L·min)
解析:v(NH3)==0.012 5 mol/(L·s)=0.75 mol/(L·min),则v(N2)=×v(NH3)=×0.012 5 mol/(L·s)=0.006 25 mol/(L·s),v(H2)=×v(NH3)=×0.012 5 mol/(L·s)=0.018 75 mol/(L·s),答案选D。
答案:D
19.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为1 120 mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 L H2O含有的H2O分子数为0.1NA
解析:没有告诉0.5 mol·L-1 MgCl2溶液的体积,无法计算溶液中氯离子的物质的量及数目,故A项错误;根据反应:Zn+2HCl===ZnCl2+H2↑可知,0.1 mol Zn与含0.1 mol HCl的盐酸充分反应时HCl不足,生成氢气的物质的量n(H2)=n(HCl)=0.1 mol×=0.05 mol,所制得的H2在标准状况下的体积0.05 mol×22.4 L/mol=1.12 L=1 120 mL,选项中没有说明是否是标准状况下,故B项错误;n(O2)==0.1 mol,氧气是双原子分子,则含有原子数为0.2NA,故C项正确;标准状况下,水不是气体,不能使用标准状况下的气体摩尔体积计算2.24 L水的物质的量,故D项错误。
答案:C
20.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去。下列有关说法正确的是( )
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在常温下即可完全反应
C.若A为碳单质,C在常温下为气体,则将C通入少量的澄清石灰水中,一定能观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
解析:浓硫酸使蔗糖变黑,主要体现了浓硫酸的脱水性,故A项错误;若A为铁,则常温下足量铁在浓硫酸中发生钝化,故B项错误;若A为碳单质,C在常温下为气体,则C为CO2,故将CO2通入少量的澄清石灰水中生成Ca(HCO3)2,在反应过程中很难观察到有白色沉淀生成,故C项错误;SO2转化为SO3的反应是工业制H2SO4过程中重要的一步反应,故D项正确。
答案:D
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
① ② ③
3 ④
⑤
⑥ ⑦ ⑧
4 ⑨
(1)在这些元素中化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物是________,碱性最强的化合物是________。
(3)最高价氧化物是两性氧化物的元素是________。
(4)元素④与⑥形成的化合物属于____________(填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式__________________。
(6)写出⑥的原子结构示意图____________。
解析:根据元素周期表,表中的①~⑨号元素分别是C、N、O、Na、Al、S、Cl、Ar、K。
(1)Ar最外层有8个电子,结构稳定,所以在这些元素中,化学性质最不活泼的是Ar。(2)非金属性越强,最高价氧化物的水化物酸性越强,酸性最强的化合物是HClO4;金属性越强,最高价氧化物的水化物的碱性越强,碱性最强的化合物是KOH。(3)氧化铝既能与酸反应又能与碱反应,所以最高价氧化物是两性氧化物的元素是Al。(4)Na元素是活泼金属,S元素是活泼非金属,形成的化合物是Na2S,Na2S属于离子化合物。(5)C与Cl形成的化合物的化学式是CCl4。(6)⑥是S元素,核外有3个电子层、最外层有6个电子,原子结构示意图是。
答案:(1)Ar HClO4 KOH (3)Al (4)离子 (5)CCl4 (6)
22.(13分)实验室制备并收集干燥、纯净氯气的装置如图所示。
请回答下列问题:
(1)写出实验室制备Cl2的化学方程式:___________________。
(2)写出指定试剂的名称:C____________,D____________。
(3)C的作用是____________________,D的作用是______________________,F的作用是______________________。
(4)检验氯气是否收集满的操作:______________________。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是_______________,若反应产生0.5 mol Cl2,则消耗的氧化剂的物质的量为________mol,反应转移的电子数是____________。
解析:(1)实验室用浓盐酸和二氧化锰共热来制取氯气。(2)氯气中杂质有挥发出来的氯化氢和水蒸气,C装饱和氯化钠溶液除去氯化氢,D中装浓硫酸进行干燥。(3)氯气中的杂质有挥发出来的氯化氢和水蒸气,C装饱和氯化钠溶液除去氯化氢,D中装浓硫酸进行干燥,氯气有毒,尾气需要处理,F中可用氢氧化钠溶液处理尾气。(4)氯气有强氧化性,可使湿润的淀粉碘化钾试纸变蓝。(5)题给反应中氯化氢中部分氯元素化合价降低;部分氯元素作盐中的阴离子,体现了还原性和酸性;反应中氯元素由-1价到0价,锰元素由+7价到+2价,降低5价,故生成1个氯气分子转移两个电子,消耗个氧化剂,所以产生0.5 mol Cl2,则消耗的氧化剂的物质的量为0.2 mol,反应转移的电子数是NA。
答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)饱和食盐水 浓硫酸
(3)除去氯气中混有的氯化氢气体 干燥氯气 吸收氯气,防止污染空气
(4)用湿润的淀粉碘化钾试纸靠近集气瓶口,若试纸变蓝,说明氯气已收集满
(5)还原性和酸性 0.2 mol NA
23.(14分)A、B、C、D、E、F、G均为常见的有机物,它们之间有如图1所示转化关系。已知:①A是一种植物生长调节剂,有催熟作用;②醛基在氧气中易被氧化成羧基。
图1
回答下列问题:
(1)A和B中官能团名称分别是____________和____________。
(2)在F的众多同系物中,最简单的同系物其空间构型为________________;含5个碳原子的同系物其同分异构体有________种,其中一氯代物种类最少的同系物的结构简式为____________。
(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应该选用反应________。
(4)反应①~⑦属取代反应的有________;反应②的化学方程式为_____________________________________________________。
(5)某同学欲用图2所示装置制备物质E,将试管Ⅱ中的物质E分离出来,用到的主要玻璃仪器有:烧杯、________,插入试管Ⅱ的导管接有一个球状物,其作用为____________________________。
解析:A是一种植物生长调节剂,有催熟作用,则A为CH2===CH2;乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,乙烯与氢气发生加成反应生成F为C2H6,乙烯与HCl发生生成G为CH3CH2Cl,乙烷与氯气发生取代反应生成氯乙烷,据此分析解答。(1)由上述分析可知,A为CH2===CH2,含有官能团为碳碳双键,B为CH3CH2OH,含有官能团为羟基。(2)由上述分析可知,F为C2H6,在F的同系物中,最简单的有机物为甲烷,空间构型为正四面体形,与F互为同系物的含5个碳原子的所有同分异构体的结构简式:CH3CH2CH2CH2CH3,CH3CH2CH(CH3)2,C(CH3)4,共3种,其中一氯代物种类最少的为C(CH3)4。(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应选择⑦,⑦为加成反应,产物较纯净。(4)由转化关系可知①⑤⑦为加成反应,②③为氧化反应,④⑥为取代反应,反应④中,浓硫酸的作用是催化剂和吸水剂。反应②的化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。(5)实验室制备物质E即CH3COOCH2CH3,由于CH3COOCH2CH3不溶于饱和碳酸钠溶液,将试管Ⅱ中的物质E分离出来采用分液法,故用到的主要玻璃仪器有烧杯、分液漏斗,由于试管Ⅰ有加热装置,故Ⅱ中易发生倒吸现象,引发事故,故插入试管Ⅱ的导管接有一个球状物,其作用为防止倒吸。
答案:(1)碳碳双键 羟基
(2)正四面体形 3 C(CH3)4
(3)⑦
(4)④⑥ 2CH3CH2OH+O22CH3CHO+2H2O
(5)分液漏斗 防倒吸
同课章节目录
