新教材高中化学合格性考试(广东)-模拟测试卷(五) 原卷版+解析版
文档属性
| 名称 | 新教材高中化学合格性考试(广东)-模拟测试卷(五) 原卷版+解析版 |  | |
| 格式 | doc | ||
| 文件大小 | 967.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 22:18:44 | ||
图片预览




文档简介
高中学业水平合格性考试模拟测试卷(五)
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质的主要成分属于合成纤维的是( )
A.羊毛 B.棉花
C.蚕丝 D.涤纶
2.雾霾已经成为社会各界共同关注的热门话题,下列因素与雾霾成因无关的是( )
A.氮气排放 B.燃煤供热
C.汽车尾气排放 D.田间焚烧秸秆
3.下列物质中属于烃的衍生物的是( )
A.异丁烷 B.甲烷
C.乙烯 D.四氯化碳
4.钬的一种同位素67Ho可用于制作医疗激光器,其原子核内中子数是( )
A.31 B.98
C.67 D.165
5.下列过程不涉及氧化还原反应的是( )
A.火药的爆炸 B.钢铁的冶炼
C.用“84”消毒液消毒 D.Na2O2露置在空气中变质
6.0.5 mol Na2CO3中所含的Na+数约为( )
A.3.01×1023 B.6.02×1023
C.0.5 D.1
7.下列有关原子或离子的结构示意图表示正确的是( )
8.蒸发氯化钠溶液时,需要用到的仪器是( )
9.下列物质中,不含离子键的是( )
A.KOH B.Na2O2
C.MgCl2 D.H2SO4
10.乙烯使溴水褪色可用如图表示,该反应的类型是( )
A.取代反应 B.加成反应
C.聚合反应 D.酯化反应
11.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
12.下列关于乙醇的说法不正确的是( )
A.官能团为—OH B.能与NaOH溶液反应
C.能与Na反应 D.能与CH3COOH反应
13.下列化合物不能由两种单质直接化合而得到的是( )
A.Na2O2 B.FeCl2
C.FeCl3 D.MgO
14.下列说法正确的是( )
A.淀粉水解的最终产物都是氨基酸
B.纤维素不可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖的水解产物能发生银镜反应
15.属于氧化还原反应且能量变化与如图一致的是( )
A.NH4ClNH3↑+HCl↑
B.HCl+NaOH===NaOH+H2O
C.2NH4Cl+Ba(OH)2·8H2O===2NH3↑+BaCl2+10H2O
D.CO2+C2CO
16.用Zn粒与稀硫酸反应制取氢气时,下列措施不能增大氢气生成速率的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用锌粒,改用锌粉
17.下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)2Na+Cl2↑
B.Al2O3+3H22Al+3H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
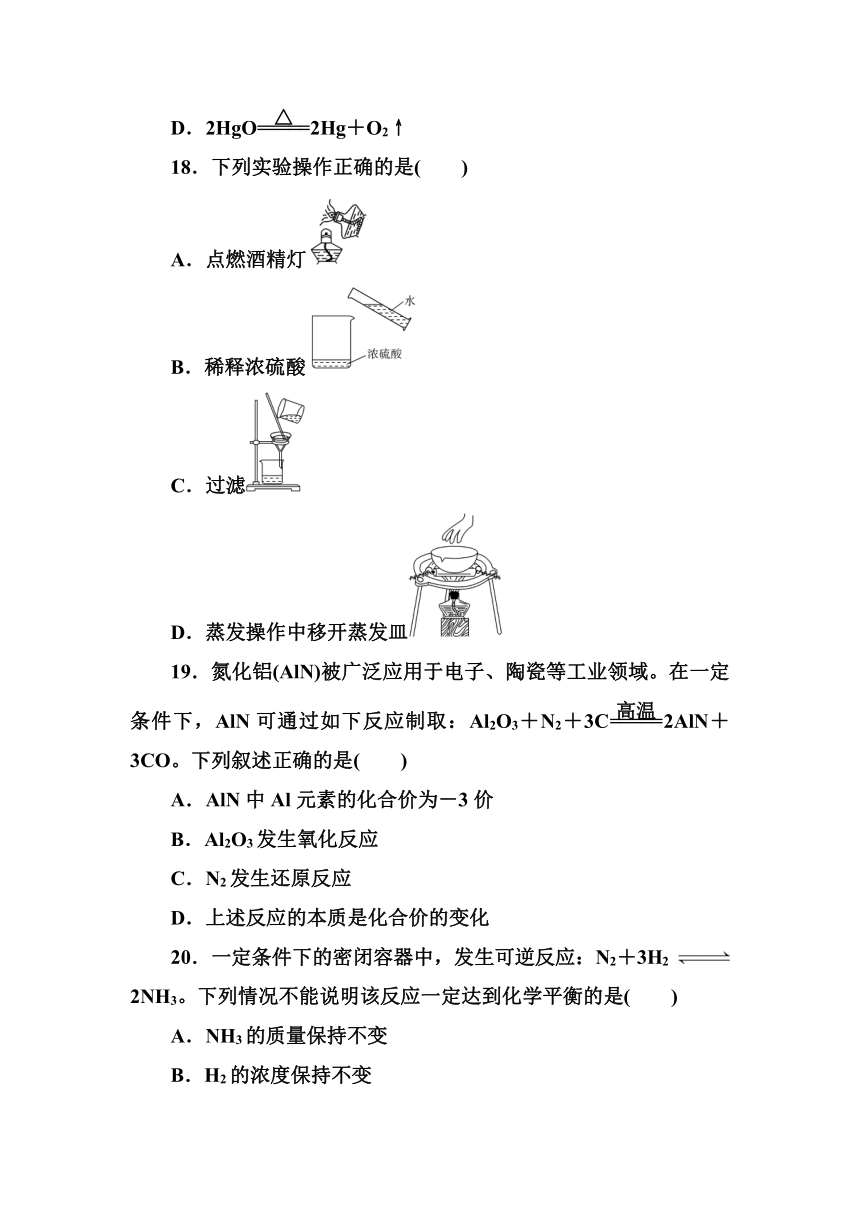
18.下列实验操作正确的是( )
A.点燃酒精灯
B.稀释浓硫酸
C.过滤
D.蒸发操作中移开蒸发皿
19.氮化铝(AlN)被广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C2AlN+3CO。下列叙述正确的是( )
A.AlN中Al元素的化合价为-3价
B.Al2O3发生氧化反应
C.N2发生还原反应
D.上述反应的本质是化合价的变化
20.一定条件下的密闭容器中,发生可逆反应:N2+3H2 2NH3。下列情况不能说明该反应一定达到化学平衡的是( )
A.NH3的质量保持不变
B.H2的浓度保持不变
C.正反应和逆反应速率相等
D.N2、H2、NH3的物质的量之比为1∶2∶3
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。
(1)下图所示的模型表示的分子中,可由A、D形成的是____________(填字母)。
c分子的空间构型为________________,d分子的结构简式为________________。
(2)关于a(乙烯)分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有________个;
②a能使溴的水溶液褪色,该反应的生成物的名称是__________________(命名);
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=____________时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式________________________;________________________。
(3)Na在R的单质气体中燃烧产物的电子式为__________;Na在F单质中燃烧的产物是__________(写化学式)。
(4)上述元素的最高价氧化物的水化物中,碱性最强的是________________________(写化学式),其与Q的单质反应的离子方程式是______________________________________________。
22.(13分)为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是________(填字母,下同)接__________,__________接________,________接________。
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为:装置乙中________________________________________________;
装置丙中____________________________________________。
(3)装置丁中酸性KMnO4溶液的作用是___________________。
(4)写出装置甲中所发生反应的化学方程式:_____________。
23.(14分)煤的综合利用备受关注。有如下图的转化关系,CO与H2不同比例可以合成A,已知烃A对氢气的相对密度是14,D能发生银镜反应,E为常见的酸味剂,已知—CHO和氢气加成可以得到—CH2OH。
(1)有机物A中含有的官能团的名称是________;D的名称为________;E的分子式是____________。
(2)反应①和④的反应类型分别为________________;________________。
(3)F的同分异构体中,属于酯的有__________种。
(4)反应②和⑥的反应方程式分别为______________
和__________________________________________________。
(5)下列说法正确的是__________(填字母)。
A.生成CO和H2是煤的气化,属于煤的综合利用的一种方法
B.有机物D和E都可以与新制氢氧化铜发生反应
C.有机物B和E的水溶液都具有杀菌消毒作用
D.乙酸乙酯与有机物E混合物的分离,可以用氢氧化钠溶液振荡、静置分液的方法
高中学业水平合格性考试模拟测试卷(五) 解析版
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质的主要成分属于合成纤维的是( )
A.羊毛 B.棉花
C.蚕丝 D.涤纶
解析:羊毛的主要成分是蛋白质,属于天然纤维,故A项不符合题意;棉花的主要成分是纤维素,属于天然纤维,故B项不符合题意;蚕丝的主要成分是蛋白质,属于天然纤维,故C项不符合题意;涤纶属于合成纤维,故D项符合题意。
答案:D
2.雾霾已经成为社会各界共同关注的热门话题,下列因素与雾霾成因无关的是( )
A.氮气排放 B.燃煤供热
C.汽车尾气排放 D.田间焚烧秸秆
解析:雾霾天气形成,其原因有城市汽车数量剧增,排放大量尾气,工业生产、田间焚烧秸秆及冬季取暖排放的粉尘、硫氧化合物等PM2.5颗粒物增多等,答案选A。
答案:A
3.下列物质中属于烃的衍生物的是( )
A.异丁烷 B.甲烷
C.乙烯 D.四氯化碳
解析:异丁烷只有碳和氢两种元素组成,属于烷烃,A项错误;甲烷只含有碳和氢两种元素,属于烷烃,不属于烃的衍生物,B项错误;乙烯是烯烃,不属于烃的衍生物,C项错误;四氯化碳是甲烷分子中4个氢原子都被氯原子取代后的物质,属于烃的衍生物,D项正确。
答案:D
4.钬的一种同位素67Ho可用于制作医疗激光器,其原子核内中子数是( )
A.31 B.98
C.67 D.165
解析:67Ho中的165表示该原子的质量数,67为质子数,则中子数=质量数-质子数=165-67=98,故答案选B。
答案:B
5.下列过程不涉及氧化还原反应的是( )
A.火药的爆炸 B.钢铁的冶炼
C.用“84”消毒液消毒 D.Na2O2露置在空气中变质
解析:火药的爆炸是硝酸钾、碳粉、硫粉反应生成硫化钾、氮气、二氧化碳,C、N、S的化合价改变,属于氧化还原反应,A项不符合题意;钢铁的冶炼是用CO把氧化铁还原为铁,属于氧化还原反应,B项不符合题意;用“84”消毒液消毒是次氯酸表现氧化性,属于氧化还原反应,C项不符合题意;Na2O2露置在空气中,与二氧化碳反应最终生成碳酸钠和水,元素化合价不变,不是氧化还原反应,D项符合题意。
答案:D
6.0.5 mol Na2CO3中所含的Na+数约为( )
A.3.01×1023 B.6.02×1023
C.0.5 D.1
解析:由物质的构成特点可知,1个Na2CO3中含有2个Na+,故0.5 mol Na2CO3中含有1 mol Na+,则个数约为6.02×1023,故答案为B。
答案:B
7.下列有关原子或离子的结构示意图表示正确的是( )
解析:Li原子K层填充2个电子,L层填充1个电子,故A项错误;K原子最外层和次外层分别填充1个和8个电子,原子最外层不能超过8个电子,故B项错误;S2-最外层填充8个电子,故C项错误;镁离子核外10个电子,2个电子在K层,8个电子在L层,故D项正确。
答案:D
8.蒸发氯化钠溶液时,需要用到的仪器是( )
解析:蒸发时需要下列仪器和用品:蒸发皿、酒精灯、玻璃棒、铁架台带铁圈、石棉网,故答案选D。
答案:D
9.下列物质中,不含离子键的是( )
A.KOH B.Na2O2
C.MgCl2 D.H2SO4
解析:氢氧化钾属于离子化合物,存在钾离子和氢氧根离子,含有离子键,故A项不符合题意;过氧化钠属于离子化合物,存在钠离子和过氧根离子,含有离子键,故B项不符合题意;氯化镁属于离子化合物,存在镁离子和氯离子,含有离子键,故C项不符合题意;硫酸属于共价化合物,原子间靠共用电子对形成共价键,一定不含离子键,故D项符合题意。
答案:D
10.乙烯使溴水褪色可用如图表示,该反应的类型是( )
A.取代反应 B.加成反应
C.聚合反应 D.酯化反应
解析:由图可知,反应前乙烯分子中的双键,在反应后变成了单键,这符合加成反应的特点,所以该反应类型为加成反应,答案选B。
答案:B
11.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
解析:锌作负极,铜为正极,选项A错误;锌作负极,负极上锌失电子发生氧化反应,选项B错误;该装置是原电池,将化学能转化为电能,选项C错误;电子从负极锌沿导线流向正极铜,选项D正确。
答案:D
12.下列关于乙醇的说法不正确的是( )
A.官能团为—OH B.能与NaOH溶液反应
C.能与Na反应 D.能与CH3COOH反应
解析:乙醇结构简式为CH3CH2OH或C2H5OH,官能团为— OH,A项正确;乙醇是非电解质,不能与氢氧化钠反应,B项错误;乙醇含有羟基,能与Na反应放出氢气,C项正确;在浓硫酸作催化剂作用下,乙酸与乙醇共热发生酯化反应生成乙酸乙酯和水,D项正确。
答案:B
13.下列化合物不能由两种单质直接化合而得到的是( )
A.Na2O2 B.FeCl2
C.FeCl3 D.MgO
解析:2Na+O2Na2O2,Na2O2可以由单质直接化合生成,A项不符合题意;2Fe+3Cl22FeCl3,Fe与Cl2直接化合生成FeCl3,无法生成FeCl2,B项符合题意;2Fe+3Cl22FeCl3,Fe与Cl2直接化合可以生成FeCl3,C项不符合题意;2Mg+O22MgO,MgO可以由单质直接化合生成,D项不符合题意。
答案:B
14.下列说法正确的是( )
A.淀粉水解的最终产物都是氨基酸
B.纤维素不可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖的水解产物能发生银镜反应
解析:淀粉水解的产物是葡萄糖,故A项错误;纤维素水解的产物都是葡萄糖,所以纤维素可以作为工业上生产葡萄糖的原料,故B项错误;油脂在碱性条件下水解得到高级脂肪酸盐和甘油,此条件下水解为皂化反应,油脂在酸性条件下水解得到高级脂肪酸和甘油,酸性条件下水解不是皂化反应,故C项错误;蔗糖水解产物为果糖和葡萄糖,葡萄糖含醛基能发生银镜反应,故D项正确。
答案:D
15.属于氧化还原反应且能量变化与如图一致的是( )
A.NH4ClNH3↑+HCl↑
B.HCl+NaOH===NaOH+H2O
C.2NH4Cl+Ba(OH)2·8H2O===2NH3↑+BaCl2+10H2O
D.CO2+C2CO
解析:NH4ClNH3↑+HCl↑属于非氧化还原反应,A项错误;HCl+NaOH===NaOH+H2O属于非氧化还原反应、放热反应,B项错误;2NH4Cl+Ba(OH)2·8H2O===2NH3↑+BaCl2+10H2O属于非氧化还原反应、吸热反应,C项错误;CO2+C2CO属于氧化还原反应且是吸热反应,D项正确。
答案:D
16.用Zn粒与稀硫酸反应制取氢气时,下列措施不能增大氢气生成速率的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用锌粒,改用锌粉
解析:加热,温度升高,能使反应速率增大,故A项不符合题意;浓硫酸具有强氧化性,改用98%的浓硫酸,Zn粒与浓硫酸反应会生成二氧化硫,不产生氢气,故B项符合题意;滴加少量的CuSO4溶液,Zn与CuSO4反应生成Cu,铜与锌、稀硫酸溶液组成原电池,使反应速率增大,故C项不符合题意;改用锌粉,增大了接触面积,使反应速率增大,故D项不符合题意。
答案:B
17.下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)2Na+Cl2↑
B.Al2O3+3H22Al+3H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
解析:钠是活泼金属,应采用电解法制取,故A项正确;铝是活泼金属,应采用电解氧化铝制取金属铝,故B项错误;Fe、Zn、Cu等中等活泼金属用热还原法冶炼,故C项正确;Hg、Ag等不活泼金属采用热分解法冶炼,加热氧化汞可以获得金属汞,故D项正确。
答案:B
18.下列实验操作正确的是( )
A.点燃酒精灯
B.稀释浓硫酸
C.过滤
D.蒸发操作中移开蒸发皿
解析:点燃酒精灯不可用其他燃着的酒精灯,A项错误;稀释浓硫酸的方法是将浓硫酸沿着烧杯壁缓缓注入水中,并不断地搅拌,B项错误;过滤操作所使用的仪器有烧杯,玻璃棒,漏斗,C项正确;移取热的蒸发皿或坩埚都要使用坩埚钳,D项错误。
答案:C
19.氮化铝(AlN)被广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C2AlN+3CO。下列叙述正确的是( )
A.AlN中Al元素的化合价为-3价
B.Al2O3发生氧化反应
C.N2发生还原反应
D.上述反应的本质是化合价的变化
解析:在金属与非金属构成的化合物中,金属元素显正价,非金属元素显负价,因此Al的化合价为+3价,A项错误;反应过程中Al2O3的各元素化合价没有发生变化,因此Al2O3并没有发生氧化还原反应,B项错误;上述反应中,N2的化合价从0价变成-3价,化合价降低,发生还原反应,C项正确;氧化还原反应的本质为电子的转移或者偏移,D项错误。
答案:C
20.一定条件下的密闭容器中,发生可逆反应:N2+3H2 2NH3。下列情况不能说明该反应一定达到化学平衡的是( )
A.NH3的质量保持不变
B.H2的浓度保持不变
C.正反应和逆反应速率相等
D.N2、H2、NH3的物质的量之比为1∶2∶3
解析:NH3的质量保持不变,密闭容器体积不变,则NH3的浓度不变,达到化学平衡状态,A项不符合题意;H2的浓度不变,浓度不再改变,化学反应达到平衡状态,B项不符合题意;正反应和逆反应速率相等,化学反应达到平衡状态,C项不符合题意;平衡时,N2、H2和NH3的物质的量之比取决于起始量之比与转化程度,不能作为达到平衡的标志,D项符合题意。
答案:D
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。
(1)下图所示的模型表示的分子中,可由A、D形成的是____________(填字母)。
c分子的空间构型为________________,d分子的结构简式为________________。
(2)关于a(乙烯)分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有________个;
②a能使溴的水溶液褪色,该反应的生成物的名称是__________________(命名);
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=____________时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式________________________;________________________。
(3)Na在R的单质气体中燃烧产物的电子式为__________;Na在F单质中燃烧的产物是__________(写化学式)。
(4)上述元素的最高价氧化物的水化物中,碱性最强的是________________________(写化学式),其与Q的单质反应的离子方程式是______________________________________________。
解析:根据元素在周期表中的位置可知A为H元素,D为C元素,F为O元素,G为Mg元素,Q为Al元素,M为S元素,R为Cl元素,N为K元素。
(1)A为H元素,D为C元素,由模型可知:a为CH2===CH2,b为NH3,c为CH4,d为C6H6,所以由A、D形成的是acd,c为CH4,其空间构型为正四面体形,d为C6H6,其结构简式为或。(2)①甲烷是正四面体结构,最多有3个原子共面,乙烯是平面形结构,最多有6个原子共面,所以a分子中的1个氢原子被甲基取代后得到的物质丙烯中在同一平面的原子最多有6+3-2=7(个);②乙烯与溴水发生加成反应生成1,2二溴乙烷;③烷烃中甲烷、乙烷、丙烷没有同分异构体,从丁烷开始出现同分异构体,所以n=4,丁烷的同分异构体有CH3CH2CH2CH3、(CH3)2CHCH3。(3)Na在Cl2中燃烧生成NaCl,氯化钠为离子化合物,电子式为Na+,Na在O2中燃烧生成Na2O2;(4)金属性最强的元素为第四周期ⅠA族元素K,对应最高价氧化物的水化物KOH的碱性最强,与Al反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。
答案:(1)acd 正四面体形 或 (2)①7 ②1,2二溴乙烷
③4 CH3CH2CH2CH3 (CH3)2CHCH3
(3)Na+ Na2O2 (4)KOH
2Al+2OH-+2H2O===2AlO+3H2↑
22.(13分)为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是________(填字母,下同)接__________,__________接________,________接________。
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为:装置乙中________________________________________________;
装置丙中____________________________________________。
(3)装置丁中酸性KMnO4溶液的作用是___________________。
(4)写出装置甲中所发生反应的化学方程式:_____________。
解析:(1)甲为浓硫酸与木炭反应的装置,KMnO4可氧化SO2,用酸性KMnO4溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认,所以装置连接顺序为A→F→E→C→D→B。(2)SO2具有漂白性,SO2能使品红褪色,丁装置用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色,证明SO2已经除尽,最后用澄清石灰水检验CO2,澄清石灰水变浑浊。若丙中品红褪色,则乙中的澄清的石灰水变浑浊,无法证明甲中反应生成了CO2。(3)若证明有CO2,需要先除去干扰气体SO2,用高锰酸钾可以吸收SO2。(4)浓硫酸与木炭在加热条件下反应生成CO2、SO2和水,化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
答案:(1)A F E C D B
(2)澄清石灰水变浑浊 品红溶液未褪色
(3)吸收SO2
(4)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
23.(14分)煤的综合利用备受关注。有如下图的转化关系,CO与H2不同比例可以合成A,已知烃A对氢气的相对密度是14,D能发生银镜反应,E为常见的酸味剂,已知—CHO和氢气加成可以得到—CH2OH。
(1)有机物A中含有的官能团的名称是________;D的名称为________;E的分子式是____________。
(2)反应①和④的反应类型分别为________________;________________。
(3)F的同分异构体中,属于酯的有__________种。
(4)反应②和⑥的反应方程式分别为______________
和__________________________________________________。
(5)下列说法正确的是__________(填字母)。
A.生成CO和H2是煤的气化,属于煤的综合利用的一种方法
B.有机物D和E都可以与新制氢氧化铜发生反应
C.有机物B和E的水溶液都具有杀菌消毒作用
D.乙酸乙酯与有机物E混合物的分离,可以用氢氧化钠溶液振荡、静置分液的方法
解析:由烃A对氢气的相对密度为14可知,烃A的相对分子质量为28,则烃A为乙烯,E为常见的酸味剂,则E为乙酸,D可以发生银镜反应,则D为乙醛,可以推断得B为乙醇,F为乙酸乙酯。
(1)A为乙烯,官能团为碳碳双键;D的名称为乙醛;E为乙酸,分子式为C2H4O2。(2)反应①为乙烯和水生成乙醇的反应为加成反应;反应④为乙醛生成乙酸的反应为催化氧化反应,故为氧化反应。(3)F的同分异构体属于酯类的包括甲酸丙酯,甲酸异丙酯,丙酸甲酯三种,故有3种。(4)反应②为乙醇生成乙醛的反应,反应方程式为2C2H5OH+O22CH3CHO+2H2O;反应⑥为乙酸和乙醇的酯化反应,反应方程式为CH3COOH+C2H5OHCH3COOC2H5+H2O。(5)生成水煤气的过程可以通过煤的气化实现,是煤的综合利用的方法,故A正确;乙醛可以和新制的氢氧化铜发生反应生成砖红色沉淀,乙酸可以和氢氧化铜发生中和反应,故B正确;乙醇和乙酸都可以进行杀菌消毒,故C正确;分离乙酸乙酯和乙酸应用饱和碳酸钠溶液震荡,如用氢氧化钠会造成乙酸乙酯的水解,故D错误;答案选ABC。
答案:(1)碳碳双键 乙醛 C2H4O2
(2)加成反应 氧化反应
(3)3
(4)2C2H5OH+O22CH3CHO+2H2O;CH3COOH+C2H5OHCH3COOC2H5+H2O (5)ABC
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质的主要成分属于合成纤维的是( )
A.羊毛 B.棉花
C.蚕丝 D.涤纶
2.雾霾已经成为社会各界共同关注的热门话题,下列因素与雾霾成因无关的是( )
A.氮气排放 B.燃煤供热
C.汽车尾气排放 D.田间焚烧秸秆
3.下列物质中属于烃的衍生物的是( )
A.异丁烷 B.甲烷
C.乙烯 D.四氯化碳
4.钬的一种同位素67Ho可用于制作医疗激光器,其原子核内中子数是( )
A.31 B.98
C.67 D.165
5.下列过程不涉及氧化还原反应的是( )
A.火药的爆炸 B.钢铁的冶炼
C.用“84”消毒液消毒 D.Na2O2露置在空气中变质
6.0.5 mol Na2CO3中所含的Na+数约为( )
A.3.01×1023 B.6.02×1023
C.0.5 D.1
7.下列有关原子或离子的结构示意图表示正确的是( )
8.蒸发氯化钠溶液时,需要用到的仪器是( )
9.下列物质中,不含离子键的是( )
A.KOH B.Na2O2
C.MgCl2 D.H2SO4
10.乙烯使溴水褪色可用如图表示,该反应的类型是( )
A.取代反应 B.加成反应
C.聚合反应 D.酯化反应
11.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
12.下列关于乙醇的说法不正确的是( )
A.官能团为—OH B.能与NaOH溶液反应
C.能与Na反应 D.能与CH3COOH反应
13.下列化合物不能由两种单质直接化合而得到的是( )
A.Na2O2 B.FeCl2
C.FeCl3 D.MgO
14.下列说法正确的是( )
A.淀粉水解的最终产物都是氨基酸
B.纤维素不可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖的水解产物能发生银镜反应
15.属于氧化还原反应且能量变化与如图一致的是( )
A.NH4ClNH3↑+HCl↑
B.HCl+NaOH===NaOH+H2O
C.2NH4Cl+Ba(OH)2·8H2O===2NH3↑+BaCl2+10H2O
D.CO2+C2CO
16.用Zn粒与稀硫酸反应制取氢气时,下列措施不能增大氢气生成速率的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用锌粒,改用锌粉
17.下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)2Na+Cl2↑
B.Al2O3+3H22Al+3H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
18.下列实验操作正确的是( )
A.点燃酒精灯
B.稀释浓硫酸
C.过滤
D.蒸发操作中移开蒸发皿
19.氮化铝(AlN)被广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C2AlN+3CO。下列叙述正确的是( )
A.AlN中Al元素的化合价为-3价
B.Al2O3发生氧化反应
C.N2发生还原反应
D.上述反应的本质是化合价的变化
20.一定条件下的密闭容器中,发生可逆反应:N2+3H2 2NH3。下列情况不能说明该反应一定达到化学平衡的是( )
A.NH3的质量保持不变
B.H2的浓度保持不变
C.正反应和逆反应速率相等
D.N2、H2、NH3的物质的量之比为1∶2∶3
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。
(1)下图所示的模型表示的分子中,可由A、D形成的是____________(填字母)。
c分子的空间构型为________________,d分子的结构简式为________________。
(2)关于a(乙烯)分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有________个;
②a能使溴的水溶液褪色,该反应的生成物的名称是__________________(命名);
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=____________时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式________________________;________________________。
(3)Na在R的单质气体中燃烧产物的电子式为__________;Na在F单质中燃烧的产物是__________(写化学式)。
(4)上述元素的最高价氧化物的水化物中,碱性最强的是________________________(写化学式),其与Q的单质反应的离子方程式是______________________________________________。
22.(13分)为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是________(填字母,下同)接__________,__________接________,________接________。
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为:装置乙中________________________________________________;
装置丙中____________________________________________。
(3)装置丁中酸性KMnO4溶液的作用是___________________。
(4)写出装置甲中所发生反应的化学方程式:_____________。
23.(14分)煤的综合利用备受关注。有如下图的转化关系,CO与H2不同比例可以合成A,已知烃A对氢气的相对密度是14,D能发生银镜反应,E为常见的酸味剂,已知—CHO和氢气加成可以得到—CH2OH。
(1)有机物A中含有的官能团的名称是________;D的名称为________;E的分子式是____________。
(2)反应①和④的反应类型分别为________________;________________。
(3)F的同分异构体中,属于酯的有__________种。
(4)反应②和⑥的反应方程式分别为______________
和__________________________________________________。
(5)下列说法正确的是__________(填字母)。
A.生成CO和H2是煤的气化,属于煤的综合利用的一种方法
B.有机物D和E都可以与新制氢氧化铜发生反应
C.有机物B和E的水溶液都具有杀菌消毒作用
D.乙酸乙酯与有机物E混合物的分离,可以用氢氧化钠溶液振荡、静置分液的方法
高中学业水平合格性考试模拟测试卷(五) 解析版
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列物质的主要成分属于合成纤维的是( )
A.羊毛 B.棉花
C.蚕丝 D.涤纶
解析:羊毛的主要成分是蛋白质,属于天然纤维,故A项不符合题意;棉花的主要成分是纤维素,属于天然纤维,故B项不符合题意;蚕丝的主要成分是蛋白质,属于天然纤维,故C项不符合题意;涤纶属于合成纤维,故D项符合题意。
答案:D
2.雾霾已经成为社会各界共同关注的热门话题,下列因素与雾霾成因无关的是( )
A.氮气排放 B.燃煤供热
C.汽车尾气排放 D.田间焚烧秸秆
解析:雾霾天气形成,其原因有城市汽车数量剧增,排放大量尾气,工业生产、田间焚烧秸秆及冬季取暖排放的粉尘、硫氧化合物等PM2.5颗粒物增多等,答案选A。
答案:A
3.下列物质中属于烃的衍生物的是( )
A.异丁烷 B.甲烷
C.乙烯 D.四氯化碳
解析:异丁烷只有碳和氢两种元素组成,属于烷烃,A项错误;甲烷只含有碳和氢两种元素,属于烷烃,不属于烃的衍生物,B项错误;乙烯是烯烃,不属于烃的衍生物,C项错误;四氯化碳是甲烷分子中4个氢原子都被氯原子取代后的物质,属于烃的衍生物,D项正确。
答案:D
4.钬的一种同位素67Ho可用于制作医疗激光器,其原子核内中子数是( )
A.31 B.98
C.67 D.165
解析:67Ho中的165表示该原子的质量数,67为质子数,则中子数=质量数-质子数=165-67=98,故答案选B。
答案:B
5.下列过程不涉及氧化还原反应的是( )
A.火药的爆炸 B.钢铁的冶炼
C.用“84”消毒液消毒 D.Na2O2露置在空气中变质
解析:火药的爆炸是硝酸钾、碳粉、硫粉反应生成硫化钾、氮气、二氧化碳,C、N、S的化合价改变,属于氧化还原反应,A项不符合题意;钢铁的冶炼是用CO把氧化铁还原为铁,属于氧化还原反应,B项不符合题意;用“84”消毒液消毒是次氯酸表现氧化性,属于氧化还原反应,C项不符合题意;Na2O2露置在空气中,与二氧化碳反应最终生成碳酸钠和水,元素化合价不变,不是氧化还原反应,D项符合题意。
答案:D
6.0.5 mol Na2CO3中所含的Na+数约为( )
A.3.01×1023 B.6.02×1023
C.0.5 D.1
解析:由物质的构成特点可知,1个Na2CO3中含有2个Na+,故0.5 mol Na2CO3中含有1 mol Na+,则个数约为6.02×1023,故答案为B。
答案:B
7.下列有关原子或离子的结构示意图表示正确的是( )
解析:Li原子K层填充2个电子,L层填充1个电子,故A项错误;K原子最外层和次外层分别填充1个和8个电子,原子最外层不能超过8个电子,故B项错误;S2-最外层填充8个电子,故C项错误;镁离子核外10个电子,2个电子在K层,8个电子在L层,故D项正确。
答案:D
8.蒸发氯化钠溶液时,需要用到的仪器是( )
解析:蒸发时需要下列仪器和用品:蒸发皿、酒精灯、玻璃棒、铁架台带铁圈、石棉网,故答案选D。
答案:D
9.下列物质中,不含离子键的是( )
A.KOH B.Na2O2
C.MgCl2 D.H2SO4
解析:氢氧化钾属于离子化合物,存在钾离子和氢氧根离子,含有离子键,故A项不符合题意;过氧化钠属于离子化合物,存在钠离子和过氧根离子,含有离子键,故B项不符合题意;氯化镁属于离子化合物,存在镁离子和氯离子,含有离子键,故C项不符合题意;硫酸属于共价化合物,原子间靠共用电子对形成共价键,一定不含离子键,故D项符合题意。
答案:D
10.乙烯使溴水褪色可用如图表示,该反应的类型是( )
A.取代反应 B.加成反应
C.聚合反应 D.酯化反应
解析:由图可知,反应前乙烯分子中的双键,在反应后变成了单键,这符合加成反应的特点,所以该反应类型为加成反应,答案选B。
答案:B
11.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
解析:锌作负极,铜为正极,选项A错误;锌作负极,负极上锌失电子发生氧化反应,选项B错误;该装置是原电池,将化学能转化为电能,选项C错误;电子从负极锌沿导线流向正极铜,选项D正确。
答案:D
12.下列关于乙醇的说法不正确的是( )
A.官能团为—OH B.能与NaOH溶液反应
C.能与Na反应 D.能与CH3COOH反应
解析:乙醇结构简式为CH3CH2OH或C2H5OH,官能团为— OH,A项正确;乙醇是非电解质,不能与氢氧化钠反应,B项错误;乙醇含有羟基,能与Na反应放出氢气,C项正确;在浓硫酸作催化剂作用下,乙酸与乙醇共热发生酯化反应生成乙酸乙酯和水,D项正确。
答案:B
13.下列化合物不能由两种单质直接化合而得到的是( )
A.Na2O2 B.FeCl2
C.FeCl3 D.MgO
解析:2Na+O2Na2O2,Na2O2可以由单质直接化合生成,A项不符合题意;2Fe+3Cl22FeCl3,Fe与Cl2直接化合生成FeCl3,无法生成FeCl2,B项符合题意;2Fe+3Cl22FeCl3,Fe与Cl2直接化合可以生成FeCl3,C项不符合题意;2Mg+O22MgO,MgO可以由单质直接化合生成,D项不符合题意。
答案:B
14.下列说法正确的是( )
A.淀粉水解的最终产物都是氨基酸
B.纤维素不可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖的水解产物能发生银镜反应
解析:淀粉水解的产物是葡萄糖,故A项错误;纤维素水解的产物都是葡萄糖,所以纤维素可以作为工业上生产葡萄糖的原料,故B项错误;油脂在碱性条件下水解得到高级脂肪酸盐和甘油,此条件下水解为皂化反应,油脂在酸性条件下水解得到高级脂肪酸和甘油,酸性条件下水解不是皂化反应,故C项错误;蔗糖水解产物为果糖和葡萄糖,葡萄糖含醛基能发生银镜反应,故D项正确。
答案:D
15.属于氧化还原反应且能量变化与如图一致的是( )
A.NH4ClNH3↑+HCl↑
B.HCl+NaOH===NaOH+H2O
C.2NH4Cl+Ba(OH)2·8H2O===2NH3↑+BaCl2+10H2O
D.CO2+C2CO
解析:NH4ClNH3↑+HCl↑属于非氧化还原反应,A项错误;HCl+NaOH===NaOH+H2O属于非氧化还原反应、放热反应,B项错误;2NH4Cl+Ba(OH)2·8H2O===2NH3↑+BaCl2+10H2O属于非氧化还原反应、吸热反应,C项错误;CO2+C2CO属于氧化还原反应且是吸热反应,D项正确。
答案:D
16.用Zn粒与稀硫酸反应制取氢气时,下列措施不能增大氢气生成速率的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用锌粒,改用锌粉
解析:加热,温度升高,能使反应速率增大,故A项不符合题意;浓硫酸具有强氧化性,改用98%的浓硫酸,Zn粒与浓硫酸反应会生成二氧化硫,不产生氢气,故B项符合题意;滴加少量的CuSO4溶液,Zn与CuSO4反应生成Cu,铜与锌、稀硫酸溶液组成原电池,使反应速率增大,故C项不符合题意;改用锌粉,增大了接触面积,使反应速率增大,故D项不符合题意。
答案:B
17.下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)2Na+Cl2↑
B.Al2O3+3H22Al+3H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
解析:钠是活泼金属,应采用电解法制取,故A项正确;铝是活泼金属,应采用电解氧化铝制取金属铝,故B项错误;Fe、Zn、Cu等中等活泼金属用热还原法冶炼,故C项正确;Hg、Ag等不活泼金属采用热分解法冶炼,加热氧化汞可以获得金属汞,故D项正确。
答案:B
18.下列实验操作正确的是( )
A.点燃酒精灯
B.稀释浓硫酸
C.过滤
D.蒸发操作中移开蒸发皿
解析:点燃酒精灯不可用其他燃着的酒精灯,A项错误;稀释浓硫酸的方法是将浓硫酸沿着烧杯壁缓缓注入水中,并不断地搅拌,B项错误;过滤操作所使用的仪器有烧杯,玻璃棒,漏斗,C项正确;移取热的蒸发皿或坩埚都要使用坩埚钳,D项错误。
答案:C
19.氮化铝(AlN)被广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C2AlN+3CO。下列叙述正确的是( )
A.AlN中Al元素的化合价为-3价
B.Al2O3发生氧化反应
C.N2发生还原反应
D.上述反应的本质是化合价的变化
解析:在金属与非金属构成的化合物中,金属元素显正价,非金属元素显负价,因此Al的化合价为+3价,A项错误;反应过程中Al2O3的各元素化合价没有发生变化,因此Al2O3并没有发生氧化还原反应,B项错误;上述反应中,N2的化合价从0价变成-3价,化合价降低,发生还原反应,C项正确;氧化还原反应的本质为电子的转移或者偏移,D项错误。
答案:C
20.一定条件下的密闭容器中,发生可逆反应:N2+3H2 2NH3。下列情况不能说明该反应一定达到化学平衡的是( )
A.NH3的质量保持不变
B.H2的浓度保持不变
C.正反应和逆反应速率相等
D.N2、H2、NH3的物质的量之比为1∶2∶3
解析:NH3的质量保持不变,密闭容器体积不变,则NH3的浓度不变,达到化学平衡状态,A项不符合题意;H2的浓度不变,浓度不再改变,化学反应达到平衡状态,B项不符合题意;正反应和逆反应速率相等,化学反应达到平衡状态,C项不符合题意;平衡时,N2、H2和NH3的物质的量之比取决于起始量之比与转化程度,不能作为达到平衡的标志,D项符合题意。
答案:D
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。
(1)下图所示的模型表示的分子中,可由A、D形成的是____________(填字母)。
c分子的空间构型为________________,d分子的结构简式为________________。
(2)关于a(乙烯)分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有________个;
②a能使溴的水溶液褪色,该反应的生成物的名称是__________________(命名);
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=____________时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式________________________;________________________。
(3)Na在R的单质气体中燃烧产物的电子式为__________;Na在F单质中燃烧的产物是__________(写化学式)。
(4)上述元素的最高价氧化物的水化物中,碱性最强的是________________________(写化学式),其与Q的单质反应的离子方程式是______________________________________________。
解析:根据元素在周期表中的位置可知A为H元素,D为C元素,F为O元素,G为Mg元素,Q为Al元素,M为S元素,R为Cl元素,N为K元素。
(1)A为H元素,D为C元素,由模型可知:a为CH2===CH2,b为NH3,c为CH4,d为C6H6,所以由A、D形成的是acd,c为CH4,其空间构型为正四面体形,d为C6H6,其结构简式为或。(2)①甲烷是正四面体结构,最多有3个原子共面,乙烯是平面形结构,最多有6个原子共面,所以a分子中的1个氢原子被甲基取代后得到的物质丙烯中在同一平面的原子最多有6+3-2=7(个);②乙烯与溴水发生加成反应生成1,2二溴乙烷;③烷烃中甲烷、乙烷、丙烷没有同分异构体,从丁烷开始出现同分异构体,所以n=4,丁烷的同分异构体有CH3CH2CH2CH3、(CH3)2CHCH3。(3)Na在Cl2中燃烧生成NaCl,氯化钠为离子化合物,电子式为Na+,Na在O2中燃烧生成Na2O2;(4)金属性最强的元素为第四周期ⅠA族元素K,对应最高价氧化物的水化物KOH的碱性最强,与Al反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。
答案:(1)acd 正四面体形 或 (2)①7 ②1,2二溴乙烷
③4 CH3CH2CH2CH3 (CH3)2CHCH3
(3)Na+ Na2O2 (4)KOH
2Al+2OH-+2H2O===2AlO+3H2↑
22.(13分)为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是________(填字母,下同)接__________,__________接________,________接________。
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为:装置乙中________________________________________________;
装置丙中____________________________________________。
(3)装置丁中酸性KMnO4溶液的作用是___________________。
(4)写出装置甲中所发生反应的化学方程式:_____________。
解析:(1)甲为浓硫酸与木炭反应的装置,KMnO4可氧化SO2,用酸性KMnO4溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认,所以装置连接顺序为A→F→E→C→D→B。(2)SO2具有漂白性,SO2能使品红褪色,丁装置用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色,证明SO2已经除尽,最后用澄清石灰水检验CO2,澄清石灰水变浑浊。若丙中品红褪色,则乙中的澄清的石灰水变浑浊,无法证明甲中反应生成了CO2。(3)若证明有CO2,需要先除去干扰气体SO2,用高锰酸钾可以吸收SO2。(4)浓硫酸与木炭在加热条件下反应生成CO2、SO2和水,化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
答案:(1)A F E C D B
(2)澄清石灰水变浑浊 品红溶液未褪色
(3)吸收SO2
(4)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
23.(14分)煤的综合利用备受关注。有如下图的转化关系,CO与H2不同比例可以合成A,已知烃A对氢气的相对密度是14,D能发生银镜反应,E为常见的酸味剂,已知—CHO和氢气加成可以得到—CH2OH。
(1)有机物A中含有的官能团的名称是________;D的名称为________;E的分子式是____________。
(2)反应①和④的反应类型分别为________________;________________。
(3)F的同分异构体中,属于酯的有__________种。
(4)反应②和⑥的反应方程式分别为______________
和__________________________________________________。
(5)下列说法正确的是__________(填字母)。
A.生成CO和H2是煤的气化,属于煤的综合利用的一种方法
B.有机物D和E都可以与新制氢氧化铜发生反应
C.有机物B和E的水溶液都具有杀菌消毒作用
D.乙酸乙酯与有机物E混合物的分离,可以用氢氧化钠溶液振荡、静置分液的方法
解析:由烃A对氢气的相对密度为14可知,烃A的相对分子质量为28,则烃A为乙烯,E为常见的酸味剂,则E为乙酸,D可以发生银镜反应,则D为乙醛,可以推断得B为乙醇,F为乙酸乙酯。
(1)A为乙烯,官能团为碳碳双键;D的名称为乙醛;E为乙酸,分子式为C2H4O2。(2)反应①为乙烯和水生成乙醇的反应为加成反应;反应④为乙醛生成乙酸的反应为催化氧化反应,故为氧化反应。(3)F的同分异构体属于酯类的包括甲酸丙酯,甲酸异丙酯,丙酸甲酯三种,故有3种。(4)反应②为乙醇生成乙醛的反应,反应方程式为2C2H5OH+O22CH3CHO+2H2O;反应⑥为乙酸和乙醇的酯化反应,反应方程式为CH3COOH+C2H5OHCH3COOC2H5+H2O。(5)生成水煤气的过程可以通过煤的气化实现,是煤的综合利用的方法,故A正确;乙醛可以和新制的氢氧化铜发生反应生成砖红色沉淀,乙酸可以和氢氧化铜发生中和反应,故B正确;乙醇和乙酸都可以进行杀菌消毒,故C正确;分离乙酸乙酯和乙酸应用饱和碳酸钠溶液震荡,如用氢氧化钠会造成乙酸乙酯的水解,故D错误;答案选ABC。
答案:(1)碳碳双键 乙醛 C2H4O2
(2)加成反应 氧化反应
(3)3
(4)2C2H5OH+O22CH3CHO+2H2O;CH3COOH+C2H5OHCH3COOC2H5+H2O (5)ABC
同课章节目录
