新教材高中化学合格性考试(广东)-模拟测试卷(六) 原卷版+解析版
文档属性
| 名称 | 新教材高中化学合格性考试(广东)-模拟测试卷(六) 原卷版+解析版 |  | |
| 格式 | doc | ||
| 文件大小 | 900.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 22:23:09 | ||
图片预览




文档简介
高中学业水平合格性考试模拟测试卷(六)
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.光导纤维的主要成分是( )
A.单晶硅 B.石墨
C.硅酸钠 D.二氧化硅
2.考古学上常用6C来测定文物的历史年代。下列关于6C的叙述错误的是( )
A.质子数是6 B.核外电子数是6
C.中子数是6 D.质量数是14
3.习近平总书记说:“绿水青山”就是金山、银山,下列做法不利于造就“绿水青山”的是( )
A.大量使用石油、煤炭
B.研发新能源汽车,减少尾气排放
C.植树造林,抑尘防沙
D.推广使用燃煤脱硫技术,防治SO2污染
4.为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH B.铁片
C.KSCN溶液 D.石蕊溶液
5.下列各组物质中,硫元素的化合价均为+4的是( )
A.Na2SO3 B.H2S2O7
C.Na2SO4 D.Na2S2O3
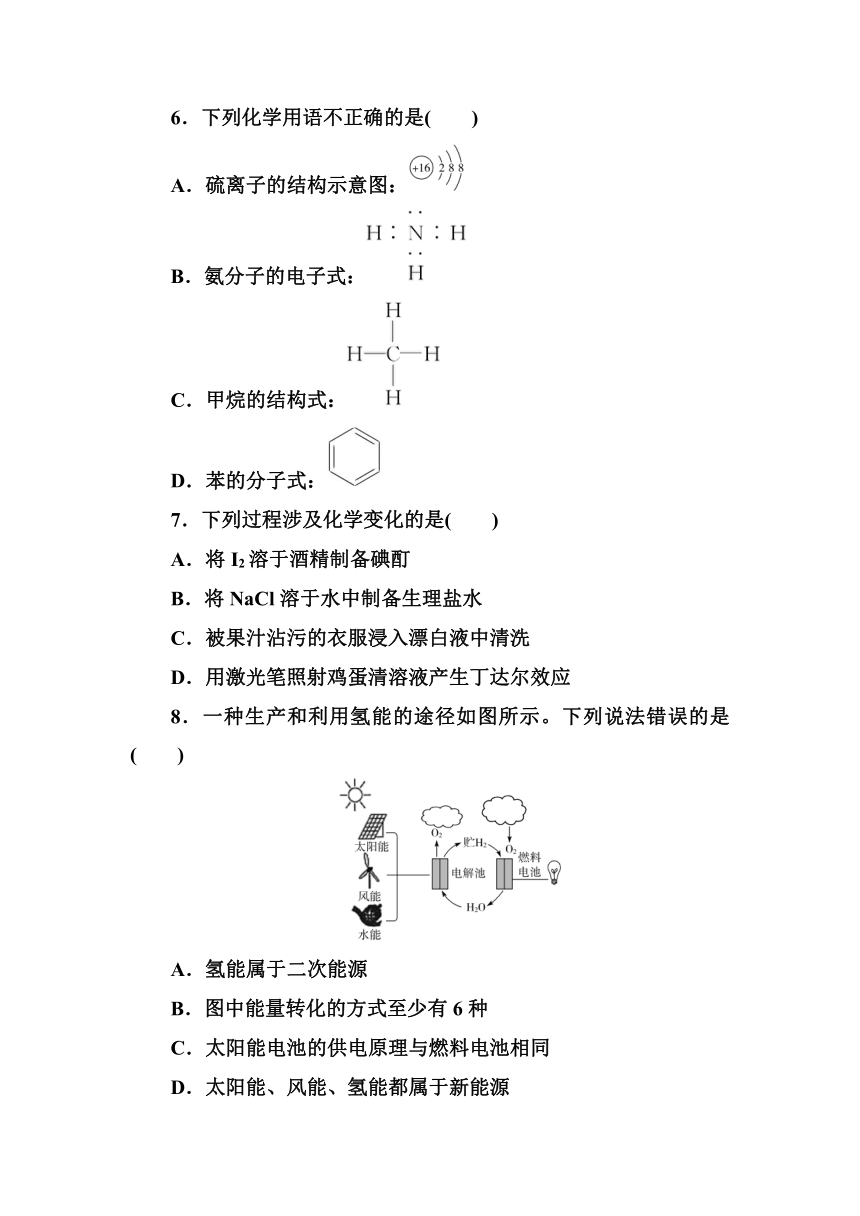
6.下列化学用语不正确的是( )
A.硫离子的结构示意图:
B.氨分子的电子式:
C.甲烷的结构式:
D.苯的分子式:
7.下列过程涉及化学变化的是( )
A.将I2溶于酒精制备碘酊
B.将NaCl溶于水中制备生理盐水
C.被果汁沾污的衣服浸入漂白液中清洗
D.用激光笔照射鸡蛋清溶液产生丁达尔效应
8.一种生产和利用氢能的途径如图所示。下列说法错误的是( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
9.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为( )
A.HX B.H2X
C.XH3 D.XH4
10.为了除去SO2中少量的HCl气体,应将混合气体通入( )
A.溴水 B.NaHSO3饱和溶液
C.NaOH溶液 D.NaHCO3饱和溶液
11.下列反应的离子方程式不正确的是( )
A.CuO和稀盐酸反应:CuO+2H+===Cu2++H2O
B.BaCl2溶液和CuSO4溶液反应:Ba2++SO===BaSO4↓
C.Fe与稀H2SO4反应:Fe+2H+===Fe2++H2↑
D.氢氧化钠溶液与盐酸反应:OH-+HCl===H2O+Cl-
12.标准状况下,下列物质中体积最大的是( )
A.44.8 L H2O B.3.01×1023个CO2
C.0.6 mol CH4 D.6 g H2
13.某原电池装置如图所示,下列说法正确的是( )
A.Cu是负极
B.电子由Cu棒经导线流向Fe棒
C.Cu棒上有气体放出
D.Fe棒处的电极反应为Fe-3e-===Fe3+
14.下列物质中既有离子键又有共价键的是( )
A.NaOH B.MgCl2
C.Na2S D.HNO3
15.反应:2Al+MoO3===Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是( )
A.Al是氧化剂 B.Mo被氧化
C.Al失去电子 D.MoO3发生氧化反应
16.可逆反应:A(g)+2B(g) C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.v(A)=0.15 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.4 mol/(L·min) D.v(D)=0.02 mol/(L·s)
17.能与金属钠反应生成H2的有机物是( )
A.CH3CH2OH B.CH3CH2Br
C.苯 D.水
18.实验室用氯化铵固体和熟石灰固体制取氨气,下列装置组合正确的是( )
A.①③ B.①⑤
C.②③ D.②④
19.t ℃时,反应:N2+3H22NH3在容积固定的密闭容器中进行,达到平衡状态的标志是( )
A.N2和H2完全转化为NH3
B.NH3的物质的量浓度不再发生变化
C.单位时间内消耗n mol N2的同时生成2n mol NH3
D.v(NH3)=v(N2)
20.中学化学实验可用如图所示的装置制取乙酸乙酯,下列说法正确的是( )
A.反应混合液的加入顺序依次为浓硫酸、乙醇、冰乙酸
B.浓硫酸不仅可以增大该反应的速率,还能提高该反应的产率
C.右侧长导管起到了冷凝回流的作用
D.饱和碳酸钠溶液可用氢氧化钠溶液代替
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表为元素周期表的一部分,请回答有关问题:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
①
②
3
③ ④ ⑤
⑥ ⑦ ⑧
4 ⑨
(1)⑤和⑧的元素符号是________和________。
(2)此表中最活泼的金属是________(填元素符号,下同),非金属性最强的元素是________。
(3)在③~⑦元素中,原子半径最大的是________(填元素符号)。
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与⑥最高价氧化物的水化物反应的化学方程式:______。
22.(13分)在实验室中用二氧化锰跟浓盐酸反应制备并收集干燥纯净的氯气。进行此实验,所用仪器如图:
(1)上述仪器正确的连接顺序是________接________,________接________,________接__________,__________接________。(填各接口处的字母)
(2)发生装置中发生的化学反应方程式为_________________。
(3)回答下列物质在装置中的作用。
①饱和食盐水的作用是________________________________。
②浓硫酸的作用是____________________________________。
(4)写出烧杯中发生反应的化学方程式:_________________。
23.(14分)已知A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图1所示(已知:R—CHOR—COOH):
图1
请回答下列问题:
(1)决定B、D化学性质的原子团的名称分别是________、________。
(2)在反应①~⑥中,属于加成反应的是________(填序号,下同),属于取代反应的是________。
(3)B和D进行缓慢,增大该反应速率的主要方法是________________________________________,用于鉴别B、D和甲的一种试剂是____________。
(4)写出下列反应的化学方程式。
②__________________________________________________;
④__________________________________________________;
⑥________________________________________________。
(5)某化学兴趣小组设计有机物B氧化的实验装置如图2所示,图中加热器、铁架台、铁夹等均未画出。
图2
已知醛与新制Cu(OH)2悬浊液的反应与葡萄糖相似。
①加热e处固体的目的是__________________________,d处碱石灰的作用是________________________________,g处导管倾斜的作用是________________________________。
②为使a中的B平稳气化成蒸气,可采用的加热方法是_____。
③能证明B反应后的实验现象是________________________。
高中学业水平合格性考试模拟测试卷(六)解析版
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.光导纤维的主要成分是( )
A.单晶硅 B.石墨
C.硅酸钠 D.二氧化硅
解析:光导纤维的主要成分是二氧化硅。
答案:D
2.考古学上常用6C来测定文物的历史年代。下列关于6C的叙述错误的是( )
A.质子数是6 B.核外电子数是6
C.中子数是6 D.质量数是14
解析:考古学上常用6C来测定文物的历史年代,6C左上角的数字14是质量数,左下角的数字6是质子数。原子的核外电子数=质子数,中子数=质量数-质子数=14-6=8,答案选C。
答案:C
3.习近平总书记说:“绿水青山”就是金山、银山,下列做法不利于造就“绿水青山”的是( )
A.大量使用石油、煤炭
B.研发新能源汽车,减少尾气排放
C.植树造林,抑尘防沙
D.推广使用燃煤脱硫技术,防治SO2污染
解析:加大石油、煤炭的使用,会向空气中排放大量空气污染物,故A项符合题意;研发新能源汽车,减少尾气排放,故B项不符合题意;植树造林,抑尘防沙,可以减少空气中灰尘颗粒,减少雾霾的发生,故C项不符合题意;推广使用燃煤脱硫技术,防治SO2污染,可以减少二氧化硫对空气污染,减少酸雨的发生,故D项不符合题意;综上所述,答案选A。
答案:A
4.为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH B.铁片
C.KSCN溶液 D.石蕊溶液
解析:FeCl2溶液变质,是由于亚铁离子有强还原性,被氧气氧化为FeCl3,即检验某氯化亚铁溶液是否变质,即是检验是否有Fe3+,而Fe3+能和SCN-生成络合物,使溶液呈现红色;因此,向FeCl2溶液中加入KSCN溶液,若出现红色,则FeCl2溶液变质了,反之没有变质。
答案:C
5.下列各组物质中,硫元素的化合价均为+4的是( )
A.Na2SO3 B.H2S2O7
C.Na2SO4 D.Na2S2O3
解析:Na2SO3中,硫元素的化合价为+4价;H2S2O7中,硫元素的化合价为+6价;Na2SO4中,硫元素的化合价为+6价;Na2S2O3中,硫元素的化合价为+2价。
答案:A
6.下列化学用语不正确的是( )
A.硫离子的结构示意图:
B.氨分子的电子式:
C.甲烷的结构式:
D.苯的分子式:
解析:S元素为16号元素,原子核外有16个电子,得2个电子形成S2-,结构示意图为,A项正确;氨为共价化合物,N原子最外层达到8电子稳定,电子式为,B项正确;甲烷的结构式为,C项正确;苯的分子式为C6H6,题目所给为苯的结构简式,D项错误。
答案:D
7.下列过程涉及化学变化的是( )
A.将I2溶于酒精制备碘酊
B.将NaCl溶于水中制备生理盐水
C.被果汁沾污的衣服浸入漂白液中清洗
D.用激光笔照射鸡蛋清溶液产生丁达尔效应
解析:碘单质易溶于有机物,酒精属于有机物,碘单质溶于酒精,属于物理变化,故A项不符合题意;NaCl溶于水,属于物理变化,故B项不符合题意;利用漂白液的强氧化性,把有色物质氧化,属于化学变化,故C项符合题意;丁达尔效应属于胶体的光学性质,无新物质生成,故D项不符合题意。
答案:C
8.一种生产和利用氢能的途径如图所示。下列说法错误的是( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
解析:氢能属于二次能源,A项正确;图中涉及的能量转化方式有太阳能、风能、水能转化为电能,电能与化学能的相互转化,电能向光能的转化,B项正确;太阳能电池的供电原理与燃料电池不同,C项错误;太阳能、风能、氢能都属于新能源,D项正确。
答案:C
9.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为( )
A.HX B.H2X
C.XH3 D.XH4
解析:X元素的最高价氧化物对应的水化物的化学式为HXO3,则X的最高正价为+5价,说明X原子最外层有5个电子,最低化合价为-3价,形成的氢化物为XH3,C选项正确。
答案:C
10.为了除去SO2中少量的HCl气体,应将混合气体通入( )
A.溴水 B.NaHSO3饱和溶液
C.NaOH溶液 D.NaHCO3饱和溶液
解析:溴水具有氧化性,会将二氧化硫氧化,将原物质除去,故A项不符合题意;HCl与亚硫酸氢钠饱和溶液反应生成二氧化硫,且不引入新杂质,洗气可分离,故B项符合题意;二者均与NaOH反应,不能除杂,故C项不符合题意;二者均与碳酸氢钠饱和溶液反应,不能除杂,故D项不符合题意。
答案:B
11.下列反应的离子方程式不正确的是( )
A.CuO和稀盐酸反应:CuO+2H+===Cu2++H2O
B.BaCl2溶液和CuSO4溶液反应:Ba2++SO===BaSO4↓
C.Fe与稀H2SO4反应:Fe+2H+===Fe2++H2↑
D.氢氧化钠溶液与盐酸反应:OH-+HCl===H2O+Cl-
解析:CuO为碱性氧化物和稀盐酸反应生成氯化铜和水,反应离子方程式为CuO+2H+===Cu2++H2O,故A项正确;BaCl2溶液和CuSO4溶液反应生成氯化铜和硫酸钡沉淀,反应离子方程式为Ba2++SO===BaSO4↓,故B项正确;Fe与稀H2SO4反应生成硫酸亚铁和水,反应离子方程式为Fe+2H+===Fe2++H2↑,故C项正确;盐酸为强酸属于强电解质,离子反应中可拆写,氢氧化钠溶液与盐酸反应离子方程式为OH-+H+===H2O,故D项错误。
答案:D
12.标准状况下,下列物质中体积最大的是( )
A.44.8 L H2O B.3.01×1023个CO2
C.0.6 mol CH4 D.6 g H2
解析:根据V=nVm可知,相同条件下气体物质的量越大,体积越大。44.8 L H2O在标况下不是气体,其体积最小;3.01×1023个CO2的物质的量为0.5 mol;0.6 mol CH4气体;6 g H2的物质的量为3 mol。
答案:D
13.某原电池装置如图所示,下列说法正确的是( )
A.Cu是负极
B.电子由Cu棒经导线流向Fe棒
C.Cu棒上有气体放出
D.Fe棒处的电极反应为Fe-3e-===Fe3+
解析:根据分析知,Cu是正极,A项错误;电子由负极经导线流向正极,所以电子由Fe棒经导线流向Cu棒,B项错误;Cu棒上氢离子得到电子产生氢气,C项正确;Fe棒处,铁失去电子生成Fe2+,电极反应为Fe-2e-===Fe2+,D项错误。
答案:C
14.下列物质中既有离子键又有共价键的是( )
A.NaOH B.MgCl2
C.Na2S D.HNO3
解析:NaOH中含钠离子与氢氧根之间的离子键和H—O之间的共价键,A项符合题意;MgCl2中只含有离子键,B项不符合题意;Na2S中只含有离子键,C项不符合题意;HNO3中只含有共价键,D项不符合题意。
答案:A
15.反应:2Al+MoO3===Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是( )
A.Al是氧化剂 B.Mo被氧化
C.Al失去电子 D.MoO3发生氧化反应
解析:反应:2Al+MoO3===Mo+Al2O3中Al元素的化合价升高,失电子,被氧化,Al作还原剂,Al2O3为氧化产物,Mo元素的化合价降低,得电子,被还原,MoO3作氧化剂,Mo为还原产物,故A项错误;Mo元素的化合价降低,得电子,被还原,MoO3作氧化剂,Mo为还原产物,故B项错误;Al元素的化合价升高,失电子,被氧化,Al作还原剂,故C项正确;MoO3作氧化剂,被还原,发生还原反应,故D项错误。
答案:C
16.可逆反应:A(g)+2B(g) C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.v(A)=0.15 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.4 mol/(L·min) D.v(D)=0.02 mol/(L·s)
解析:A项,=0.15 mol/(L·min);B项,=0.3 mol/(L·min);C项,=0.4 mol/(L·min);D项,v(D)=0.02 mol/(L·s)=1.2 mol/(L·min),=1.2 mol/(L·min);故反应速率:v(D)>v(C)>v(B)>v(A),故答案选D。
答案:D
17.能与金属钠反应生成H2的有机物是( )
A.CH3CH2OH B.CH3CH2Br
C.苯 D.水
解析:CH3CH2OH含有羟基可以钠反应生成氢气,且乙醇属于有机物,故A项符合题意;CH3CH2Br虽为有机物,但不与金属钠反应,故B项不符合题意;苯虽为有机物,但不与金属钠反应,故C项不符合题意;水虽然和金属钠反应生成氢气,但水为无机物,故D项不符合题意。
答案:A
18.实验室用氯化铵固体和熟石灰固体制取氨气,下列装置组合正确的是( )
A.①③ B.①⑤
C.②③ D.②④
解析:实验室用氯化铵固体和熟石灰固体制取氨气,属于固体混合需加热型,发生装置是①,氨气密度比空气小、易溶于水,可用向下排空法(装置⑤),不能用向上排空气法(装置④)或排水法(装置③)收集,装置组合正确的是①⑤,只有B项正确。
答案:B
19.t ℃时,反应:N2+3H22NH3在容积固定的密闭容器中进行,达到平衡状态的标志是( )
A.N2和H2完全转化为NH3
B.NH3的物质的量浓度不再发生变化
C.单位时间内消耗n mol N2的同时生成2n mol NH3
D.v(NH3)=v(N2)
解析:合成氨的反应属于可逆反应,N2和H2不能完全转化为NH3,故A项不符合题意;NH3的物质的量浓度不再发生变化,反应达到平衡状态,故B项符合题意;单位时间内消耗n mol N2的同时生成2n mol NH3都代表的是正反应方向的速率,未体现正、逆反应速率的关系,故不能代表反应达到平衡状态,故C项不符合题意;根据化学反应速率之比等于化学计量数之比,v(NH3)=2v(N2),v(NH3)和v(N2)不相等,未体现正、逆反应速率的关系,也不能代表化学反应达到平衡状态,故D项不符合题意。
答案:B
20.中学化学实验可用如图所示的装置制取乙酸乙酯,下列说法正确的是( )
A.反应混合液的加入顺序依次为浓硫酸、乙醇、冰乙酸
B.浓硫酸不仅可以增大该反应的速率,还能提高该反应的产率
C.右侧长导管起到了冷凝回流的作用
D.饱和碳酸钠溶液可用氢氧化钠溶液代替
解析:为了防止混合液体溅出,发生危险,反应混合液的加入顺序依次为乙醇、浓硫酸、冰乙酸,A项错误;浓硫酸在反应中起催化作用,增大该反应的速率,同时能吸收生成的水,使平衡正向移动,提高该反应的产率,B项正确;右侧长导管起到了冷凝的作用,不能回流,C项错误;用氢氧化钠溶液能将生成的乙酸乙酯水解,降低了乙酸乙酯的产率,所以饱和碳酸钠溶液不可用氢氧化钠溶液代替,D项错误。
答案:B
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表为元素周期表的一部分,请回答有关问题:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
①
②
3
③ ④ ⑤
⑥ ⑦ ⑧
4 ⑨
(1)⑤和⑧的元素符号是________和________。
(2)此表中最活泼的金属是________(填元素符号,下同),非金属性最强的元素是________。
(3)在③~⑦元素中,原子半径最大的是________(填元素符号)。
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与⑥最高价氧化物的水化物反应的化学方程式:______。
解析:由表知①②③④⑤⑥⑦⑧⑨对应的元素分别为N、F、Mg、Al、Si、S、Cl、Ar、K。根据元素周期律,原子半径:同周期由左向右逐渐减小,金属性逐渐减弱,非金属性逐渐增强,同主族由上到下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,题图中最活泼的金属是K,非金属性最强的元素是F。(4)能形成两性氢氧化物的元素是Al,2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O。
答案:(1)Si Ar (2)K F (3)Mg (4)Al 2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
22.(13分)在实验室中用二氧化锰跟浓盐酸反应制备并收集干燥纯净的氯气。进行此实验,所用仪器如图:
(1)上述仪器正确的连接顺序是________接________,________接________,________接__________,__________接________。(填各接口处的字母)
(2)发生装置中发生的化学反应方程式为_________________。
(3)回答下列物质在装置中的作用。
①饱和食盐水的作用是________________________________。
②浓硫酸的作用是____________________________________。
(4)写出烧杯中发生反应的化学方程式:_________________。
解析:实验室制干燥氯气,氯气密度比空气大且易溶于水,故用向上排空气法收集,需要用氢氧化钠溶液吸收尾气,浓硫酸用于干燥气体,饱和食盐水用于除杂吸收挥发出的氯化氢气体。
(1)根据上述分析可知,制得的氯气中含有水蒸气和氯化氢,分别用饱和食盐水、浓硫酸来除去,采用向上排空气法进行收集,最后进行尾气的处理,所以仪器正确的连接顺序是(填各接口处的字母):E接C,D接A,B接H,G接F。(2)发生装置中发生的化学反应方程式MnO2+4HCl(浓)===MnCl2+Cl2+2H2O。(3)在装置中:①饱和食盐水的作用是除去Cl2中的HCl气体;②浓硫酸的作用是除去Cl2中的H2O蒸气。(4)烧杯中发生反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O。
答案:(1)E C D A B H G F
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)①除去Cl2中的HCl气体 ②除去Cl2中的H2O蒸气
(4)Cl2+2NaOH===NaCl+NaClO+H2O
23.(14分)已知A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图1所示(已知:R—CHOR—COOH):
图1
请回答下列问题:
(1)决定B、D化学性质的原子团的名称分别是________、________。
(2)在反应①~⑥中,属于加成反应的是________(填序号,下同),属于取代反应的是________。
(3)B和D进行缓慢,增大该反应速率的主要方法是________________________________________,用于鉴别B、D和甲的一种试剂是____________。
(4)写出下列反应的化学方程式。
②__________________________________________________;
④__________________________________________________;
⑥________________________________________________。
(5)某化学兴趣小组设计有机物B氧化的实验装置如图2所示,图中加热器、铁架台、铁夹等均未画出。
图2
已知醛与新制Cu(OH)2悬浊液的反应与葡萄糖相似。
①加热e处固体的目的是__________________________,d处碱石灰的作用是________________________________,g处导管倾斜的作用是________________________________。
②为使a中的B平稳气化成蒸气,可采用的加热方法是_____。
③能证明B反应后的实验现象是________________________。
答案:(1)羟基 羧基
(2)①⑥ ④⑤
(3)加入浓硫酸作催化剂、加热、增加乙醇和乙酸浓度 饱和Na2CO3溶液
(4)2CH3CH2OH+O22CH3CHO+2H2O CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
nCH2===CH2
(5)①制取O2 防止f处的水蒸气进入C处的无水硫酸铜发生反应而干扰实验结果 冷凝回流乙醇 ②将试管a放入78.5 ℃或稍高于78.5 ℃的热水浴中 ③c处无水硫酸铜粉末变成蓝色晶体,取下试管f在酒精灯上加热,观察到有砖红色沉淀生成
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.光导纤维的主要成分是( )
A.单晶硅 B.石墨
C.硅酸钠 D.二氧化硅
2.考古学上常用6C来测定文物的历史年代。下列关于6C的叙述错误的是( )
A.质子数是6 B.核外电子数是6
C.中子数是6 D.质量数是14
3.习近平总书记说:“绿水青山”就是金山、银山,下列做法不利于造就“绿水青山”的是( )
A.大量使用石油、煤炭
B.研发新能源汽车,减少尾气排放
C.植树造林,抑尘防沙
D.推广使用燃煤脱硫技术,防治SO2污染
4.为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH B.铁片
C.KSCN溶液 D.石蕊溶液
5.下列各组物质中,硫元素的化合价均为+4的是( )
A.Na2SO3 B.H2S2O7
C.Na2SO4 D.Na2S2O3
6.下列化学用语不正确的是( )
A.硫离子的结构示意图:
B.氨分子的电子式:
C.甲烷的结构式:
D.苯的分子式:
7.下列过程涉及化学变化的是( )
A.将I2溶于酒精制备碘酊
B.将NaCl溶于水中制备生理盐水
C.被果汁沾污的衣服浸入漂白液中清洗
D.用激光笔照射鸡蛋清溶液产生丁达尔效应
8.一种生产和利用氢能的途径如图所示。下列说法错误的是( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
9.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为( )
A.HX B.H2X
C.XH3 D.XH4
10.为了除去SO2中少量的HCl气体,应将混合气体通入( )
A.溴水 B.NaHSO3饱和溶液
C.NaOH溶液 D.NaHCO3饱和溶液
11.下列反应的离子方程式不正确的是( )
A.CuO和稀盐酸反应:CuO+2H+===Cu2++H2O
B.BaCl2溶液和CuSO4溶液反应:Ba2++SO===BaSO4↓
C.Fe与稀H2SO4反应:Fe+2H+===Fe2++H2↑
D.氢氧化钠溶液与盐酸反应:OH-+HCl===H2O+Cl-
12.标准状况下,下列物质中体积最大的是( )
A.44.8 L H2O B.3.01×1023个CO2
C.0.6 mol CH4 D.6 g H2
13.某原电池装置如图所示,下列说法正确的是( )
A.Cu是负极
B.电子由Cu棒经导线流向Fe棒
C.Cu棒上有气体放出
D.Fe棒处的电极反应为Fe-3e-===Fe3+
14.下列物质中既有离子键又有共价键的是( )
A.NaOH B.MgCl2
C.Na2S D.HNO3
15.反应:2Al+MoO3===Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是( )
A.Al是氧化剂 B.Mo被氧化
C.Al失去电子 D.MoO3发生氧化反应
16.可逆反应:A(g)+2B(g) C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.v(A)=0.15 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.4 mol/(L·min) D.v(D)=0.02 mol/(L·s)
17.能与金属钠反应生成H2的有机物是( )
A.CH3CH2OH B.CH3CH2Br
C.苯 D.水
18.实验室用氯化铵固体和熟石灰固体制取氨气,下列装置组合正确的是( )
A.①③ B.①⑤
C.②③ D.②④
19.t ℃时,反应:N2+3H22NH3在容积固定的密闭容器中进行,达到平衡状态的标志是( )
A.N2和H2完全转化为NH3
B.NH3的物质的量浓度不再发生变化
C.单位时间内消耗n mol N2的同时生成2n mol NH3
D.v(NH3)=v(N2)
20.中学化学实验可用如图所示的装置制取乙酸乙酯,下列说法正确的是( )
A.反应混合液的加入顺序依次为浓硫酸、乙醇、冰乙酸
B.浓硫酸不仅可以增大该反应的速率,还能提高该反应的产率
C.右侧长导管起到了冷凝回流的作用
D.饱和碳酸钠溶液可用氢氧化钠溶液代替
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表为元素周期表的一部分,请回答有关问题:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
①
②
3
③ ④ ⑤
⑥ ⑦ ⑧
4 ⑨
(1)⑤和⑧的元素符号是________和________。
(2)此表中最活泼的金属是________(填元素符号,下同),非金属性最强的元素是________。
(3)在③~⑦元素中,原子半径最大的是________(填元素符号)。
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与⑥最高价氧化物的水化物反应的化学方程式:______。
22.(13分)在实验室中用二氧化锰跟浓盐酸反应制备并收集干燥纯净的氯气。进行此实验,所用仪器如图:
(1)上述仪器正确的连接顺序是________接________,________接________,________接__________,__________接________。(填各接口处的字母)
(2)发生装置中发生的化学反应方程式为_________________。
(3)回答下列物质在装置中的作用。
①饱和食盐水的作用是________________________________。
②浓硫酸的作用是____________________________________。
(4)写出烧杯中发生反应的化学方程式:_________________。
23.(14分)已知A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图1所示(已知:R—CHOR—COOH):
图1
请回答下列问题:
(1)决定B、D化学性质的原子团的名称分别是________、________。
(2)在反应①~⑥中,属于加成反应的是________(填序号,下同),属于取代反应的是________。
(3)B和D进行缓慢,增大该反应速率的主要方法是________________________________________,用于鉴别B、D和甲的一种试剂是____________。
(4)写出下列反应的化学方程式。
②__________________________________________________;
④__________________________________________________;
⑥________________________________________________。
(5)某化学兴趣小组设计有机物B氧化的实验装置如图2所示,图中加热器、铁架台、铁夹等均未画出。
图2
已知醛与新制Cu(OH)2悬浊液的反应与葡萄糖相似。
①加热e处固体的目的是__________________________,d处碱石灰的作用是________________________________,g处导管倾斜的作用是________________________________。
②为使a中的B平稳气化成蒸气,可采用的加热方法是_____。
③能证明B反应后的实验现象是________________________。
高中学业水平合格性考试模拟测试卷(六)解析版
(时间:60分钟 满分:100分)
第一部分 选择题
一、选择题:本大题共20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意。
1.光导纤维的主要成分是( )
A.单晶硅 B.石墨
C.硅酸钠 D.二氧化硅
解析:光导纤维的主要成分是二氧化硅。
答案:D
2.考古学上常用6C来测定文物的历史年代。下列关于6C的叙述错误的是( )
A.质子数是6 B.核外电子数是6
C.中子数是6 D.质量数是14
解析:考古学上常用6C来测定文物的历史年代,6C左上角的数字14是质量数,左下角的数字6是质子数。原子的核外电子数=质子数,中子数=质量数-质子数=14-6=8,答案选C。
答案:C
3.习近平总书记说:“绿水青山”就是金山、银山,下列做法不利于造就“绿水青山”的是( )
A.大量使用石油、煤炭
B.研发新能源汽车,减少尾气排放
C.植树造林,抑尘防沙
D.推广使用燃煤脱硫技术,防治SO2污染
解析:加大石油、煤炭的使用,会向空气中排放大量空气污染物,故A项符合题意;研发新能源汽车,减少尾气排放,故B项不符合题意;植树造林,抑尘防沙,可以减少空气中灰尘颗粒,减少雾霾的发生,故C项不符合题意;推广使用燃煤脱硫技术,防治SO2污染,可以减少二氧化硫对空气污染,减少酸雨的发生,故D项不符合题意;综上所述,答案选A。
答案:A
4.为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH B.铁片
C.KSCN溶液 D.石蕊溶液
解析:FeCl2溶液变质,是由于亚铁离子有强还原性,被氧气氧化为FeCl3,即检验某氯化亚铁溶液是否变质,即是检验是否有Fe3+,而Fe3+能和SCN-生成络合物,使溶液呈现红色;因此,向FeCl2溶液中加入KSCN溶液,若出现红色,则FeCl2溶液变质了,反之没有变质。
答案:C
5.下列各组物质中,硫元素的化合价均为+4的是( )
A.Na2SO3 B.H2S2O7
C.Na2SO4 D.Na2S2O3
解析:Na2SO3中,硫元素的化合价为+4价;H2S2O7中,硫元素的化合价为+6价;Na2SO4中,硫元素的化合价为+6价;Na2S2O3中,硫元素的化合价为+2价。
答案:A
6.下列化学用语不正确的是( )
A.硫离子的结构示意图:
B.氨分子的电子式:
C.甲烷的结构式:
D.苯的分子式:
解析:S元素为16号元素,原子核外有16个电子,得2个电子形成S2-,结构示意图为,A项正确;氨为共价化合物,N原子最外层达到8电子稳定,电子式为,B项正确;甲烷的结构式为,C项正确;苯的分子式为C6H6,题目所给为苯的结构简式,D项错误。
答案:D
7.下列过程涉及化学变化的是( )
A.将I2溶于酒精制备碘酊
B.将NaCl溶于水中制备生理盐水
C.被果汁沾污的衣服浸入漂白液中清洗
D.用激光笔照射鸡蛋清溶液产生丁达尔效应
解析:碘单质易溶于有机物,酒精属于有机物,碘单质溶于酒精,属于物理变化,故A项不符合题意;NaCl溶于水,属于物理变化,故B项不符合题意;利用漂白液的强氧化性,把有色物质氧化,属于化学变化,故C项符合题意;丁达尔效应属于胶体的光学性质,无新物质生成,故D项不符合题意。
答案:C
8.一种生产和利用氢能的途径如图所示。下列说法错误的是( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
解析:氢能属于二次能源,A项正确;图中涉及的能量转化方式有太阳能、风能、水能转化为电能,电能与化学能的相互转化,电能向光能的转化,B项正确;太阳能电池的供电原理与燃料电池不同,C项错误;太阳能、风能、氢能都属于新能源,D项正确。
答案:C
9.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为( )
A.HX B.H2X
C.XH3 D.XH4
解析:X元素的最高价氧化物对应的水化物的化学式为HXO3,则X的最高正价为+5价,说明X原子最外层有5个电子,最低化合价为-3价,形成的氢化物为XH3,C选项正确。
答案:C
10.为了除去SO2中少量的HCl气体,应将混合气体通入( )
A.溴水 B.NaHSO3饱和溶液
C.NaOH溶液 D.NaHCO3饱和溶液
解析:溴水具有氧化性,会将二氧化硫氧化,将原物质除去,故A项不符合题意;HCl与亚硫酸氢钠饱和溶液反应生成二氧化硫,且不引入新杂质,洗气可分离,故B项符合题意;二者均与NaOH反应,不能除杂,故C项不符合题意;二者均与碳酸氢钠饱和溶液反应,不能除杂,故D项不符合题意。
答案:B
11.下列反应的离子方程式不正确的是( )
A.CuO和稀盐酸反应:CuO+2H+===Cu2++H2O
B.BaCl2溶液和CuSO4溶液反应:Ba2++SO===BaSO4↓
C.Fe与稀H2SO4反应:Fe+2H+===Fe2++H2↑
D.氢氧化钠溶液与盐酸反应:OH-+HCl===H2O+Cl-
解析:CuO为碱性氧化物和稀盐酸反应生成氯化铜和水,反应离子方程式为CuO+2H+===Cu2++H2O,故A项正确;BaCl2溶液和CuSO4溶液反应生成氯化铜和硫酸钡沉淀,反应离子方程式为Ba2++SO===BaSO4↓,故B项正确;Fe与稀H2SO4反应生成硫酸亚铁和水,反应离子方程式为Fe+2H+===Fe2++H2↑,故C项正确;盐酸为强酸属于强电解质,离子反应中可拆写,氢氧化钠溶液与盐酸反应离子方程式为OH-+H+===H2O,故D项错误。
答案:D
12.标准状况下,下列物质中体积最大的是( )
A.44.8 L H2O B.3.01×1023个CO2
C.0.6 mol CH4 D.6 g H2
解析:根据V=nVm可知,相同条件下气体物质的量越大,体积越大。44.8 L H2O在标况下不是气体,其体积最小;3.01×1023个CO2的物质的量为0.5 mol;0.6 mol CH4气体;6 g H2的物质的量为3 mol。
答案:D
13.某原电池装置如图所示,下列说法正确的是( )
A.Cu是负极
B.电子由Cu棒经导线流向Fe棒
C.Cu棒上有气体放出
D.Fe棒处的电极反应为Fe-3e-===Fe3+
解析:根据分析知,Cu是正极,A项错误;电子由负极经导线流向正极,所以电子由Fe棒经导线流向Cu棒,B项错误;Cu棒上氢离子得到电子产生氢气,C项正确;Fe棒处,铁失去电子生成Fe2+,电极反应为Fe-2e-===Fe2+,D项错误。
答案:C
14.下列物质中既有离子键又有共价键的是( )
A.NaOH B.MgCl2
C.Na2S D.HNO3
解析:NaOH中含钠离子与氢氧根之间的离子键和H—O之间的共价键,A项符合题意;MgCl2中只含有离子键,B项不符合题意;Na2S中只含有离子键,C项不符合题意;HNO3中只含有共价键,D项不符合题意。
答案:A
15.反应:2Al+MoO3===Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是( )
A.Al是氧化剂 B.Mo被氧化
C.Al失去电子 D.MoO3发生氧化反应
解析:反应:2Al+MoO3===Mo+Al2O3中Al元素的化合价升高,失电子,被氧化,Al作还原剂,Al2O3为氧化产物,Mo元素的化合价降低,得电子,被还原,MoO3作氧化剂,Mo为还原产物,故A项错误;Mo元素的化合价降低,得电子,被还原,MoO3作氧化剂,Mo为还原产物,故B项错误;Al元素的化合价升高,失电子,被氧化,Al作还原剂,故C项正确;MoO3作氧化剂,被还原,发生还原反应,故D项错误。
答案:C
16.可逆反应:A(g)+2B(g) C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.v(A)=0.15 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.4 mol/(L·min) D.v(D)=0.02 mol/(L·s)
解析:A项,=0.15 mol/(L·min);B项,=0.3 mol/(L·min);C项,=0.4 mol/(L·min);D项,v(D)=0.02 mol/(L·s)=1.2 mol/(L·min),=1.2 mol/(L·min);故反应速率:v(D)>v(C)>v(B)>v(A),故答案选D。
答案:D
17.能与金属钠反应生成H2的有机物是( )
A.CH3CH2OH B.CH3CH2Br
C.苯 D.水
解析:CH3CH2OH含有羟基可以钠反应生成氢气,且乙醇属于有机物,故A项符合题意;CH3CH2Br虽为有机物,但不与金属钠反应,故B项不符合题意;苯虽为有机物,但不与金属钠反应,故C项不符合题意;水虽然和金属钠反应生成氢气,但水为无机物,故D项不符合题意。
答案:A
18.实验室用氯化铵固体和熟石灰固体制取氨气,下列装置组合正确的是( )
A.①③ B.①⑤
C.②③ D.②④
解析:实验室用氯化铵固体和熟石灰固体制取氨气,属于固体混合需加热型,发生装置是①,氨气密度比空气小、易溶于水,可用向下排空法(装置⑤),不能用向上排空气法(装置④)或排水法(装置③)收集,装置组合正确的是①⑤,只有B项正确。
答案:B
19.t ℃时,反应:N2+3H22NH3在容积固定的密闭容器中进行,达到平衡状态的标志是( )
A.N2和H2完全转化为NH3
B.NH3的物质的量浓度不再发生变化
C.单位时间内消耗n mol N2的同时生成2n mol NH3
D.v(NH3)=v(N2)
解析:合成氨的反应属于可逆反应,N2和H2不能完全转化为NH3,故A项不符合题意;NH3的物质的量浓度不再发生变化,反应达到平衡状态,故B项符合题意;单位时间内消耗n mol N2的同时生成2n mol NH3都代表的是正反应方向的速率,未体现正、逆反应速率的关系,故不能代表反应达到平衡状态,故C项不符合题意;根据化学反应速率之比等于化学计量数之比,v(NH3)=2v(N2),v(NH3)和v(N2)不相等,未体现正、逆反应速率的关系,也不能代表化学反应达到平衡状态,故D项不符合题意。
答案:B
20.中学化学实验可用如图所示的装置制取乙酸乙酯,下列说法正确的是( )
A.反应混合液的加入顺序依次为浓硫酸、乙醇、冰乙酸
B.浓硫酸不仅可以增大该反应的速率,还能提高该反应的产率
C.右侧长导管起到了冷凝回流的作用
D.饱和碳酸钠溶液可用氢氧化钠溶液代替
解析:为了防止混合液体溅出,发生危险,反应混合液的加入顺序依次为乙醇、浓硫酸、冰乙酸,A项错误;浓硫酸在反应中起催化作用,增大该反应的速率,同时能吸收生成的水,使平衡正向移动,提高该反应的产率,B项正确;右侧长导管起到了冷凝的作用,不能回流,C项错误;用氢氧化钠溶液能将生成的乙酸乙酯水解,降低了乙酸乙酯的产率,所以饱和碳酸钠溶液不可用氢氧化钠溶液代替,D项错误。
答案:B
第二部分 非选择题
二、非选择题:本大题包括3小题,共40分。
21.(13分)下表为元素周期表的一部分,请回答有关问题:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2
①
②
3
③ ④ ⑤
⑥ ⑦ ⑧
4 ⑨
(1)⑤和⑧的元素符号是________和________。
(2)此表中最活泼的金属是________(填元素符号,下同),非金属性最强的元素是________。
(3)在③~⑦元素中,原子半径最大的是________(填元素符号)。
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与⑥最高价氧化物的水化物反应的化学方程式:______。
解析:由表知①②③④⑤⑥⑦⑧⑨对应的元素分别为N、F、Mg、Al、Si、S、Cl、Ar、K。根据元素周期律,原子半径:同周期由左向右逐渐减小,金属性逐渐减弱,非金属性逐渐增强,同主族由上到下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,题图中最活泼的金属是K,非金属性最强的元素是F。(4)能形成两性氢氧化物的元素是Al,2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O。
答案:(1)Si Ar (2)K F (3)Mg (4)Al 2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
22.(13分)在实验室中用二氧化锰跟浓盐酸反应制备并收集干燥纯净的氯气。进行此实验,所用仪器如图:
(1)上述仪器正确的连接顺序是________接________,________接________,________接__________,__________接________。(填各接口处的字母)
(2)发生装置中发生的化学反应方程式为_________________。
(3)回答下列物质在装置中的作用。
①饱和食盐水的作用是________________________________。
②浓硫酸的作用是____________________________________。
(4)写出烧杯中发生反应的化学方程式:_________________。
解析:实验室制干燥氯气,氯气密度比空气大且易溶于水,故用向上排空气法收集,需要用氢氧化钠溶液吸收尾气,浓硫酸用于干燥气体,饱和食盐水用于除杂吸收挥发出的氯化氢气体。
(1)根据上述分析可知,制得的氯气中含有水蒸气和氯化氢,分别用饱和食盐水、浓硫酸来除去,采用向上排空气法进行收集,最后进行尾气的处理,所以仪器正确的连接顺序是(填各接口处的字母):E接C,D接A,B接H,G接F。(2)发生装置中发生的化学反应方程式MnO2+4HCl(浓)===MnCl2+Cl2+2H2O。(3)在装置中:①饱和食盐水的作用是除去Cl2中的HCl气体;②浓硫酸的作用是除去Cl2中的H2O蒸气。(4)烧杯中发生反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O。
答案:(1)E C D A B H G F
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)①除去Cl2中的HCl气体 ②除去Cl2中的H2O蒸气
(4)Cl2+2NaOH===NaCl+NaClO+H2O
23.(14分)已知A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图1所示(已知:R—CHOR—COOH):
图1
请回答下列问题:
(1)决定B、D化学性质的原子团的名称分别是________、________。
(2)在反应①~⑥中,属于加成反应的是________(填序号,下同),属于取代反应的是________。
(3)B和D进行缓慢,增大该反应速率的主要方法是________________________________________,用于鉴别B、D和甲的一种试剂是____________。
(4)写出下列反应的化学方程式。
②__________________________________________________;
④__________________________________________________;
⑥________________________________________________。
(5)某化学兴趣小组设计有机物B氧化的实验装置如图2所示,图中加热器、铁架台、铁夹等均未画出。
图2
已知醛与新制Cu(OH)2悬浊液的反应与葡萄糖相似。
①加热e处固体的目的是__________________________,d处碱石灰的作用是________________________________,g处导管倾斜的作用是________________________________。
②为使a中的B平稳气化成蒸气,可采用的加热方法是_____。
③能证明B反应后的实验现象是________________________。
答案:(1)羟基 羧基
(2)①⑥ ④⑤
(3)加入浓硫酸作催化剂、加热、增加乙醇和乙酸浓度 饱和Na2CO3溶液
(4)2CH3CH2OH+O22CH3CHO+2H2O CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
nCH2===CH2
(5)①制取O2 防止f处的水蒸气进入C处的无水硫酸铜发生反应而干扰实验结果 冷凝回流乙醇 ②将试管a放入78.5 ℃或稍高于78.5 ℃的热水浴中 ③c处无水硫酸铜粉末变成蓝色晶体,取下试管f在酒精灯上加热,观察到有砖红色沉淀生成
同课章节目录
