化学选修5第三章第一节_醇_酚
文档属性
| 名称 | 化学选修5第三章第一节_醇_酚 | 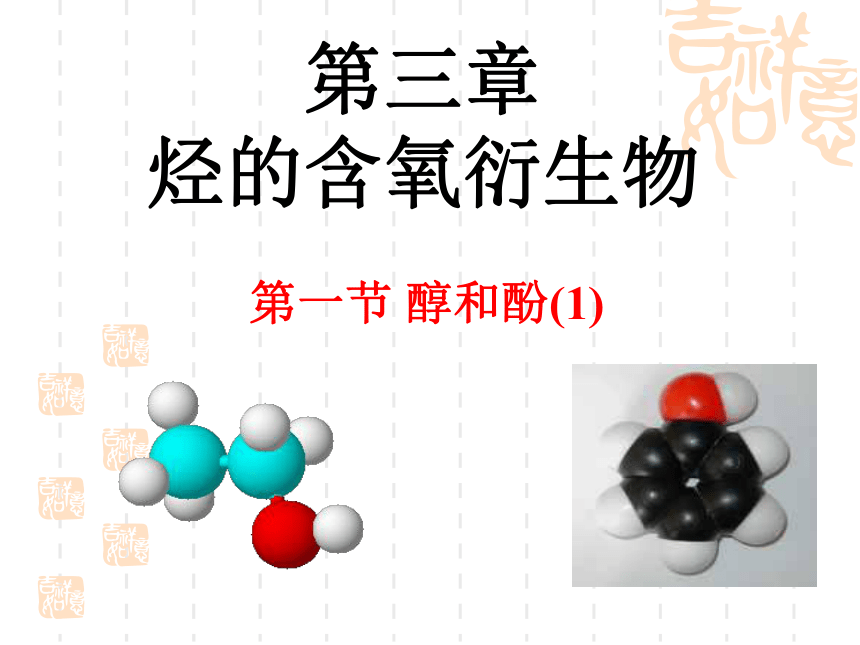 | |
| 格式 | zip | ||
| 文件大小 | 947.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-05 19:41:56 | ||
图片预览





文档简介
(共45张PPT)
第三章 烃的含氧衍生物
第一节 醇和酚(1)
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
归纳总结
羟基(—OH)与苯环直接相连的化合物称为酚。
OH
CH3
OH
CH3CHCH3
OH
CH3CH2OH
乙醇
2—丙醇
苯酚
邻甲基苯酚
CH2OH
苯甲醇
1)根据所含羟基的数目
一元醇:只含一个羟基
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
二元醇:含两个羟基
多元醇:多个羟基
一、醇
1.分类
2)根据羟基所连烃基的种类
2、命名
(2)编号
(1)选主链
(3)写名称
选含—OH的最长碳链为主链,称某醇
从离—OH最近的一端起编
取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。)
CH3—CH—CH2—CH2—OH
CH3
3—甲基—1—丁醇
CH3—CH2—CH—CH3
OH
2—丁醇
CH3—CH—C—OH
CH3
CH2—CH3
CH3
2,3—二甲基—3—戊醇
CH2OH
苯甲醇
CH2OH
CH2OH
乙二醇
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或丙三醇、甘油)
3、醇的同分异构体的类型
(1)碳链异构、
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构
4、同系物物理性质的比较
相对分子质量
沸点/℃
表3-1图
0
50
100
-50
-100
30
40
50
60
表3-2图
羟基数
沸点/℃
0
150
200
100
50
1
2
3
●
●
●
●
●
●
●
●
●
●
●
醇
烷
乙醇
丙醇
醇的沸点远高于烷烃。
醇羟基越多沸点越高。
氢键
乙二醇
1,2-丙二醇
丙三醇
氢键数目增多
随碳原子(羟基)的数目增多,沸点逐渐升高。
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
醇分子间形成氢键示意图:
原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。(分子间形成了氢键)
低级醇均可与水以任意比例混溶。
乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
5、常见的醇
CH3CH2OH
乙醇(一元醇)
乙醇是无色透明、有特殊香味的液体,易挥发,密度比水小,沸点比水低,能与水以任意比互溶,能溶解多种无机物和有机物。
1、乙醇的结构
从乙烷分子中的1个H原子被—OH(羟基)取代衍变成乙醇
分子式
结构式
结构简式
官能团
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
二、乙醇
⑤
④
③
②
①
那么乙醇的结构如何影响其
性质的呢
C—C—O—H
H
H
H
H
H
①
②
由于氧原子的电负
性较大,吸引电子
的能力比C和H强,
造成O-H键和C-O
键的电子对都向氧
原子偏移。反应时
O-H键和C-O键易
断裂。
(1)与金属Na的反应
2CH3CH2OH + 2Na → 2CH3CH2ONa﹢H2↑ 乙醇钠
2、乙醇的化学性质
现象:缓慢产生气泡,金属钠沉于底部或上下浮动。
产物乙醇钠在水中强烈水解
CH3CH2-ONa +H2O→CH3CH2OH +NaOH
练习:写出乙醇与K、Ca分别反应的化学方程式
(3)与HX反应
(2)酯化反应(找错误)
CH3CH2OH+CH3COOH→
CH3COOC2H5+H2O
C2H5OH + HBr C2H5Br + H2O
△
(4)氧化反应
①燃烧
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
②催化氧化
醇能发生催化氧化的条件:“本碳有氢”
③强氧化剂氧化
乙醇可被酸性高锰酸钾溶液或重铬酸钾酸性溶液氧化生成乙酸。氧化过程可分为两步:
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
乙醇能不能被其他氧化剂氧化?
结论:羟基碳上有2个氢原子的醇被氧化成酸。
羟基碳上有1个氢原子的醇被氧化成酮。
羟基碳上没有氢原子的醇不能被氧化。
CH3CH2O H+HO CH2CH3
CH3CH2OCH2CH3+H2O
浓硫酸
140℃
(5) 分子间脱水——取代反应
(6) 分子内脱水——消去反应
醇能发生消去反应的条件:
与-OH相连的碳原子相邻的碳原子有氢原子。
制乙烯实验装置
为何使液体温度迅速升到170℃,不能过高或过低?
酒精与浓硫酸混合液如何配置
放入几片碎瓷片作用是什么?
为何要用排水集气法收集 ?
浓硫酸的作用是什么?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
1、放入几片碎瓷片作用是什么?
防止暴沸
2、浓硫酸的作用是什么?
催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计感温泡要置于反应物的
中央位置因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
CH3CH2OH
CH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液、加热
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸、加热到170℃
学与问:
溴乙烷与乙醇都能发生消去反应,它们有什么异同?
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应
消去反应
催化氧化
①
CH3CH2-OH
CH3CHO
CH3COOH
[O]
[O]
CH3CH2-ONa
CH3CH2-Br
CH2=CH2
CH3CH2-O-CH2CH3
乙醇的化学性质小结
Na
H2O
HBr
NaOH水溶液
浓H2SO4
170℃
浓H2SO4
140℃
CH3C-O-CH2CH3
O
醇的化学性质——与乙醇相似
NaOH醇溶液
H2O
HBr
第三章 烃的含氧衍生物
第一节 醇和酚(2)
酚:羟基与苯环上碳原子直接相连的化合物
最简单的酚是苯酚
三、酚
1、苯酚的分子组成与结构
OH
结构式:
分子式:
结构简式:
C6H5OH
或
(球棍模型)
(比例模型)
O H
C
C H
H C
C
H
H C
C H
OH
,
C6H6O
性质探究
实验一:
说明苯酚在水中的溶解度受温度的影响:
苯酚
浑浊 澄清 浑浊
常温时,溶解度不大,温度升高,溶解度增大。当高于65℃时,则能与水互溶。
(1)纯净的苯酚是无色的晶体,具有特殊的气味。
(2)熔点是43℃ 。
(3)室温下,苯酚在水中溶解度9.3克,当温度高于65℃时,能跟水混溶。苯酚易溶于乙醇,乙醚等有机溶剂。
(4)苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性,使用时要小心!
露置在空气中因小部分发生氧化而显粉红色。
如不慎沾到皮肤上,应立即用酒精洗涤。
2、苯酚的物理性质
(5)苯酚的稀溶液可以直接用来作为防腐剂和消毒剂,如日常所用的药皂中掺入了少量苯酚。
实验二:
性质探究
紫色石蕊试液
苯酚浊溶液
无明显现象,能说明苯酚没有酸性吗?
性质探究
实验三:
苯酚浊溶液
NaOH溶液
说明:苯酚有酸性,但酸性很弱,不能使指示剂变色。
乙醇和苯酚分子中都有—OH ,为什么乙醇不显酸性而苯酚显酸性?
苯环对—OH的影响:使酚羟基上的H比醇羟基
上的H活泼,更易电离出H+,显酸性.
—OH
+ NaOH
—ONa
+ H2O
苯酚钠
不同的烃基与羟基相连,会对羟基产生不同的影响,导致物质的化学性质产生差异。
性质探究
实验四:
澄清 浑浊
说明苯酚的酸性强弱: 盐酸>碳酸>苯酚
+ HCl
+ NaCl
—OH
—ONa
(俗名:石炭酸)
分两等份
通入CO2
ONa溶液
加HCl
2
?
+ CO2 + H2O
+ Na2CO3
—OH
—ONa
2
+ CO2 + H2O
+ NaHCO3
—OH
—ONa
+ Na2CO3
—OH
—ONa
+ NaHCO3
苯酚浊溶液
Na2CO3溶液
实验五:
性质探究
2,4,6—三溴苯酚(白色)
此反应很灵敏,常用于苯酚的定性检验和定量测定。
Br
Br
—OH
+ Br2
—OH
↓
Br
+ 3HBr
3
溴水过量
实验六:
苯酚稀溶液
浓溴水
苯和苯酚都能和溴反应,有何不同?
酚羟基对苯环的影响:使苯环—OH邻、对位上的
氢原子变得活泼,易被取代.
苯酚 苯
反应物
反应条件
产物
取代苯环上
氢原子数
浓溴水与苯酚
液溴与苯
不用催化剂
需催化剂
一次取代苯环上三个氢原子
一次取代苯环上一个氢原子
性质探究
实验七:
苯酚遇FeCl3溶液变紫色,可用于二者的互检.
苯酚稀溶液
---苯环对羟基的影响,使电离变容易
(1)苯酚的弱酸性
3、苯酚的化学性质
(石炭酸)
+ Na2CO3
—OH
—ONa
+ NaHCO3
—ONa
+ HCl
—OH
+ NaCl
—ONa
+ CO2 + H2O
—OH
+ NaHCO3
苯酚的酸性比碳酸的还弱,但比HCO3-强。
(2)苯环上的取代反应
Br
Br
—OH
+ Br2
—OH ↓
Br
+ 3HBr
3
---羟基对苯环的影响,使苯环性质活泼
3、苯酚的化学性质
(3)显色反应
---遇FeCl3显紫色
(4)易被氧化
---与O2等氧化剂反应
(5)加成反应
---与H2加成
3、苯酚的化学性质
+Fe3+
OH
6
[Fe(C6H5O)6]3-
+6H+
(紫色)
OH
=O
=
O
苯酚可使酸性高锰酸钾溶液褪色
在与醇相似的条件下,苯酚不能发生酯化反应、消去反应。
注意:
苯酚的用途:
化工原料,制酚醛树脂、医药、染料等,稀溶液用作防腐剂和消毒剂
小结:
1、下列物质中: (A) (B)
(C) (D)
能与氢氧化钠溶液发生反应的是( )
能与金属钠发生反应的是( )
能与氢气发生加成反应的是( )
—CH2OH
—OH
CH3
—OH
B、D
A、B、D
A、B、C 、 D
2、用哪种试剂,可以把苯酚、苯、乙醇、 NaOH、KSCN五种物质鉴别开来?现象分别如何?
FeCl3溶液
物质 苯酚 苯 乙醇 NaOH KSCN
现象 紫色溶液 分层 无明显
现象 现象 红褐色沉淀 血红色溶液
思 考
1.如何除去苯中的苯酚
2.如何分离苯和苯酚
[参考答案]
1、加入NaOH溶液,振荡后分液,上层即为苯。
2、加入NaOH溶液→分液(上层为苯)→在苯酚钠溶液
中通入CO2→分液,得到苯酚。
第三章 烃的含氧衍生物
第一节 醇和酚(1)
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
归纳总结
羟基(—OH)与苯环直接相连的化合物称为酚。
OH
CH3
OH
CH3CHCH3
OH
CH3CH2OH
乙醇
2—丙醇
苯酚
邻甲基苯酚
CH2OH
苯甲醇
1)根据所含羟基的数目
一元醇:只含一个羟基
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
二元醇:含两个羟基
多元醇:多个羟基
一、醇
1.分类
2)根据羟基所连烃基的种类
2、命名
(2)编号
(1)选主链
(3)写名称
选含—OH的最长碳链为主链,称某醇
从离—OH最近的一端起编
取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。)
CH3—CH—CH2—CH2—OH
CH3
3—甲基—1—丁醇
CH3—CH2—CH—CH3
OH
2—丁醇
CH3—CH—C—OH
CH3
CH2—CH3
CH3
2,3—二甲基—3—戊醇
CH2OH
苯甲醇
CH2OH
CH2OH
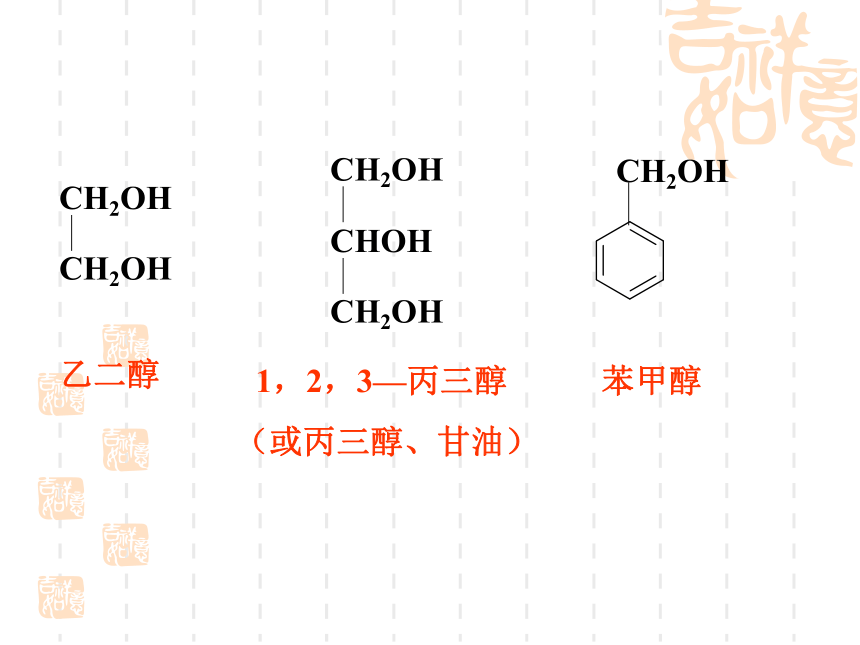
乙二醇
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或丙三醇、甘油)
3、醇的同分异构体的类型
(1)碳链异构、
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构
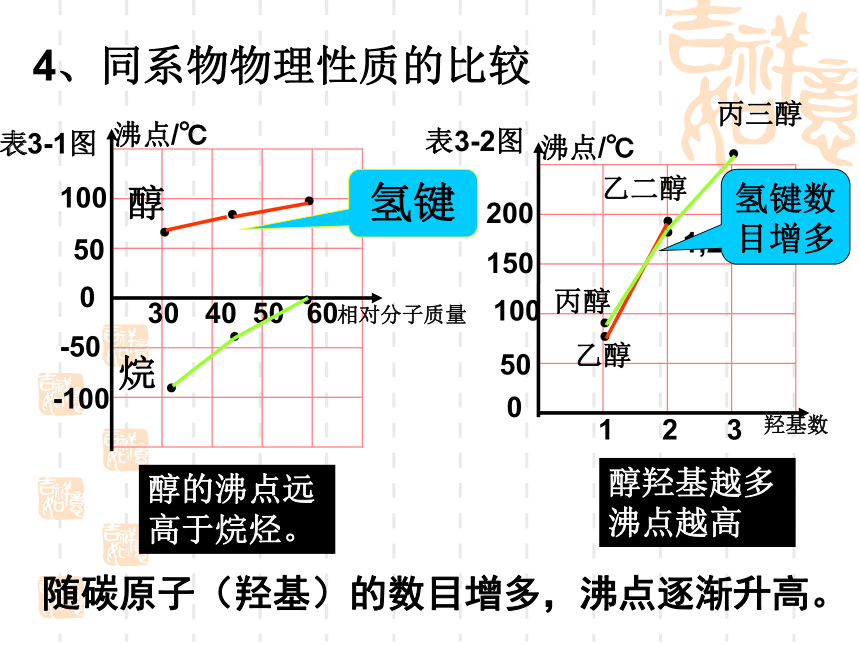
4、同系物物理性质的比较
相对分子质量
沸点/℃
表3-1图
0
50
100
-50
-100
30
40
50
60
表3-2图
羟基数
沸点/℃
0
150
200
100
50
1
2
3
●
●
●
●
●
●
●
●
●
●
●
醇
烷
乙醇
丙醇
醇的沸点远高于烷烃。
醇羟基越多沸点越高。
氢键
乙二醇
1,2-丙二醇
丙三醇
氢键数目增多
随碳原子(羟基)的数目增多,沸点逐渐升高。
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
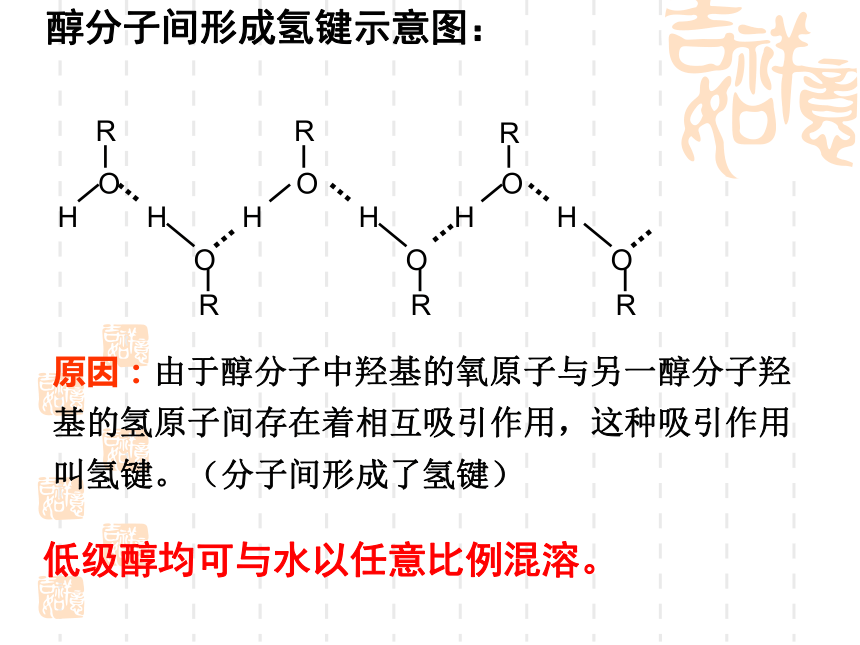
醇分子间形成氢键示意图:
原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。(分子间形成了氢键)
低级醇均可与水以任意比例混溶。
乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
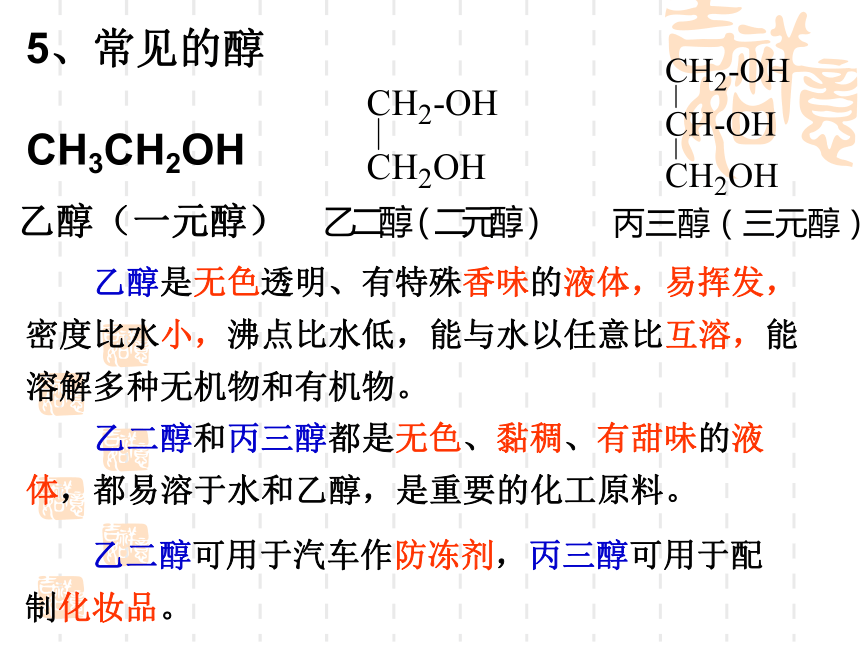
5、常见的醇
CH3CH2OH
乙醇(一元醇)
乙醇是无色透明、有特殊香味的液体,易挥发,密度比水小,沸点比水低,能与水以任意比互溶,能溶解多种无机物和有机物。
1、乙醇的结构
从乙烷分子中的1个H原子被—OH(羟基)取代衍变成乙醇
分子式
结构式
结构简式
官能团
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
二、乙醇
⑤
④
③
②
①
那么乙醇的结构如何影响其
性质的呢
C—C—O—H
H
H
H
H
H
①
②
由于氧原子的电负
性较大,吸引电子
的能力比C和H强,
造成O-H键和C-O
键的电子对都向氧
原子偏移。反应时
O-H键和C-O键易
断裂。
(1)与金属Na的反应
2CH3CH2OH + 2Na → 2CH3CH2ONa﹢H2↑ 乙醇钠
2、乙醇的化学性质
现象:缓慢产生气泡,金属钠沉于底部或上下浮动。
产物乙醇钠在水中强烈水解
CH3CH2-ONa +H2O→CH3CH2OH +NaOH
练习:写出乙醇与K、Ca分别反应的化学方程式
(3)与HX反应
(2)酯化反应(找错误)
CH3CH2OH+CH3COOH→
CH3COOC2H5+H2O
C2H5OH + HBr C2H5Br + H2O
△
(4)氧化反应
①燃烧
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
②催化氧化
醇能发生催化氧化的条件:“本碳有氢”
③强氧化剂氧化
乙醇可被酸性高锰酸钾溶液或重铬酸钾酸性溶液氧化生成乙酸。氧化过程可分为两步:
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
乙醇能不能被其他氧化剂氧化?
结论:羟基碳上有2个氢原子的醇被氧化成酸。
羟基碳上有1个氢原子的醇被氧化成酮。
羟基碳上没有氢原子的醇不能被氧化。
CH3CH2O H+HO CH2CH3
CH3CH2OCH2CH3+H2O
浓硫酸
140℃
(5) 分子间脱水——取代反应
(6) 分子内脱水——消去反应
醇能发生消去反应的条件:
与-OH相连的碳原子相邻的碳原子有氢原子。
制乙烯实验装置
为何使液体温度迅速升到170℃,不能过高或过低?
酒精与浓硫酸混合液如何配置
放入几片碎瓷片作用是什么?
为何要用排水集气法收集 ?
浓硫酸的作用是什么?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
1、放入几片碎瓷片作用是什么?
防止暴沸
2、浓硫酸的作用是什么?
催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计感温泡要置于反应物的
中央位置因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
CH3CH2OH
CH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液、加热
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸、加热到170℃
学与问:
溴乙烷与乙醇都能发生消去反应,它们有什么异同?
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应
消去反应
催化氧化
①
CH3CH2-OH
CH3CHO
CH3COOH
[O]
[O]
CH3CH2-ONa
CH3CH2-Br
CH2=CH2
CH3CH2-O-CH2CH3
乙醇的化学性质小结
Na
H2O
HBr
NaOH水溶液
浓H2SO4
170℃
浓H2SO4
140℃
CH3C-O-CH2CH3
O
醇的化学性质——与乙醇相似
NaOH醇溶液
H2O
HBr
第三章 烃的含氧衍生物
第一节 醇和酚(2)
酚:羟基与苯环上碳原子直接相连的化合物
最简单的酚是苯酚
三、酚
1、苯酚的分子组成与结构
OH
结构式:
分子式:
结构简式:
C6H5OH
或
(球棍模型)
(比例模型)
O H
C
C H
H C
C
H
H C
C H
OH
,
C6H6O
性质探究
实验一:
说明苯酚在水中的溶解度受温度的影响:
苯酚
浑浊 澄清 浑浊
常温时,溶解度不大,温度升高,溶解度增大。当高于65℃时,则能与水互溶。
(1)纯净的苯酚是无色的晶体,具有特殊的气味。
(2)熔点是43℃ 。
(3)室温下,苯酚在水中溶解度9.3克,当温度高于65℃时,能跟水混溶。苯酚易溶于乙醇,乙醚等有机溶剂。
(4)苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性,使用时要小心!
露置在空气中因小部分发生氧化而显粉红色。
如不慎沾到皮肤上,应立即用酒精洗涤。
2、苯酚的物理性质
(5)苯酚的稀溶液可以直接用来作为防腐剂和消毒剂,如日常所用的药皂中掺入了少量苯酚。
实验二:
性质探究
紫色石蕊试液
苯酚浊溶液
无明显现象,能说明苯酚没有酸性吗?
性质探究
实验三:
苯酚浊溶液
NaOH溶液
说明:苯酚有酸性,但酸性很弱,不能使指示剂变色。
乙醇和苯酚分子中都有—OH ,为什么乙醇不显酸性而苯酚显酸性?
苯环对—OH的影响:使酚羟基上的H比醇羟基
上的H活泼,更易电离出H+,显酸性.
—OH
+ NaOH
—ONa
+ H2O
苯酚钠
不同的烃基与羟基相连,会对羟基产生不同的影响,导致物质的化学性质产生差异。
性质探究
实验四:
澄清 浑浊
说明苯酚的酸性强弱: 盐酸>碳酸>苯酚
+ HCl
+ NaCl
—OH
—ONa
(俗名:石炭酸)
分两等份
通入CO2
ONa溶液
加HCl
2
?
+ CO2 + H2O
+ Na2CO3
—OH
—ONa
2
+ CO2 + H2O
+ NaHCO3
—OH
—ONa
+ Na2CO3
—OH
—ONa
+ NaHCO3
苯酚浊溶液
Na2CO3溶液
实验五:
性质探究
2,4,6—三溴苯酚(白色)
此反应很灵敏,常用于苯酚的定性检验和定量测定。
Br
Br
—OH
+ Br2
—OH
↓
Br
+ 3HBr
3
溴水过量
实验六:
苯酚稀溶液
浓溴水
苯和苯酚都能和溴反应,有何不同?
酚羟基对苯环的影响:使苯环—OH邻、对位上的
氢原子变得活泼,易被取代.
苯酚 苯
反应物
反应条件
产物
取代苯环上
氢原子数
浓溴水与苯酚
液溴与苯
不用催化剂
需催化剂
一次取代苯环上三个氢原子
一次取代苯环上一个氢原子
性质探究
实验七:
苯酚遇FeCl3溶液变紫色,可用于二者的互检.
苯酚稀溶液
---苯环对羟基的影响,使电离变容易
(1)苯酚的弱酸性
3、苯酚的化学性质
(石炭酸)
+ Na2CO3
—OH
—ONa
+ NaHCO3
—ONa
+ HCl
—OH
+ NaCl
—ONa
+ CO2 + H2O
—OH
+ NaHCO3
苯酚的酸性比碳酸的还弱,但比HCO3-强。
(2)苯环上的取代反应
Br
Br
—OH
+ Br2
—OH ↓
Br
+ 3HBr
3
---羟基对苯环的影响,使苯环性质活泼
3、苯酚的化学性质
(3)显色反应
---遇FeCl3显紫色
(4)易被氧化
---与O2等氧化剂反应
(5)加成反应
---与H2加成
3、苯酚的化学性质
+Fe3+
OH
6
[Fe(C6H5O)6]3-
+6H+
(紫色)
OH
=O
=
O
苯酚可使酸性高锰酸钾溶液褪色
在与醇相似的条件下,苯酚不能发生酯化反应、消去反应。
注意:
苯酚的用途:
化工原料,制酚醛树脂、医药、染料等,稀溶液用作防腐剂和消毒剂
小结:
1、下列物质中: (A) (B)
(C) (D)
能与氢氧化钠溶液发生反应的是( )
能与金属钠发生反应的是( )
能与氢气发生加成反应的是( )
—CH2OH
—OH
CH3
—OH
B、D
A、B、D
A、B、C 、 D
2、用哪种试剂,可以把苯酚、苯、乙醇、 NaOH、KSCN五种物质鉴别开来?现象分别如何?
FeCl3溶液
物质 苯酚 苯 乙醇 NaOH KSCN
现象 紫色溶液 分层 无明显
现象 现象 红褐色沉淀 血红色溶液
思 考
1.如何除去苯中的苯酚
2.如何分离苯和苯酚
[参考答案]
1、加入NaOH溶液,振荡后分液,上层即为苯。
2、加入NaOH溶液→分液(上层为苯)→在苯酚钠溶液
中通入CO2→分液,得到苯酚。
