2020-2021学年高中化学新人教版选择性必修1 第3章实验活动3 盐类水解的应用课件(14张)
文档属性
| 名称 | 2020-2021学年高中化学新人教版选择性必修1 第3章实验活动3 盐类水解的应用课件(14张) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 15:22:35 | ||
图片预览






文档简介
人教(2019)版 选择性必修一
第三章 水溶液中的离子反应与平衡
实验活动3 盐类水解的应用
实验活动3 盐类水解的应用
【实验目的】
1.加深对盐类水解原理的认识。
2.了解盐类水解的广泛应用,体会化学的价值。
【实验用品】
试管、试管夹、试管架、胶头滴管、烧杯、药匙、量筒、铁架台(带铁圈)、石棉网(或陶土网)、酒精灯、火柴。
蒸馏水、FeCl3晶体、浓盐酸、饱和Na2CO3溶液、饱和FeCl3溶液、1 mol·L-1 Al2(SO4)3溶液、泥土、植物油。
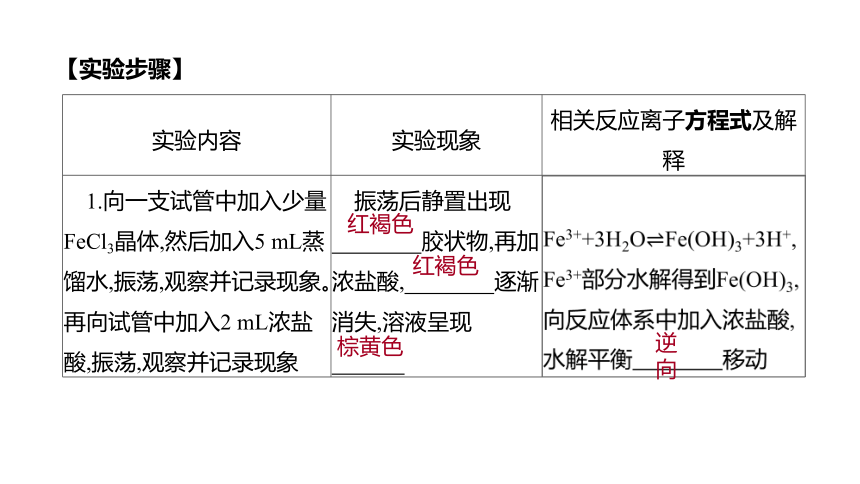
【实验步骤】
实验内容
实验现象
相关反应离子方程式及解释
1.向一支试管中加入少量FeCl3晶体,然后加入5 mL蒸馏水,振荡,观察并记录现象。再向试管中加入2 mL浓盐酸,振荡,观察并记录现象
振荡后静置出现
胶状物,再加浓盐酸, 逐渐消失,溶液呈现
?
红褐色
红褐色
棕黄色
逆向
实验内容
实验现象
相关反应离子方程式及解释
2.向三支试管中分别加入5 mL混有少量泥土的浑浊水,然后向其中的两支试管中分别加入2 mL饱和FeCl3溶液、2 mL 1 mol·L-1 Al2(SO4)3溶液,振荡。把三支试管放在试管架上,静置5 min,观察并记录现象,同时进行比较
加入饱和FeCl3溶液、
2 mL 1 mol·L-1 Al2(SO4)3溶液的两支试管中逐渐由浑浊变 ?
澄清
吸附
实验内容
实验现象
相关反应离子方程式及解释
3.向一个烧杯中加入40 mL蒸馏水。加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和FeCl3溶液。继续煮沸至液体呈红褐色,停止加热,观察制得的Fe(OH)3胶体
实验3中发生反应Fe3++
3H2O=Fe(OH)3(胶体)+3H+,水解为 过程,加热煮沸制得Fe(OH)3胶体?
吸热
实验内容
实验现象
相关反应离子方程式及解释
4.向两支试管中分别加入5 mL饱和Na2CO3溶液,然后各滴入2~3滴植物油,振荡。将其中的一支试管加热煮沸一会儿,然后再振荡。把两支试管中的液体倒掉,并用水冲洗试管,比较两支试管的内壁哪支更干净
经过
的试管内壁更干净?
加热煮沸
正向
【问题和讨论】
根据实验结果,说明实验室中应该如何配制FeCl3溶液。
提示:把FeCl3固体溶解于浓盐酸,再加水稀释到所需浓度。
【实验评价】
1.(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,调节pH=4过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)
。?
CuO或Cu(OH)2或Cu(OH)2CO3
CuCl2·2H2O Cu(OH)Cl+HCl+H2O
[解析]为得到纯净的CuCl2·2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素的难溶化合物,可以是氧化铜或氢氧化铜或碱式碳酸铜;在空气中直接加热CuCl2·2H2O晶体,氯化铜水解生成碱式氯化铜;
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是
。?
在氯化氢气流中加热
[解析]由于CuCl2在加热过程中水解,水解生成的HCl挥发而脱离体系,造成水解完全,得到碱式氯化铜或氢氧化铜,而不是CuCl2,若要制得无水CuCl2,应在干燥的HCl气流中加热CuCl2·2H2O晶体,防止CuCl2在加热过程中水解。
2.10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃
10
20
30
加热煮沸后冷却到50 ℃
pH
8.3
8.4
8.5
8.8
甲同学认为,该溶液的pH升高的原因是HCO3?水解程度增大,故碱性增强,该反应的离子方程式为 。?
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。?
?
HCO3?+H2O?H2CO3+OH-
?
大于
[解析] 甲、乙两同学对碳酸氢钠溶液受热后碱性增强的原因进行了猜测,其中甲认为温度升高,促进碳酸氢钠水解,导致溶液碱性增强,而乙认为碳酸氢钠受热发生分解产生了碳酸钠,而由于碳酸钠的水解程度大于碳酸氢钠的水解程度,使溶液碱性增强。若要证明甲、乙的结论,则证明CO32?是否存在即可。若CO32?存在则说明乙对,若CO32?不存在,则说明甲对。以此解题。甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,其发生水解的方程式为HCO3?+H2O?H2CO3+OH-;
?
乙:碳酸钠是强碱弱酸盐能水解,其水解的方程式分两步,分别为:CO32?+H2O?HCO3?+OH-、HCO3?+H2O?H2CO3+OH-。由于碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度。丙:若要证明甲、乙的结论,则证明CO32?是否存在即可。若CO32?存在则说明乙对,若CO32?不存在,则说明甲对。
?
丙认为:(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(填“甲”或“乙”)判断正确。试剂X是 。?
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
乙
B
[解析]碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡:Na2CO3+BaCl2=BaCO3↓+2NaCl,因此向加热煮沸后的溶液中加入BaCl2溶液,就可鉴别是否存在CO32?。氢氧化钡或氢氧化钙与碳酸钠或碳酸氢钠溶液都生成白色沉淀,无法证明CO32?是否存在。AlCl3溶液与碳酸钠溶液或碳酸氢钠溶液均会发生双水解反应产生白色沉淀和气体,因此也无法证明CO32?是否存在;
?
(2)查阅资料发现NaHCO3的分解温度为150 ℃,丙断言 (填“甲”或“乙”)的判断是错误的,理由是
。?
乙
常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃
[解析]碳酸氢钠的分解温度是150 ℃,常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃,所以碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,由此判断乙是错误的。
https://www.21cnjy.com/help/help_extract.php
第三章 水溶液中的离子反应与平衡
实验活动3 盐类水解的应用
实验活动3 盐类水解的应用
【实验目的】
1.加深对盐类水解原理的认识。
2.了解盐类水解的广泛应用,体会化学的价值。
【实验用品】
试管、试管夹、试管架、胶头滴管、烧杯、药匙、量筒、铁架台(带铁圈)、石棉网(或陶土网)、酒精灯、火柴。
蒸馏水、FeCl3晶体、浓盐酸、饱和Na2CO3溶液、饱和FeCl3溶液、1 mol·L-1 Al2(SO4)3溶液、泥土、植物油。
【实验步骤】
实验内容
实验现象
相关反应离子方程式及解释
1.向一支试管中加入少量FeCl3晶体,然后加入5 mL蒸馏水,振荡,观察并记录现象。再向试管中加入2 mL浓盐酸,振荡,观察并记录现象
振荡后静置出现
胶状物,再加浓盐酸, 逐渐消失,溶液呈现
?
红褐色
红褐色
棕黄色
逆向
实验内容
实验现象
相关反应离子方程式及解释
2.向三支试管中分别加入5 mL混有少量泥土的浑浊水,然后向其中的两支试管中分别加入2 mL饱和FeCl3溶液、2 mL 1 mol·L-1 Al2(SO4)3溶液,振荡。把三支试管放在试管架上,静置5 min,观察并记录现象,同时进行比较
加入饱和FeCl3溶液、
2 mL 1 mol·L-1 Al2(SO4)3溶液的两支试管中逐渐由浑浊变 ?
澄清
吸附
实验内容
实验现象
相关反应离子方程式及解释
3.向一个烧杯中加入40 mL蒸馏水。加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和FeCl3溶液。继续煮沸至液体呈红褐色,停止加热,观察制得的Fe(OH)3胶体
实验3中发生反应Fe3++
3H2O=Fe(OH)3(胶体)+3H+,水解为 过程,加热煮沸制得Fe(OH)3胶体?
吸热
实验内容
实验现象
相关反应离子方程式及解释
4.向两支试管中分别加入5 mL饱和Na2CO3溶液,然后各滴入2~3滴植物油,振荡。将其中的一支试管加热煮沸一会儿,然后再振荡。把两支试管中的液体倒掉,并用水冲洗试管,比较两支试管的内壁哪支更干净
经过
的试管内壁更干净?
加热煮沸
正向
【问题和讨论】
根据实验结果,说明实验室中应该如何配制FeCl3溶液。
提示:把FeCl3固体溶解于浓盐酸,再加水稀释到所需浓度。
【实验评价】
1.(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,调节pH=4过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)
。?
CuO或Cu(OH)2或Cu(OH)2CO3
CuCl2·2H2O Cu(OH)Cl+HCl+H2O
[解析]为得到纯净的CuCl2·2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素的难溶化合物,可以是氧化铜或氢氧化铜或碱式碳酸铜;在空气中直接加热CuCl2·2H2O晶体,氯化铜水解生成碱式氯化铜;
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是
。?
在氯化氢气流中加热
[解析]由于CuCl2在加热过程中水解,水解生成的HCl挥发而脱离体系,造成水解完全,得到碱式氯化铜或氢氧化铜,而不是CuCl2,若要制得无水CuCl2,应在干燥的HCl气流中加热CuCl2·2H2O晶体,防止CuCl2在加热过程中水解。
2.10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃
10
20
30
加热煮沸后冷却到50 ℃
pH
8.3
8.4
8.5
8.8
甲同学认为,该溶液的pH升高的原因是HCO3?水解程度增大,故碱性增强,该反应的离子方程式为 。?
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。?
?
HCO3?+H2O?H2CO3+OH-
?
大于
[解析] 甲、乙两同学对碳酸氢钠溶液受热后碱性增强的原因进行了猜测,其中甲认为温度升高,促进碳酸氢钠水解,导致溶液碱性增强,而乙认为碳酸氢钠受热发生分解产生了碳酸钠,而由于碳酸钠的水解程度大于碳酸氢钠的水解程度,使溶液碱性增强。若要证明甲、乙的结论,则证明CO32?是否存在即可。若CO32?存在则说明乙对,若CO32?不存在,则说明甲对。以此解题。甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,其发生水解的方程式为HCO3?+H2O?H2CO3+OH-;
?
乙:碳酸钠是强碱弱酸盐能水解,其水解的方程式分两步,分别为:CO32?+H2O?HCO3?+OH-、HCO3?+H2O?H2CO3+OH-。由于碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度。丙:若要证明甲、乙的结论,则证明CO32?是否存在即可。若CO32?存在则说明乙对,若CO32?不存在,则说明甲对。
?
丙认为:(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(填“甲”或“乙”)判断正确。试剂X是 。?
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
乙
B
[解析]碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡:Na2CO3+BaCl2=BaCO3↓+2NaCl,因此向加热煮沸后的溶液中加入BaCl2溶液,就可鉴别是否存在CO32?。氢氧化钡或氢氧化钙与碳酸钠或碳酸氢钠溶液都生成白色沉淀,无法证明CO32?是否存在。AlCl3溶液与碳酸钠溶液或碳酸氢钠溶液均会发生双水解反应产生白色沉淀和气体,因此也无法证明CO32?是否存在;
?
(2)查阅资料发现NaHCO3的分解温度为150 ℃,丙断言 (填“甲”或“乙”)的判断是错误的,理由是
。?
乙
常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃
[解析]碳酸氢钠的分解温度是150 ℃,常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃,所以碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,由此判断乙是错误的。
https://www.21cnjy.com/help/help_extract.php
