2020-2021学年高中化学新人教版选择性必修1 第一章 第二节 反应热的计算 课件(54张)
文档属性
| 名称 | 2020-2021学年高中化学新人教版选择性必修1 第一章 第二节 反应热的计算 课件(54张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 15:37:05 | ||
图片预览











文档简介
人教(2019)版 选择性必修一
第一章 化学反应的热效应
第二节 反应热的计算
第一章
化学反应的热效应
第二节 反应热的计算
学习目标
1.通过盖斯定律的学习,理解盖斯定律,并能利用盖斯定律解决简单问题。
2.通过热化学方程式、中和热、燃烧热和盖斯定律的学习,能进行反应焓变的简单计算。
核心素养
1.从宏观角度认识和掌握盖斯定律,培养宏观辨识和微观探析的能力。
2.认识化学变化的本质是既有新物质生成又伴有能量变化,并遵循盖斯定律,培养变化观念与平衡思想。
3.通过分析、推理等方法总结反应热与始态、终态的相互关系,建立认知模型,能运用模型解决有关反应热的计算。
课前素能奠基
课堂素能探究
课堂达标验收
夯基提能作业
新课情境呈现
名师博客呈现
新课情境呈现
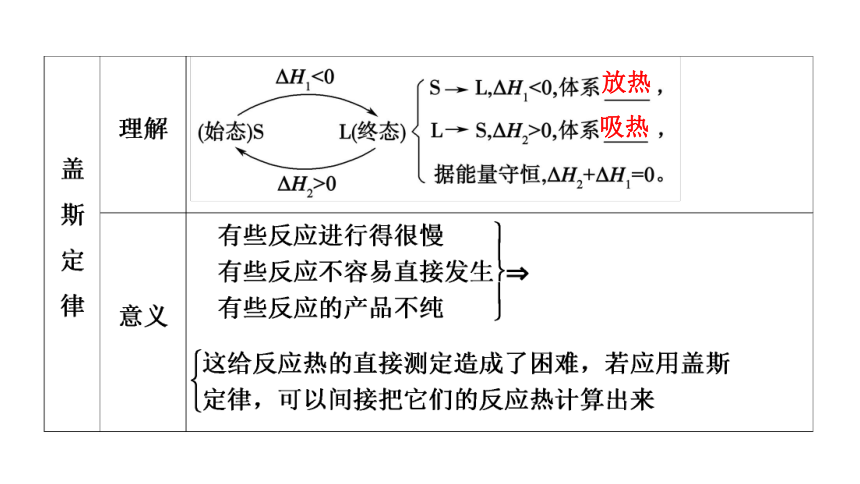
1840年,盖斯(G.H.Hess,瑞士化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。
课前素能奠基
一、盖斯定律
新知预习
盖斯定律
内容
(1)表述一:不论化学反应是一步完成还是分几步完成,其反应热_______。
(2)表述二:化学反应的反应热只与反应体系的_____________有关,而与反应的_______无关。
相同
始态和终态
途径
放热
吸热
ΔH+ΔH2
ΔH1-ΔH2=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1
1.判断正误(正确的打“√”,错误的打“×”)。
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量就越多。 ( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。
( )
(3)利用盖斯定律,可计算某些反应的反应热。 ( )
(4)任何化学反应的反应热都可以直接测定。 ( )
预习自测
×
×
√
×
×
×
2.下列关于盖斯定律的说法不正确的是 ( )
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中ΔH直接相加即可得总反应热
D
解析:盖斯定律指若一个反应可以分步进行,则各步反应吸收或放出的热量总和与这个反应一步发生时吸收或放出的热量相同,A项正确;反应物的总能量与产物的总能量决定反应热效应,所以反应热只与反应体系的始态和终态有关,而与反应的途径无关,B项正确;有些反应很慢,有的反应有副反应,其反应热通过实验测定有困难,可以用盖斯定律间接计算出来,C项正确;方程式按一定系数比加和时其反应热也按该系数比加和,D项错误。
3.物质的生成热可定义为由稳定单质生成1 mol物质所放出的热量,如CO2气体的生成热就是1 mol C完全燃烧生成CO2气体时放出的热量,已知下列几种化合物的生成热分别是
?
则1 kg葡萄糖在人体内完全氧化生成CO2气体和液态水,最多可提供的能量约为 ( )
A.3 225 kJ B.2 816 kJ
C.6 999 kJ D.15 644 kJ
D
化合物
葡萄糖
H2O(l)
CO2
生成热/kJ·mol-1
1 259.8
285.8
393.5
4.焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
①C(s)+H2O(g)══CO(g)+H2(g) ΔH1=+131.5 kJ·mol-1
②CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH2=+205.9 kJ·mol-1 试计算CH4(g)══C(s)+2H2(g)的ΔH。
解析:分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应:CH4(g)══C(s)+2H2(g)即:
CO(g)+H2(g)══C(s)+H2O(g) ΔH3=-ΔH1=-131.5 kJ·mol-1
CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH2=+205.96 kJ·mol-1
CH4(g)══C(s)+2H2(g) ΔH=?
根据盖斯定律:
ΔH=ΔH3+ΔH2=ΔH2-ΔH1=+205.9 kJ·mol-1-131.5 kJ·mol-1=+74.4 kJ·mol-1。
课堂素能探究
问题探究:1.一定量固态碳在炉膛内完全燃烧,放出热量为Q1 kJ;向炽热的炉膛内通入水蒸气会产生水煤气,水煤气完全燃烧,此过程共放出热量为Q2 kJ;若炉膛内按两种方法燃烧等质量固态碳,试讨论Q1、Q2的大小关系。
一
盖斯定律的应用
2.合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起着重要作用。贮氢合金ThNi,可催化由CO、H2合成CH4的反应。已知温度为T时:CH4(g)+2H2O(g)══CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)══CO2(g)+H2(g) ΔH=-41 kJ·mol-1。温度为T时,试写出CO、H2合成CH4的热化学方程式。
探究提示:1.根据盖斯定律,两种情况下的始态与终态相同,故放出的热量是相同的,即Q1=Q2。
2.CO(g)+3H2(g)══CH4(g)+H2O(g) ΔH=-206 kJ·mol-1
(2)加和法:
①确定待求反应的热化学方程式。
②找出待求热化学方程式中各物质出现在已知方程式中的位置(是同侧还是异侧)。
③利用同侧相加、异侧相减进行处理。
④根据待求方程式中各物质的化学计量数通过乘除来调整已知反应的化学计量数,并消去中间产物。
⑤实施叠加并确定ΔH的变化。
2.应用盖斯定律计算反应热时的注意事项:
(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数;(2)热化学方程式相加减时,同种物质之间相加减,反应热也随之相加减(带符号);(3)将一个热化学方程式颠倒时,ΔH的“+”“-”号相反,但数值不变。
典例 1
B
规律方法指导:
反应热的计算与大小比较
①寻找ΔH之间的等量关系时,应特别注意盖斯定律的应用,通过方程式的加减进行计算。
②比较ΔH大小时,应特别注意物质的状态,理清物质三态变化中能量的变化。
〔变式训练1〕已知:C2H5OH(l)══C2H5OH(g) ΔH1
6H2O+6CO2(g)══C6H12O6(g)+6O2(g) ΔH2
C6H12O6(g)══2C2H5OH(l)+2CO2(g) ΔH3
C2H5OH(g)+3O2(g)══3H2O(g)+2CO2(g) ΔH4
下列说法正确的是 ( )
A.ΔH1<ΔH4
B.ΔH3+2ΔH4+ΔH2=0
C.2ΔH1+ΔH2+ΔH3+2ΔH4=0
D.2ΔH1-ΔH2+ΔH3+2ΔH4=0
C
解析:C2H5OH(l)══C2H5OH(g)为吸热过程,ΔH1>0,A项错;题目中四个热化学过程分别为①②③④,由盖斯定律得2ΔH1=ΔH3+2ΔH2+2ΔH4 ΔH1>0,ΔH3+2ΔH4+ΔH2>0,B项错;据盖斯定律②×1+②+③得到6H2O(g)+4CO2(g)══2C2H5OH(g)+6O2(g) ΔH=2ΔH1+ΔH2+ΔH3=-2ΔH4,即2ΔH1+ΔH2+ΔH3+2ΔH4=0,C项正确,D项错,故选C。
问题探究:1.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,H—Cl键的键能为431 kJ·mol-1,则H2(g)+Cl2(g)══2HCl(g)的反应热(ΔH)等于多少?
2.等质量的红磷和白磷都完全燃烧,放出的热量是否相等?请解释原因。
二
反应热的计算与比较
探究提示:1.ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1。
2.不相等。因为等质量的红磷和白磷的能量不相同,即反应物的总能量不同而生成物的总能量相同,则放出的热量不同。
知识归纳总结:
1.反应热的计算:
计算依据
计算方法
热化学方程式
热化学方程式与数学上的方程式相似,可以左右颠倒同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数
根据盖斯定律
根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式
计算依据
计算方法
根据燃烧热
可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热
根据化学
键的变化
ΔH=反应物的化学键断裂所吸收的能量总和-生成物的化学键形成所放出的能量总和
根据反应物和生成物的总能量
ΔH=E总(生成物)-E总(反应物)
2.反应热的大小比较:
(1)同一反应生成物状态不同时。
A(g)+B(g)══C(g) ΔH1<0
A(g)+B(g)══C(l) ΔH2<0
因为C(g)══C(l) ΔH3<0,
ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。
氮是地球上含量丰富的一种元素,
氮及其化合物在工农业生产、生活中有着重要作
用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)
过程中能量的变化示意图,请写出N2(g)和H2(g)反
应的热化学方程式:
_______________________________________________。
典例 2
390
(3)用NH3催化还原NO,还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)══2N2(g)+6H2O(g)
ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)══2NO(g)
ΔH2=-b kJ·mol-1②
求:若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=_____________kJ·mol-1(用含a、b的式子表示)。
(3b-a)/4
规律方法指导:
利用键能计算ΔH的方法
ΔH=反应物的化学键断裂所吸收的能量总和-生成物的化学键形成所放出的能量总和
〔变式训练2〕《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”。火药燃烧爆炸时发生的反应为S(s)+2KNO3(s)+3C(s)══K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。已知:
①碳的燃烧热ΔH1=a kJ·mol-1
②S(s)+2K(g)══K2S(s) ΔH2=b kJ·mol-1
③2K(s)+N2(g)+3O2(g)══2KNO3(s)
ΔH3=c kJ·mol-1,则x为 ( )
A.3a+b-c B.c-3a-b
C.a-b-c D.c-a-b
A
解析:①碳燃烧的热化学方程式为:
C(s)+O2(g)══CO2(g) ΔH1=a kJ·mol-1
②S(s)+2K(g)══K2S(s) ΔH2=b kJ·mol-1
③2K(s)+N2(g)+3O2(g)══2KNO3(s) ΔH3=c kJ·mol-1
根据盖斯定律,①×3+②-③可得:
S(s)+2KNO3(s)+3C(s)══K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1=(a kJ·mol-1)×3+b kJ·mol-1-c kJ·mol-1=(3a+b-c)kJ·mol-1,故选A。
名师博客呈现
盖斯简介
盖斯,瑞士化学家,1802年8月8日生于瑞士日内瓦市一个画家家庭,三岁时随父亲定居俄国莫斯科,因而在俄国上学和工作。1825年毕业于多尔帕特大学医学系,并获得医学博士学位。1826年弃医专攻化学,并到瑞典斯德哥尔摩柏济力阿斯实验室专修化学,从此与柏济力阿斯结成了深厚的友谊。回国后到乌拉尔做地质调查和勘探工作,后又到伊尔库茨克研究矿物。1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士,旋即被聘为圣彼得堡工艺学院理论化学教授兼中央师范学院和矿业学院教授。
盖斯早年从事分析化学的研究,曾对巴库附近的矿物和天然气进行分析,作出了一定成绩,之后还曾发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。1840年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的。这就是举世闻名的盖斯定律。
B
https://www.21cnjy.com/help/help_extract.php
第一章 化学反应的热效应
第二节 反应热的计算
第一章
化学反应的热效应
第二节 反应热的计算
学习目标
1.通过盖斯定律的学习,理解盖斯定律,并能利用盖斯定律解决简单问题。
2.通过热化学方程式、中和热、燃烧热和盖斯定律的学习,能进行反应焓变的简单计算。
核心素养
1.从宏观角度认识和掌握盖斯定律,培养宏观辨识和微观探析的能力。
2.认识化学变化的本质是既有新物质生成又伴有能量变化,并遵循盖斯定律,培养变化观念与平衡思想。
3.通过分析、推理等方法总结反应热与始态、终态的相互关系,建立认知模型,能运用模型解决有关反应热的计算。
课前素能奠基
课堂素能探究
课堂达标验收
夯基提能作业
新课情境呈现
名师博客呈现
新课情境呈现
1840年,盖斯(G.H.Hess,瑞士化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。
课前素能奠基
一、盖斯定律
新知预习
盖斯定律
内容
(1)表述一:不论化学反应是一步完成还是分几步完成,其反应热_______。
(2)表述二:化学反应的反应热只与反应体系的_____________有关,而与反应的_______无关。
相同
始态和终态
途径
放热
吸热
ΔH+ΔH2
ΔH1-ΔH2=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1
1.判断正误(正确的打“√”,错误的打“×”)。
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量就越多。 ( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。
( )
(3)利用盖斯定律,可计算某些反应的反应热。 ( )
(4)任何化学反应的反应热都可以直接测定。 ( )
预习自测
×
×
√
×
×
×
2.下列关于盖斯定律的说法不正确的是 ( )
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中ΔH直接相加即可得总反应热
D
解析:盖斯定律指若一个反应可以分步进行,则各步反应吸收或放出的热量总和与这个反应一步发生时吸收或放出的热量相同,A项正确;反应物的总能量与产物的总能量决定反应热效应,所以反应热只与反应体系的始态和终态有关,而与反应的途径无关,B项正确;有些反应很慢,有的反应有副反应,其反应热通过实验测定有困难,可以用盖斯定律间接计算出来,C项正确;方程式按一定系数比加和时其反应热也按该系数比加和,D项错误。
3.物质的生成热可定义为由稳定单质生成1 mol物质所放出的热量,如CO2气体的生成热就是1 mol C完全燃烧生成CO2气体时放出的热量,已知下列几种化合物的生成热分别是
?
则1 kg葡萄糖在人体内完全氧化生成CO2气体和液态水,最多可提供的能量约为 ( )
A.3 225 kJ B.2 816 kJ
C.6 999 kJ D.15 644 kJ
D
化合物
葡萄糖
H2O(l)
CO2
生成热/kJ·mol-1
1 259.8
285.8
393.5
4.焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
①C(s)+H2O(g)══CO(g)+H2(g) ΔH1=+131.5 kJ·mol-1
②CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH2=+205.9 kJ·mol-1 试计算CH4(g)══C(s)+2H2(g)的ΔH。
解析:分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应:CH4(g)══C(s)+2H2(g)即:
CO(g)+H2(g)══C(s)+H2O(g) ΔH3=-ΔH1=-131.5 kJ·mol-1
CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH2=+205.96 kJ·mol-1
CH4(g)══C(s)+2H2(g) ΔH=?
根据盖斯定律:
ΔH=ΔH3+ΔH2=ΔH2-ΔH1=+205.9 kJ·mol-1-131.5 kJ·mol-1=+74.4 kJ·mol-1。
课堂素能探究
问题探究:1.一定量固态碳在炉膛内完全燃烧,放出热量为Q1 kJ;向炽热的炉膛内通入水蒸气会产生水煤气,水煤气完全燃烧,此过程共放出热量为Q2 kJ;若炉膛内按两种方法燃烧等质量固态碳,试讨论Q1、Q2的大小关系。
一
盖斯定律的应用
2.合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起着重要作用。贮氢合金ThNi,可催化由CO、H2合成CH4的反应。已知温度为T时:CH4(g)+2H2O(g)══CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)══CO2(g)+H2(g) ΔH=-41 kJ·mol-1。温度为T时,试写出CO、H2合成CH4的热化学方程式。
探究提示:1.根据盖斯定律,两种情况下的始态与终态相同,故放出的热量是相同的,即Q1=Q2。
2.CO(g)+3H2(g)══CH4(g)+H2O(g) ΔH=-206 kJ·mol-1
(2)加和法:
①确定待求反应的热化学方程式。
②找出待求热化学方程式中各物质出现在已知方程式中的位置(是同侧还是异侧)。
③利用同侧相加、异侧相减进行处理。
④根据待求方程式中各物质的化学计量数通过乘除来调整已知反应的化学计量数,并消去中间产物。
⑤实施叠加并确定ΔH的变化。
2.应用盖斯定律计算反应热时的注意事项:
(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数;(2)热化学方程式相加减时,同种物质之间相加减,反应热也随之相加减(带符号);(3)将一个热化学方程式颠倒时,ΔH的“+”“-”号相反,但数值不变。
典例 1
B
规律方法指导:
反应热的计算与大小比较
①寻找ΔH之间的等量关系时,应特别注意盖斯定律的应用,通过方程式的加减进行计算。
②比较ΔH大小时,应特别注意物质的状态,理清物质三态变化中能量的变化。
〔变式训练1〕已知:C2H5OH(l)══C2H5OH(g) ΔH1
6H2O+6CO2(g)══C6H12O6(g)+6O2(g) ΔH2
C6H12O6(g)══2C2H5OH(l)+2CO2(g) ΔH3
C2H5OH(g)+3O2(g)══3H2O(g)+2CO2(g) ΔH4
下列说法正确的是 ( )
A.ΔH1<ΔH4
B.ΔH3+2ΔH4+ΔH2=0
C.2ΔH1+ΔH2+ΔH3+2ΔH4=0
D.2ΔH1-ΔH2+ΔH3+2ΔH4=0
C
解析:C2H5OH(l)══C2H5OH(g)为吸热过程,ΔH1>0,A项错;题目中四个热化学过程分别为①②③④,由盖斯定律得2ΔH1=ΔH3+2ΔH2+2ΔH4 ΔH1>0,ΔH3+2ΔH4+ΔH2>0,B项错;据盖斯定律②×1+②+③得到6H2O(g)+4CO2(g)══2C2H5OH(g)+6O2(g) ΔH=2ΔH1+ΔH2+ΔH3=-2ΔH4,即2ΔH1+ΔH2+ΔH3+2ΔH4=0,C项正确,D项错,故选C。
问题探究:1.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,H—Cl键的键能为431 kJ·mol-1,则H2(g)+Cl2(g)══2HCl(g)的反应热(ΔH)等于多少?
2.等质量的红磷和白磷都完全燃烧,放出的热量是否相等?请解释原因。
二
反应热的计算与比较
探究提示:1.ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1。
2.不相等。因为等质量的红磷和白磷的能量不相同,即反应物的总能量不同而生成物的总能量相同,则放出的热量不同。
知识归纳总结:
1.反应热的计算:
计算依据
计算方法
热化学方程式
热化学方程式与数学上的方程式相似,可以左右颠倒同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数
根据盖斯定律
根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式
计算依据
计算方法
根据燃烧热
可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热
根据化学
键的变化
ΔH=反应物的化学键断裂所吸收的能量总和-生成物的化学键形成所放出的能量总和
根据反应物和生成物的总能量
ΔH=E总(生成物)-E总(反应物)
2.反应热的大小比较:
(1)同一反应生成物状态不同时。
A(g)+B(g)══C(g) ΔH1<0
A(g)+B(g)══C(l) ΔH2<0
因为C(g)══C(l) ΔH3<0,
ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。
氮是地球上含量丰富的一种元素,
氮及其化合物在工农业生产、生活中有着重要作
用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)
过程中能量的变化示意图,请写出N2(g)和H2(g)反
应的热化学方程式:
_______________________________________________。
典例 2
390
(3)用NH3催化还原NO,还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)══2N2(g)+6H2O(g)
ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)══2NO(g)
ΔH2=-b kJ·mol-1②
求:若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=_____________kJ·mol-1(用含a、b的式子表示)。
(3b-a)/4
规律方法指导:
利用键能计算ΔH的方法
ΔH=反应物的化学键断裂所吸收的能量总和-生成物的化学键形成所放出的能量总和
〔变式训练2〕《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”。火药燃烧爆炸时发生的反应为S(s)+2KNO3(s)+3C(s)══K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。已知:
①碳的燃烧热ΔH1=a kJ·mol-1
②S(s)+2K(g)══K2S(s) ΔH2=b kJ·mol-1
③2K(s)+N2(g)+3O2(g)══2KNO3(s)
ΔH3=c kJ·mol-1,则x为 ( )
A.3a+b-c B.c-3a-b
C.a-b-c D.c-a-b
A
解析:①碳燃烧的热化学方程式为:
C(s)+O2(g)══CO2(g) ΔH1=a kJ·mol-1
②S(s)+2K(g)══K2S(s) ΔH2=b kJ·mol-1
③2K(s)+N2(g)+3O2(g)══2KNO3(s) ΔH3=c kJ·mol-1
根据盖斯定律,①×3+②-③可得:
S(s)+2KNO3(s)+3C(s)══K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1=(a kJ·mol-1)×3+b kJ·mol-1-c kJ·mol-1=(3a+b-c)kJ·mol-1,故选A。
名师博客呈现
盖斯简介
盖斯,瑞士化学家,1802年8月8日生于瑞士日内瓦市一个画家家庭,三岁时随父亲定居俄国莫斯科,因而在俄国上学和工作。1825年毕业于多尔帕特大学医学系,并获得医学博士学位。1826年弃医专攻化学,并到瑞典斯德哥尔摩柏济力阿斯实验室专修化学,从此与柏济力阿斯结成了深厚的友谊。回国后到乌拉尔做地质调查和勘探工作,后又到伊尔库茨克研究矿物。1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士,旋即被聘为圣彼得堡工艺学院理论化学教授兼中央师范学院和矿业学院教授。
盖斯早年从事分析化学的研究,曾对巴库附近的矿物和天然气进行分析,作出了一定成绩,之后还曾发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。1840年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的。这就是举世闻名的盖斯定律。
B
https://www.21cnjy.com/help/help_extract.php
