2020-2021学年高中化学新人教版选择性必修1 第一章 化学反应的热效应 章末素能提升 课件(40张)
文档属性
| 名称 | 2020-2021学年高中化学新人教版选择性必修1 第一章 化学反应的热效应 章末素能提升 课件(40张) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-30 23:49:44 | ||
图片预览











文档简介
人教(2019)版 选择性必修一
第一章 化学反应的热效应
章末素能提升
第一章
化学反应的热效应
章末素能提升
专题归纳
真题体验
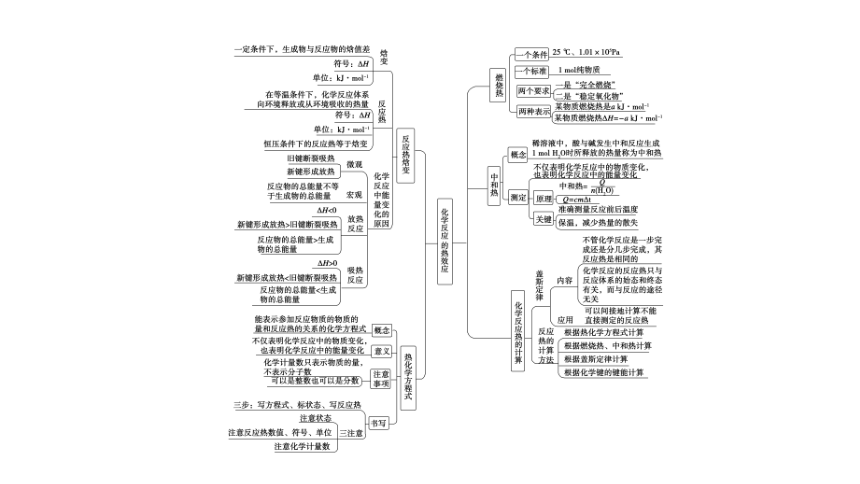
知识网络
知识网络
专题归纳
1.反应类型与反应条件
热化学反应类型与条件无必然联系。吸热反应,不一定需要加热,如氢氧化钡晶体与氯化铵混合反应是吸热反应,但在常温下可以进行;燃烧反应一般需要点燃,但它们都是放热反应。
2.反应热与反应条件
反应热大小由反应物和生成物的总能量的相对大小决定,改变反应条件,不影响同一反应的反应热。
专题1 能量变化中概念辨析的六大陷阱
3.键能、总能量与反应热的关系
键能是指常温常压下,将1 mol AB分子断裂为气态原子A和B所需要的能量。键能越大,物质稳定性越强。而物质总能量是指物质处于一定状态下所具有的内能,能量越大,物质越不稳定;故二者不是同一概念。
从键能的角度看,ΔH=反应物总键能-生成物总键能;
从总能量角度看,ΔH=生成物总能量-反应物总能量。
4.反应热和放出的热量
对于放热反应,若比较反应热,既要考虑数值又要考虑负号,绝对值越大,负值越小,放热越多;若比较放出热量的大小,只考虑数值,不考虑负号,数值越大,放热越多。
5.热化学方程式中反应热的单位与数值
热化学方程式中反应热的数值与各物质的物质的量成正比,单位都是kJ·mol-1。在热化学方程式中,“kJ·mol-1”中mol不表示反应物的物质的量为1 mol。
6.中和热与中和反应
(1)中和热与中和反应:强酸、弱酸与强碱、弱碱发生中和反应都有中和热,但现在研究的中和热一般是强酸、强碱反应的中和热。
(2)测中和热时,中和热的数值大小与酸、碱的用量无关,与酸碱强弱、浓稀有关。
(3)中和热数值与57.3 kJ·mol-1:只有强酸与强碱在稀溶液中发生中和反应的中和热数值为57.3 kJ·mol-1;氢氧化钠固体、浓硫酸参加反应,会额外放出热量;弱酸或弱碱发生中和反应时,因电离要吸收部分热量;稀硫酸和氢氧化钡溶液反应,因生成沉淀会放出热量。
〔强化训练1〕
单斜硫和正交硫转化为二氧化硫的能量变化图如图所示。下列说法正确的是 ( )
A.S(s,单斜)══S(s,正交) ΔH=+0.33 kJ·mol-1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含
有的能量高
D.①式表示断裂1 mol O2中的共价键
所吸收的能量比形成1 mol SO2中的共价键所
放出的能量少297.16 kJ
B
解析:A项,单斜硫的能量比正交硫的能量高,S(s,单斜)=S(s,正交) ΔH=-0.33 kJ·mol-1,为放热反应,错误;B项,物质的能量越高越不稳定,则正交硫比单斜硫稳定,正确;C项,由图象可以看出,单斜硫的能量比正交硫的能量高,错误;D项,①式反应需断裂单斜硫中S—S键和O=O键,不仅仅是断裂1 mol O2中的共价键所吸收的能量,错误。
1.根据反应物的本性比较
等物质的量的不同物质与同一物质反应时,性质不同,其反应热不同。如等物质的量的不同金属或非金属与同一种物质反应,金属或非金属越活泼,反应越容易发生,放出的热量就越多,ΔH就越小。
专题2 ΔH大小比较面面观
2.利用状态,迅速比较反应热的大小
物质的气、液、固三态的变化与反应热的关系。
(1)若反应为放热反应,当反应物状态相同,生成物状态不同时,生成固体放热最多,生成气体放热最少。
(2)若反应为放热反应,当反应物状态不同,生成物状态相同时,固体反应物放热最少,气体反应物放热最多。
3.根据反应进行的程度进行比较
(1)对于多步进行的放热反应,当反应物和生成物的状态相同时,参加反应物质的量越多,ΔH就越小。对于可逆反应,若正反应是放热反应,反应程度越大,反应放出的热量越多;若正反应是吸热反应,反应程度越大,反应吸收的热量越多。
4.根据反应规律和影响ΔH大小的因素直接比较
依据规律、经验和常识可直接判断反应的ΔH的大小。
(1)吸热反应的ΔH肯定比放热反应的大(前者大于0,后者小于0);
(2)2 mol H2燃烧放出的热量肯定比1 mol H2燃烧放出的热量多;
(3)等量的碳完全燃烧生成CO2放出的热量肯定比不完全燃烧生成CO放出的热量多;
(4)生成等量的水时,强酸和强碱的稀溶液反应比强酸和弱碱(或弱酸和强碱)的稀溶液反应放出的热量多。
5.盖斯定律法
依据盖斯定律,化学反应的反应热只与始态和终态有关,而与化学反应进行的途径无关。热化学方程式像代数式一样,可进行移项、合并和加、减、乘、除等数学运算。依据进行数学运算后所得新反应的ΔH可以比较运算前各反应的ΔH的大小,这种方法称为盖斯定律。
〔强化训练2〕
已知:
C(s)+O2(g)══CO2(g) ΔH1
CO2(g)+C(s)══2CO(g) ΔH2
2CO(g)+O2(g)══2CO2(g) ΔH3
4Fe(s)+3O2(g)══2Fe2O3 ΔH4
3CO(g)+Fe2O3(s)══3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是 ( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
C
1.运用盖斯定律计算
计算反应热最基本的方法是应用盖斯定律。高考题中往往给出几个已知的热化学方程式,然后要求计算与之有关的目标热化学方程式的反应热,此时可应用盖斯定律进行计算。
专题3 反应热的计算方法
3.根据化学方程式计算
计算依据:对于相同的反应,反应热与反应物参加反应的物质的量成正比。若题目给出了相应的热化学方程式,则按照化学计量数与ΔH的关系计算反应热。若没有给出热化学方程式,可先写出热化学方程式,再根据热化学方程式所体现的物质与物质间、物质与反应热间的关系直接或间接求算物质的质量或反应热。
4.根据反应物和生成物的能量计算
(1)根据公式:ΔH=生成物的总能量-反应物的总能量。
(2)根据燃烧热计算:紧扣燃烧热的定义,反应物的量为“1 mol”,生成物为稳定的氧化物。Q放=n(可燃物)×|ΔH|。
53.1
247
+120 kJ·mol-1
(4)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)══HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)══HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1反应3NO2(g)+H2O(l)══2HNO3(aq)+NO(g)的ΔH=_______kJ·mol-1。
-136.2
真题体验
解析:(1)根据盖斯定律,反应①+②可得反应③,则ΔH3=ΔH1+ΔH2=100.3 kJ·mol-1 +(-11.0 kJ·mol-1)=89.3 kJ·mol-1。
89.3
-116
解析:由盖斯定律可得,4HCl(g)+O2(g)══2Cl2(g)+2H2O(g)
ΔH=2ΔH3+2ΔH2+2ΔH1=(-121 kJ·mol-1)×2+(-20 kJ·mol-1×2)+(83 kJ·mol-1×2)=-116 kJ·mol-1。
3.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4︰1,甲烷和水蒸气反应的方程式是___________________________。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)══CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)══C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________________________________________________________反应的ΔH。
C(s)+2H2O(g)══CO2(g)+2H2(g)或C(s)+CO2(g)══2CO(g)
解析:(1)①已知反应物为CH4和H2O(g),生成物为H2和CO2,且物质的量之比为4︰1,据此结合质量守恒定律即可写出化学方程式。
②根据盖斯定律,ⅰ式+ⅱ式可得:CH4(g)+2H2O(g)══CO2(g)+4H2(g) ΔH1+ΔH2,则(ⅰ式+ⅱ式)-ⅲ式可得:C(s)+2H2O(g)══CO2(g)+2H2(g) ΔH;ⅰ式-ⅱ式可得:CH4(g)+CO2(g)══2CO(g)+2H2(g) ΔH1-ΔH2,则(ⅰ式-ⅱ式)-ⅲ式可得:C(s)+CO2(g)══2CO(g) ΔH。因此,要求反应ⅲ式的ΔH3,还必须利用反应C(s)+2H2O(g)══CO2(g)+2H2(g)或C(s)+CO2(g)══2CO(g)的ΔH。
D
解析:由题图可知,1 mol HCN的能量比HNC的能量低59.3 kJ,则HCN更稳定,则该异构化反应是吸热反应,反应的ΔH=+59.3 kJ·mol-1,A、B项正确;由题图可知,正反应的活化能是186.5 kJ·mol-1,逆反应的活化能为127.2 kJ·mol-1,C项正确;催化剂不改变反应热,D项错误。
https://www.21cnjy.com/help/help_extract.php
第一章 化学反应的热效应
章末素能提升
第一章
化学反应的热效应
章末素能提升
专题归纳
真题体验
知识网络
知识网络
专题归纳
1.反应类型与反应条件
热化学反应类型与条件无必然联系。吸热反应,不一定需要加热,如氢氧化钡晶体与氯化铵混合反应是吸热反应,但在常温下可以进行;燃烧反应一般需要点燃,但它们都是放热反应。
2.反应热与反应条件
反应热大小由反应物和生成物的总能量的相对大小决定,改变反应条件,不影响同一反应的反应热。
专题1 能量变化中概念辨析的六大陷阱
3.键能、总能量与反应热的关系
键能是指常温常压下,将1 mol AB分子断裂为气态原子A和B所需要的能量。键能越大,物质稳定性越强。而物质总能量是指物质处于一定状态下所具有的内能,能量越大,物质越不稳定;故二者不是同一概念。
从键能的角度看,ΔH=反应物总键能-生成物总键能;
从总能量角度看,ΔH=生成物总能量-反应物总能量。
4.反应热和放出的热量
对于放热反应,若比较反应热,既要考虑数值又要考虑负号,绝对值越大,负值越小,放热越多;若比较放出热量的大小,只考虑数值,不考虑负号,数值越大,放热越多。
5.热化学方程式中反应热的单位与数值
热化学方程式中反应热的数值与各物质的物质的量成正比,单位都是kJ·mol-1。在热化学方程式中,“kJ·mol-1”中mol不表示反应物的物质的量为1 mol。
6.中和热与中和反应
(1)中和热与中和反应:强酸、弱酸与强碱、弱碱发生中和反应都有中和热,但现在研究的中和热一般是强酸、强碱反应的中和热。
(2)测中和热时,中和热的数值大小与酸、碱的用量无关,与酸碱强弱、浓稀有关。
(3)中和热数值与57.3 kJ·mol-1:只有强酸与强碱在稀溶液中发生中和反应的中和热数值为57.3 kJ·mol-1;氢氧化钠固体、浓硫酸参加反应,会额外放出热量;弱酸或弱碱发生中和反应时,因电离要吸收部分热量;稀硫酸和氢氧化钡溶液反应,因生成沉淀会放出热量。
〔强化训练1〕
单斜硫和正交硫转化为二氧化硫的能量变化图如图所示。下列说法正确的是 ( )
A.S(s,单斜)══S(s,正交) ΔH=+0.33 kJ·mol-1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含
有的能量高
D.①式表示断裂1 mol O2中的共价键
所吸收的能量比形成1 mol SO2中的共价键所
放出的能量少297.16 kJ
B
解析:A项,单斜硫的能量比正交硫的能量高,S(s,单斜)=S(s,正交) ΔH=-0.33 kJ·mol-1,为放热反应,错误;B项,物质的能量越高越不稳定,则正交硫比单斜硫稳定,正确;C项,由图象可以看出,单斜硫的能量比正交硫的能量高,错误;D项,①式反应需断裂单斜硫中S—S键和O=O键,不仅仅是断裂1 mol O2中的共价键所吸收的能量,错误。
1.根据反应物的本性比较
等物质的量的不同物质与同一物质反应时,性质不同,其反应热不同。如等物质的量的不同金属或非金属与同一种物质反应,金属或非金属越活泼,反应越容易发生,放出的热量就越多,ΔH就越小。
专题2 ΔH大小比较面面观
2.利用状态,迅速比较反应热的大小
物质的气、液、固三态的变化与反应热的关系。
(1)若反应为放热反应,当反应物状态相同,生成物状态不同时,生成固体放热最多,生成气体放热最少。
(2)若反应为放热反应,当反应物状态不同,生成物状态相同时,固体反应物放热最少,气体反应物放热最多。
3.根据反应进行的程度进行比较
(1)对于多步进行的放热反应,当反应物和生成物的状态相同时,参加反应物质的量越多,ΔH就越小。对于可逆反应,若正反应是放热反应,反应程度越大,反应放出的热量越多;若正反应是吸热反应,反应程度越大,反应吸收的热量越多。
4.根据反应规律和影响ΔH大小的因素直接比较
依据规律、经验和常识可直接判断反应的ΔH的大小。
(1)吸热反应的ΔH肯定比放热反应的大(前者大于0,后者小于0);
(2)2 mol H2燃烧放出的热量肯定比1 mol H2燃烧放出的热量多;
(3)等量的碳完全燃烧生成CO2放出的热量肯定比不完全燃烧生成CO放出的热量多;
(4)生成等量的水时,强酸和强碱的稀溶液反应比强酸和弱碱(或弱酸和强碱)的稀溶液反应放出的热量多。
5.盖斯定律法
依据盖斯定律,化学反应的反应热只与始态和终态有关,而与化学反应进行的途径无关。热化学方程式像代数式一样,可进行移项、合并和加、减、乘、除等数学运算。依据进行数学运算后所得新反应的ΔH可以比较运算前各反应的ΔH的大小,这种方法称为盖斯定律。
〔强化训练2〕
已知:
C(s)+O2(g)══CO2(g) ΔH1
CO2(g)+C(s)══2CO(g) ΔH2
2CO(g)+O2(g)══2CO2(g) ΔH3
4Fe(s)+3O2(g)══2Fe2O3 ΔH4
3CO(g)+Fe2O3(s)══3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是 ( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
C
1.运用盖斯定律计算
计算反应热最基本的方法是应用盖斯定律。高考题中往往给出几个已知的热化学方程式,然后要求计算与之有关的目标热化学方程式的反应热,此时可应用盖斯定律进行计算。
专题3 反应热的计算方法
3.根据化学方程式计算
计算依据:对于相同的反应,反应热与反应物参加反应的物质的量成正比。若题目给出了相应的热化学方程式,则按照化学计量数与ΔH的关系计算反应热。若没有给出热化学方程式,可先写出热化学方程式,再根据热化学方程式所体现的物质与物质间、物质与反应热间的关系直接或间接求算物质的质量或反应热。
4.根据反应物和生成物的能量计算
(1)根据公式:ΔH=生成物的总能量-反应物的总能量。
(2)根据燃烧热计算:紧扣燃烧热的定义,反应物的量为“1 mol”,生成物为稳定的氧化物。Q放=n(可燃物)×|ΔH|。
53.1
247
+120 kJ·mol-1
(4)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)══HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)══HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1反应3NO2(g)+H2O(l)══2HNO3(aq)+NO(g)的ΔH=_______kJ·mol-1。
-136.2
真题体验
解析:(1)根据盖斯定律,反应①+②可得反应③,则ΔH3=ΔH1+ΔH2=100.3 kJ·mol-1 +(-11.0 kJ·mol-1)=89.3 kJ·mol-1。
89.3
-116
解析:由盖斯定律可得,4HCl(g)+O2(g)══2Cl2(g)+2H2O(g)
ΔH=2ΔH3+2ΔH2+2ΔH1=(-121 kJ·mol-1)×2+(-20 kJ·mol-1×2)+(83 kJ·mol-1×2)=-116 kJ·mol-1。
3.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4︰1,甲烷和水蒸气反应的方程式是___________________________。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)══CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)══C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________________________________________________________反应的ΔH。
C(s)+2H2O(g)══CO2(g)+2H2(g)或C(s)+CO2(g)══2CO(g)
解析:(1)①已知反应物为CH4和H2O(g),生成物为H2和CO2,且物质的量之比为4︰1,据此结合质量守恒定律即可写出化学方程式。
②根据盖斯定律,ⅰ式+ⅱ式可得:CH4(g)+2H2O(g)══CO2(g)+4H2(g) ΔH1+ΔH2,则(ⅰ式+ⅱ式)-ⅲ式可得:C(s)+2H2O(g)══CO2(g)+2H2(g) ΔH;ⅰ式-ⅱ式可得:CH4(g)+CO2(g)══2CO(g)+2H2(g) ΔH1-ΔH2,则(ⅰ式-ⅱ式)-ⅲ式可得:C(s)+CO2(g)══2CO(g) ΔH。因此,要求反应ⅲ式的ΔH3,还必须利用反应C(s)+2H2O(g)══CO2(g)+2H2(g)或C(s)+CO2(g)══2CO(g)的ΔH。
D
解析:由题图可知,1 mol HCN的能量比HNC的能量低59.3 kJ,则HCN更稳定,则该异构化反应是吸热反应,反应的ΔH=+59.3 kJ·mol-1,A、B项正确;由题图可知,正反应的活化能是186.5 kJ·mol-1,逆反应的活化能为127.2 kJ·mol-1,C项正确;催化剂不改变反应热,D项错误。
https://www.21cnjy.com/help/help_extract.php
