2020-2021学年高中化学新人教版选择性必修1 第一章第一节 反应热(第1课时) 课件(31张)
文档属性
| 名称 | 2020-2021学年高中化学新人教版选择性必修1 第一章第一节 反应热(第1课时) 课件(31张) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 15:30:06 | ||
图片预览









文档简介
人教(2019)版 选择性必修一
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
1.知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。
2.了解反应热与焓变的含义,了解化学能与热能的相互转化,等压条件下化学反应的反应热可以用焓变的表示。
3.了解吸热反应、放热反应、反应热等概念。
4.知道中和反应反应热的测定方法。
课程目标
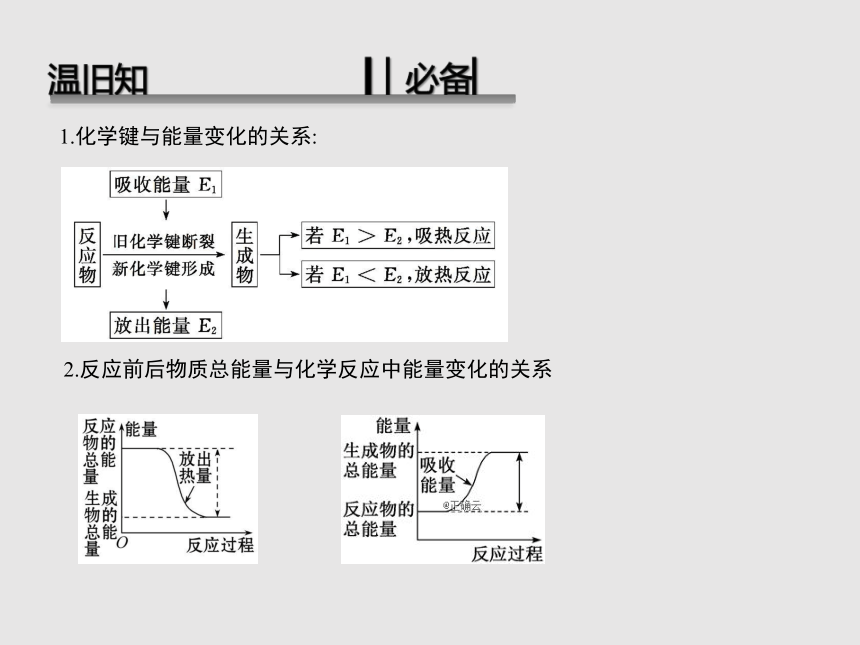
温旧知 ▎▏必备▏
1.化学键与能量变化的关系:
2.反应前后物质总能量与化学反应中能量变化的关系
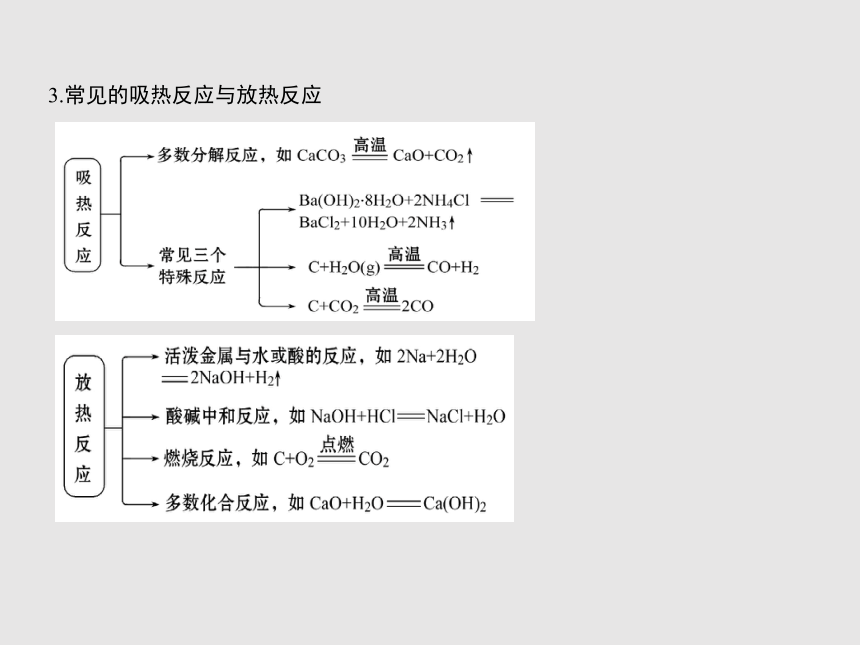
3.常见的吸热反应与放热反应
一、反应热
1、反应热及其测定
(1)体系与环境——以盐酸与NaOH溶液之间为例
环境:与体系相互影响的其他部分,如试管、空气等。
体系:包括 、 、 。
[基础?初探]
(2)体系与环境的热量交换——反应热
热量:因温度不同而在体系与环境之间 的能量。
反应热:在 条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
交换或传递
等温
反应物
发生的反应
生成物
?名师点拨
反应热概念中的“等温条件”是指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度 。
相等
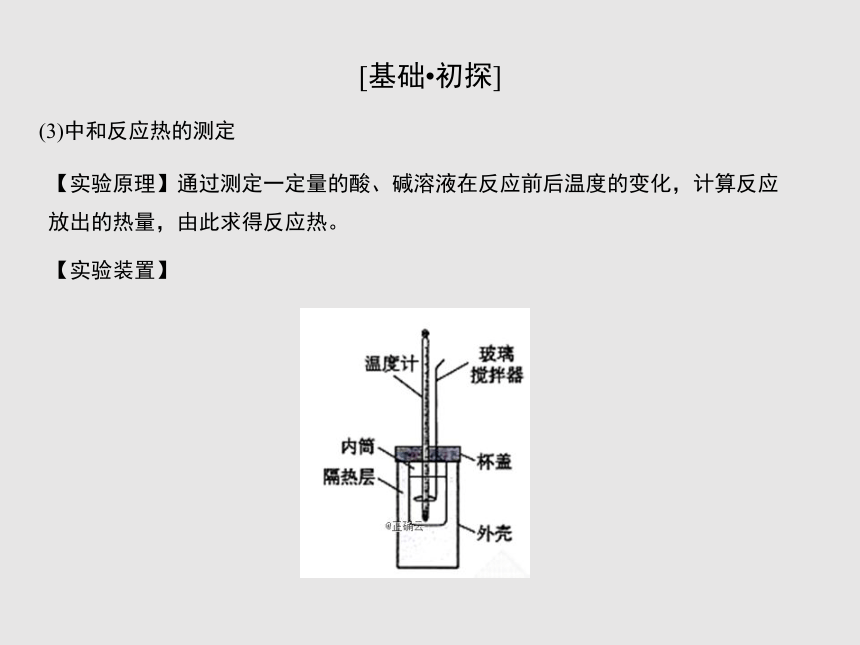
(3)中和反应热的测定
[基础?初探]
【实验原理】通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得反应热。
【实验装置】
【实验步骤】
[基础?初探]
热量损失
高
注意事项
①为了保证酸、碱完全中和,常采用碱稍过量的方法。
②中和反应的终止温度是反应混合液的最高温度。
【数据处理】
[基础?初探]
【实验结论】
大量实验测得,在25 C和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3kJ的热量。
【问题与讨论】
[基础?初探]
在上述过程中,提高测定反应热准确度的措施有哪些?
提示:①实验中用温度计先后测量酸溶液、碱溶液及混合溶液的温度时,使用同一支温度计可减小实验误差,且测量完一种溶液后 ,温度计必须用水冲洗干净并用滤纸擦干。温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记下读数。
②反应物应一次性迅速加入,且避免有液体溅出。
③实验操作时动作要快,尽量减少热量的损失。
④重复实验3次,取3次实验数据的平均值。
?名师点拨
导致中和反应反应热测定存在误差的原因
①量取溶液的体积不准确。
②温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。③实验过程中有液体溅出。
④混合酸、碱溶液时,动作缓慢。
⑤隔热层隔热效果不好,实验过程中有热量损失。
⑥测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。⑦溶液浓度不准确。
⑧没有进行重复实验。
二、焓变
[基础?初探]
1、内能:体系内物质的各种能量的 ,受温度、 和物质的聚集状态等影响。符号为 。
2、焓:与物质 有关的物理量,单位为 ,符号为H。
3、焓变(ΔH): 与 的焓值差,单位为 。恒压条件下反应的热效应等于焓变。
4、焓变与吸热反应、放热反应的关系
当ΔH为“ ”或ΔH 0时,为吸热反应;当ΔH为“ ”或ΔH 0时,为放热反应。
总和
压强
U
内能
kJ/mol
生成物的总焓
反应物的总焓
kJ/mol
+
>
-
<
5、化学反应过程中能量变化的原因
[基础?初探]
(1)微观角度
[基础?初探]
436kJ
243kJ
862kJ
184.6kJ
?名师点拨
上述分析表明:化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
ΔH=反应物分子化学键断裂时吸收的总能量-生成物分子的化学键形成时释放的总能量
(2)宏观角度
从物质内能上分析,如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出能量,这就是放热反应。反之,则为吸热反应。如图所示:
[基础?初探]
ΔH=生成物的总能量-反应物的总能量
重难点剖析 反应热、焓、焓变的比较
{5940675A-B579-460E-94D1-54222C63F5DA}
反应热
焓变
焓
概念
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
化学反应中生成物的总焓与反应物的总焓之差
物质所具有的能量
符号
ΔQ
ΔH
H
单位
kJ/mol
数值
正值表示反应吸热;负值表示反应放热
只有正值
联系
反应热=焓变(等压);ΔH=H(生成物)-H(反成物)
注意
焓变、焓、反应热代表的意义不同。
任何化学反应都有反应热。
物质三态之间变化的焓变不能叫反应热,反应热是化学反应的焓变。
[课堂?练习]
[课堂?练习]
[课堂?练习]
答案:D
解析:浓硫酸溶于水不是化学反应,是物理变化,且该过程放热。
[课堂?练习]
[课堂?练习]
[课堂?练习]
[课堂?练习]
[课堂?练习]
[课堂?练习]
Thank you for watching !
本部分内容讲解结束
https://www.21cnjy.com/help/help_extract.php
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
1.知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。
2.了解反应热与焓变的含义,了解化学能与热能的相互转化,等压条件下化学反应的反应热可以用焓变的表示。
3.了解吸热反应、放热反应、反应热等概念。
4.知道中和反应反应热的测定方法。
课程目标
温旧知 ▎▏必备▏
1.化学键与能量变化的关系:
2.反应前后物质总能量与化学反应中能量变化的关系
3.常见的吸热反应与放热反应
一、反应热
1、反应热及其测定
(1)体系与环境——以盐酸与NaOH溶液之间为例
环境:与体系相互影响的其他部分,如试管、空气等。
体系:包括 、 、 。
[基础?初探]
(2)体系与环境的热量交换——反应热
热量:因温度不同而在体系与环境之间 的能量。
反应热:在 条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
交换或传递
等温
反应物
发生的反应
生成物
?名师点拨
反应热概念中的“等温条件”是指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度 。
相等
(3)中和反应热的测定
[基础?初探]
【实验原理】通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得反应热。
【实验装置】
【实验步骤】
[基础?初探]
热量损失
高
注意事项
①为了保证酸、碱完全中和,常采用碱稍过量的方法。
②中和反应的终止温度是反应混合液的最高温度。
【数据处理】
[基础?初探]
【实验结论】
大量实验测得,在25 C和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3kJ的热量。
【问题与讨论】
[基础?初探]
在上述过程中,提高测定反应热准确度的措施有哪些?
提示:①实验中用温度计先后测量酸溶液、碱溶液及混合溶液的温度时,使用同一支温度计可减小实验误差,且测量完一种溶液后 ,温度计必须用水冲洗干净并用滤纸擦干。温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记下读数。
②反应物应一次性迅速加入,且避免有液体溅出。
③实验操作时动作要快,尽量减少热量的损失。
④重复实验3次,取3次实验数据的平均值。
?名师点拨
导致中和反应反应热测定存在误差的原因
①量取溶液的体积不准确。
②温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。③实验过程中有液体溅出。
④混合酸、碱溶液时,动作缓慢。
⑤隔热层隔热效果不好,实验过程中有热量损失。
⑥测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。⑦溶液浓度不准确。
⑧没有进行重复实验。
二、焓变
[基础?初探]
1、内能:体系内物质的各种能量的 ,受温度、 和物质的聚集状态等影响。符号为 。
2、焓:与物质 有关的物理量,单位为 ,符号为H。
3、焓变(ΔH): 与 的焓值差,单位为 。恒压条件下反应的热效应等于焓变。
4、焓变与吸热反应、放热反应的关系
当ΔH为“ ”或ΔH 0时,为吸热反应;当ΔH为“ ”或ΔH 0时,为放热反应。
总和
压强
U
内能
kJ/mol
生成物的总焓
反应物的总焓
kJ/mol
+
>
-
<
5、化学反应过程中能量变化的原因
[基础?初探]
(1)微观角度
[基础?初探]
436kJ
243kJ
862kJ
184.6kJ
?名师点拨
上述分析表明:化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
ΔH=反应物分子化学键断裂时吸收的总能量-生成物分子的化学键形成时释放的总能量
(2)宏观角度
从物质内能上分析,如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出能量,这就是放热反应。反之,则为吸热反应。如图所示:
[基础?初探]
ΔH=生成物的总能量-反应物的总能量
重难点剖析 反应热、焓、焓变的比较
{5940675A-B579-460E-94D1-54222C63F5DA}
反应热
焓变
焓
概念
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
化学反应中生成物的总焓与反应物的总焓之差
物质所具有的能量
符号
ΔQ
ΔH
H
单位
kJ/mol
数值
正值表示反应吸热;负值表示反应放热
只有正值
联系
反应热=焓变(等压);ΔH=H(生成物)-H(反成物)
注意
焓变、焓、反应热代表的意义不同。
任何化学反应都有反应热。
物质三态之间变化的焓变不能叫反应热,反应热是化学反应的焓变。
[课堂?练习]
[课堂?练习]
[课堂?练习]
答案:D
解析:浓硫酸溶于水不是化学反应,是物理变化,且该过程放热。
[课堂?练习]
[课堂?练习]
[课堂?练习]
[课堂?练习]
[课堂?练习]
[课堂?练习]
Thank you for watching !
本部分内容讲解结束
https://www.21cnjy.com/help/help_extract.php
