2020-2021学年 高中化学新人教版选择性必修1 第4章化学反应与电能复习课件(38张)
文档属性
| 名称 | 2020-2021学年 高中化学新人教版选择性必修1 第4章化学反应与电能复习课件(38张) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 16:38:16 | ||
图片预览










文档简介
人教(2019)版 选择性必修一
第四章 化学反应与电能
本章素养提升
本章素养提升
知 识 网 络
化学反应与电能
知 识 网 络
化学反应与电能
知 识 网 络
化学反应与电能
探究点一 原电池、电解池、电镀池的比较与判断
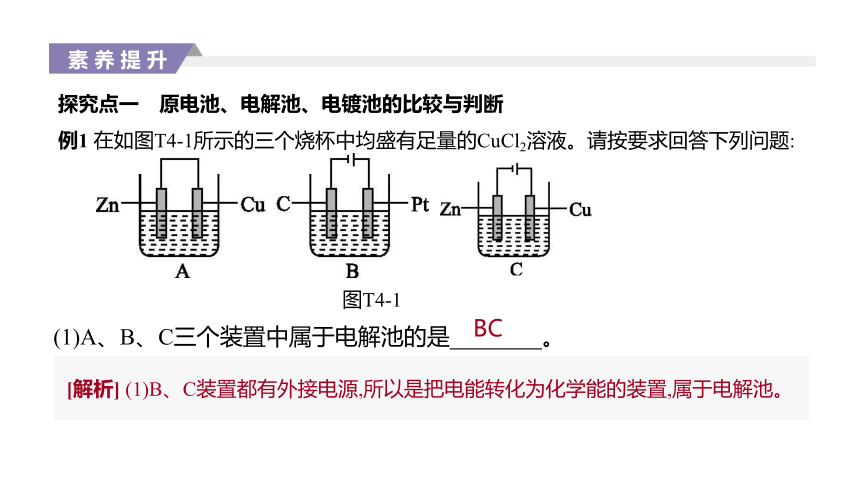
例1 在如图T4-1所示的三个烧杯中均盛有足量的CuCl2溶液。请按要求回答下列问题:
素 养 提 升
图T4-1
(1)A、B、C三个装置中属于电解池的是 。?
BC
[解析] (1)B、C装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池。
素 养 提 升
(2)A池中Cu是 极,A池中Cl-移向 极
(填“Zn”或“Cu”),总反应的离子方程式为
。?
正
Zn
Cu2++Zn=Zn2++Cu
[解析] (2)该装置是原电池,较活泼的金属锌作负极,铜作正极;带负电荷的氯离子移向原电池的负极;锌和铜离子发生氧化还原反应生成锌离子和铜单质。
(3)B池中C电极上发生 (填“氧化”或“还原”)
反应,B池中总反应的化学方程式为
。?
CuCl2 Cl2↑+Cu
素 养 提 升
还原
[解析] (3)B电池中,C连接外接电源负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,阳极上氯离子失电子发生氧化反应。
素 养 提 升
(4)C池中Cu是 极,电极反应为 ,?
反应过程中c(Cu2+) (填“变大”“变小”或“不变”)。?
阳
Cu-2e-=Cu2+
不变
[解析] (4)铜连接外接电源的正极,所以是阳极,电解池工作时,阳极上铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变。
?
原电池
电解池
电镀池
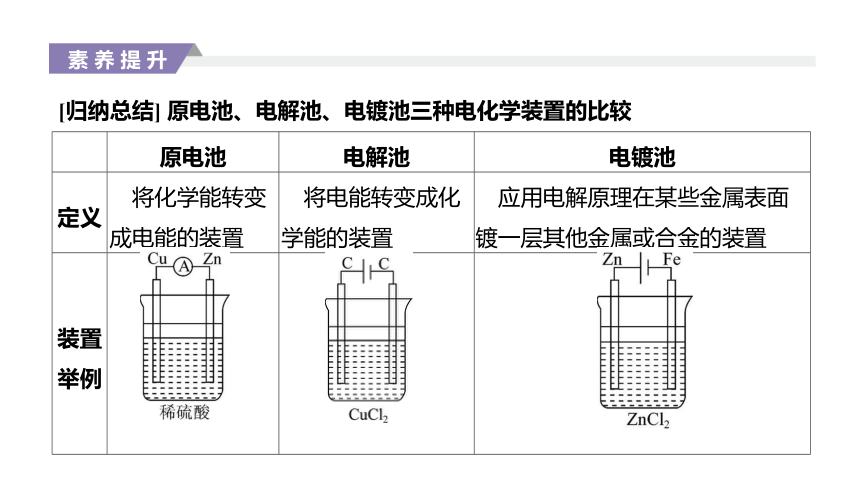
定义
将化学能转变成电能的装置
将电能转变成化学能的装置
应用电解原理在某些金属表面镀一层其他金属或合金的装置
装置
举例
?
?
?
[归纳总结] 原电池、电解池、电镀池三种电化学装置的比较
素 养 提 升
素 养 提 升
形成
条件
①活泼性不同的两电极(连接)
②电解质溶液(电极插入其中)
③形成闭合回路
④自发的氧化还原反应
①两电极接直流电源
②两电极插入电解质溶液
③形成闭合回路
①镀层金属接电源正极,待镀金属接电源负极
②电镀液必须含有镀层金属的离子
装置
特征
无电源,两极材料不同
有电源,两极材料可同可不同
有电源
素 养 提 升
电极
名称
一般情况下,
负极:较活泼金属
正极:较不活泼金属(或能导电的非金属)
阳极:与电源正极相连的一极
阴极:与电源负极相连的一极
名称同电解池,但有限制条件
阳极:必须是镀层金属
阴极:镀件
电极
反应
负极:金属失电子,发生氧化反应
正极:溶液中的阳离子得电子,发生还原反应
阳极:发生氧化反应,溶液中的阴离子失电子,或电极金属失电子
阴极:发生还原反应,溶液中的阳离子得电子
阳极:金属电极失电子
阴极:电镀液中镀层金属的阳离子得电子
电子
流向
负极 正极
电源负极 阴极
电源正极 阳极
同电解池
带电粒子
的移动
阳离子向正极移动
阴离子向负极移动
阳离子向阴极移动
阴离子向阳极移动
同电解池
是否自发
自发
不自发
不自发
主要应用
①金属的电化学腐蚀
②制造化学电源
①氯碱工业 ②电冶金
③精炼铜
①增强金属抗腐蚀能力
②增加美观和表面硬度
实质
均是发生氧化还原反应,两电极得失电子数相等
联系
原电池可以作为电解池、电镀池的电池
素 养 提 升
探究点二 新型化学电池
例2 如图T4-2(Ⅰ)为全钒电池,电池工作原理为:2H++VO2++V2+ VO2++V3++
H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
A.闭合K时,全钒电池负极区pH基本不变
B.闭合K时,铂电极的电极反应式为:
NO3?+6e-+5H2O=NH2OH+7OH-
C.全钒电池充电时,电极B上发生还原反应
D.全钒电池放电时,电极B上发生的反应为:VO2++2H++e-=VO2++H2O
?
素 养 提 升
图T4-2
D
[解析] 电池工作时,即放电时(Ⅰ)装置为原电池,放电时,反应中V2+离子被氧化,电极A应是电源的负极,负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电极B为正极,发生反应:VO2++2H++e-=VO2++H2O。接通电路时(Ⅰ)装置为原电池,(Ⅱ)装置为电解池,当闭合开关K
时,铂电极上生成NH2OH则铂电极为阴极,
石墨电极为阳极。根据此分析进行解答。
放电过程中,总反应消耗氢离子,溶液的pH
变大,A错误。
?
素 养 提 升
图T4-2
闭合K时,铂电极为阴极,发生还原反应,混合溶液为酸性溶液,不会生成OH-,电极反应式为:NO3?+6e-+7H+=NH2OH+2H2O,B错误。
充电时,电极B为阳极,发生氧化反应,C错误。
放电时电极B为正极,发生反应:
VO2++2H++e-=VO2++H2O,D正确。
?
素 养 提 升
图T4-2
[归纳小结] 新型化学电池的判断
1.新型电池正负极的判断
新型电池中负极材料元素化合价升高的物质发生氧化反应的物质正极材料元素化合价降低的物质发生还原反应的物质
?
素 养 提 升
2.新型电池“放电”“充电”时电极反应式的正误判断
(1)新型电池放电
①若给出新型电池的装置图:先找出电池的正、负极,即找出氧化剂和还原剂;再结合电解质确定出还原产物和氧化产物;最后判断相应的电极反应式的正误。
②若给出新型电池的总反应式:分析总反应式中各元素化合价的变化情况,找出氧化剂及其对应的还原产物、还原剂及其对应的氧化产物,最后考虑电解质是否参加反应,判断电极反应式的正误。
素 养 提 升
(2)新型电池充电
①充电时阴极的电极反应式是该电池放电时的负极反应式的“逆反应”。
②充电时阳极的电极反应式是该电池放电时的正极反应式的“逆反应”。
3.新型电池中离子的移动方向的判断:
正正负负,溶液中的带负电荷的阴离子要移向负极;带正电荷的阳离子要移向正极。
素 养 提 升
探究点三 电解问题的分析与判断
例3 在如图T4-3所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x、y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题:
(1)标出电源的正、负极:x为 极,y为 极。?
素 养 提 升
图T4-3
正
负
素 养 提 升
图T4-3
[解析] (1)惰性电极电解KOH溶液,实质就是电解水,所得产物为H2和O2,因为A试管中气体体积是B试管中的2倍,所以A中为H2,B中为O2,即A为阴极,B为阳极,所以x为正极,y为负极。
(2)在滤纸的C端附近,观察到的现象是
,在滤纸的D端附近,观察到的现象是 。?
素 养 提 升
图T4-3
试纸变蓝
试纸变红
[解析] (2)C为阳极,电极反应式为2I--2e-=I2,淀粉遇碘显蓝色,所以试纸变蓝,D为阴极,水电离产生的H+放电,使D极附近呈碱性,使酚酞变红。
(3)写出电极反应式:
B中 ;?
D端 。?
素 养 提 升
图T4-3
4OH--4e-=2H2O+O2↑
4H2O+4e-=2H2↑+4OH-
[解析] (3)B电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2,闭合开关S1,则电流表的指针是否发生偏转? (填“偏转”或“不偏转”)。?
素 养 提 升
图T4-3
偏转
[解析] (4)如果切断S2,闭合S1,则可由A中的H2、B中的O2与KOH溶液形成H2-O2燃料电池,把化学能变为电能,因此指针偏转。
[归纳小结] 分析电解问题的基本思路模式
1.通电前
电解池溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
2.通电后
阴离子移向阳极、阳离子移向阴极,结合放电顺序分析谁优先放电。
素 养 提 升
3.写电极反应式,并结合题目要求得出结论,如两极现象、水的电离平衡移动、离子浓度的变化、pH的变化等。
(1)阴、阳极的判断
①根据电极与电源两极相连的顺序判断。
阴极:与直流电源的负极相连接的电解池中的电极。
阳极:与直流电源的正极相连接的电解池中的电极。
素 养 提 升
②根据电极上的变化判断。
阴极:溶液中氧化性强的阳离子首先在阴极上得电子,发生还原反应,析出金属单质,电极质量增加。
阳极:溶液中还原性强的阴离子失去电子被氧化,或者活性电极本身失去电子被氧化而溶入溶液,使电极质量减小。
③根据电解质溶液里离子移动的方向判断。
在电解质溶液里阳离子总是向阴极作定向移动,阴离子总是向阳极作定向移动。
素 养 提 升
(2)判断电解后溶液的pH变化的方法
根据原溶液的酸碱性和电解产物即可对电解后溶液的pH变化作出正确的判断,其方法如下:
①若电解产物只有H2而无O2,则pH变大;
②若电解产物只有O2而无H2,则pH变小;
③若电解产物既有O2又有H2,原溶液呈酸性则pH变小,原溶液呈碱性则pH变大,原溶液呈中性则pH不变。
素 养 提 升
1.下面有关电化学的图示,完全正确的是 ( )
自 我 检 测
A B C D
图T4-4
D
[解析] 该原电池中,Cu作正极,Zn作负极,A错误;
电解池中,电源正极连接阳极,阳极失去电子,发生氧化反应,电源负极连接阴极,阴极得到电子,发生还原反应,所以粗铜应该
作阳极,失去电子,发生氧化反应,B错误;
据图可知,电源正极连接Fe作阳极,Fe失去
电子,电极反应式为:Fe-2e-=Fe2+,电源负极
连接Zn,Zn作阴极,Fe2++2e-=Fe,即在阴极上镀Fe,C错误;
电解池中,电流从电源正极流出,即碳棒为阳极,电极反应式:2Cl--2e-=Cl2↑,阴极附近生成Cl2使淀粉碘化钾溶液变蓝,铁棒为阴极,电极反应式:2H2O+2e-=2OH-+H2↑,使含有酚酞的溶液变红,D正确。
自 我 检 测
2.通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图T4-5所示,下列说法正确的是 ( )
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6
LiM1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
自 我 检 测
图T4-5
C
[解析] 放电时,电子由石墨电极流向磷酸铁锂电极,则电流由磷酸铁锂电极流向石墨电极,A错误;
根据电池结构可知,该电池的总反应方程式为M1-xFexPO4+LiC6 LiM1-xFexPO4+6C,B错误;
放电时,石墨电极为负极,负极反应式为
LiC6-e-=Li++6C,C正确;
放电时,Li+移向磷酸铁锂电极,充电时
Li+移向石墨电极,D错误。
自 我 检 测
图T4-5
3.如图T4-6,某同学设计了一个燃料电池并
探究氯碱工业的原理和粗铜的精炼原理,
其中乙装置中的X为阳离子交换膜。请按
要求回答相关问题:(1)甲烷燃料电池的负极
反应为 。?
自 我 检 测
图T4-6
CH4-8e-+10OH-=CO32?+7H2O
?
[解析] (1)甲烷燃料电池负极上发生氧化反应,即甲烷在负极上被氧化。在KOH溶液中甲烷被氧化后生成碳酸钾,负极反应为CH4-8e-+10OH-=CO32?+7H2O。
?
(2)石墨(C)极的电极反应为 。
自 我 检 测
图T4-6
2Cl--2e-=Cl2↑
[解析] (2)原电池的负极与电解池的阴极相接,铁极为阴极,则C极为阳极,在C极上发生氧化反应,电极反应为2Cl--2e-=Cl2↑。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的体积为 L;丙装置中阴极析出铜的质量为 g。?
自 我 检 测
图T4-6
4.48
12.8
[解析] (3)n(O2)=2.24?L22.4?L·mol?1=0.1 mol,甲池中正极反应为O2+4e-+2H2O=4OH-,由电子守恒知,经过甲、乙、丙装置的电子的物质的量为0.4 mol。乙池中的铁电极与甲池的负极相连,铁电极为阴极,发生还原反应,电极反应为2H2O+2e-=2OH-+H2↑,n(H2)=0.4mol2=0.2 mol,V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。丙池中精铜为阴极,发生还原反应,电极反应为Cu2++2e-=Cu,n(Cu)=0.4mol2=0.2 mol,m(Cu)=0.2 mol×64 g·mol-1=12.8 g。
?
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图T4-7)。
若用于制漂白液,a为电池的 极,电解质
溶液最好用 。?
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用
作电极。?
自 我 检 测
图T4-7
负
饱和氯化钠溶液(或饱和食盐水)
铁
[解析] (4)漂白液的有效成分是次氯酸盐,制备原理是
2Cl-+2H2O 2OH-+Cl2↑+H2↑,Cl2+2OH-=Cl-+ClO-+H2O,
气体与液体反应,最好采用逆向接触,即气体在下端产生,
碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,
上端为阴极,阴极与电源负极相连,故a极为负极,生活中常见
且廉价的氯化物是氯化钠,故电解质溶液最好用饱和氯化钠
溶液。若制备氢氧化亚铁,用硫酸钠溶液作电解质溶液,选用铁作阳极。
自 我 检 测
图T4-7
4.按如图T4-8装置实验,A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出。又测得A杯溶液中NaOH的质量分数为10.23%。试回答:
(1)电源P为 极。?
(2)b极产生气体的体积为 L(标准状况)。?
(3)c极上析出Cu的质量为 g。?
(4)d极上所发生的电极反应式:
。?
自 我 检 测
图T4-8
负
2.8
16
2H2O-4e-=O2↑+4H+
[解析] B烧杯中c极上有金属析出,说明它为阴极,由此可知,d、b为阳极,a为阴极。按照“正接阳,负接阴”的规律,电源P为负极。电解NaOH溶液的实质是电解水,a极产生H2,b极产生O2;电解CuSO4溶液时,d极产生O2,其电极反应式为2H2O-4e-=O2↑+4H+。m(NaOH)=200 g×10%=20 g。电解后
溶液的质量为20?g10.23%=195.5 g。被电解的水为200 g-195.5 g
=4.5 g,为0.25 mol。由此可知,b极产生的O2为0.125 mol,
即2.8 L。根据电子守恒,可得0.125 mol×4=n(Cu)×2,n(Cu)=
0.25 mol,即16 g。
?
自 我 检 测
图T4-8
https://www.21cnjy.com/help/help_extract.php
第四章 化学反应与电能
本章素养提升
本章素养提升
知 识 网 络
化学反应与电能
知 识 网 络
化学反应与电能
知 识 网 络
化学反应与电能
探究点一 原电池、电解池、电镀池的比较与判断
例1 在如图T4-1所示的三个烧杯中均盛有足量的CuCl2溶液。请按要求回答下列问题:
素 养 提 升
图T4-1
(1)A、B、C三个装置中属于电解池的是 。?
BC
[解析] (1)B、C装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池。
素 养 提 升
(2)A池中Cu是 极,A池中Cl-移向 极
(填“Zn”或“Cu”),总反应的离子方程式为
。?
正
Zn
Cu2++Zn=Zn2++Cu
[解析] (2)该装置是原电池,较活泼的金属锌作负极,铜作正极;带负电荷的氯离子移向原电池的负极;锌和铜离子发生氧化还原反应生成锌离子和铜单质。
(3)B池中C电极上发生 (填“氧化”或“还原”)
反应,B池中总反应的化学方程式为
。?
CuCl2 Cl2↑+Cu
素 养 提 升
还原
[解析] (3)B电池中,C连接外接电源负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,阳极上氯离子失电子发生氧化反应。
素 养 提 升
(4)C池中Cu是 极,电极反应为 ,?
反应过程中c(Cu2+) (填“变大”“变小”或“不变”)。?
阳
Cu-2e-=Cu2+
不变
[解析] (4)铜连接外接电源的正极,所以是阳极,电解池工作时,阳极上铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变。
?
原电池
电解池
电镀池
定义
将化学能转变成电能的装置
将电能转变成化学能的装置
应用电解原理在某些金属表面镀一层其他金属或合金的装置
装置
举例
?
?
?
[归纳总结] 原电池、电解池、电镀池三种电化学装置的比较
素 养 提 升
素 养 提 升
形成
条件
①活泼性不同的两电极(连接)
②电解质溶液(电极插入其中)
③形成闭合回路
④自发的氧化还原反应
①两电极接直流电源
②两电极插入电解质溶液
③形成闭合回路
①镀层金属接电源正极,待镀金属接电源负极
②电镀液必须含有镀层金属的离子
装置
特征
无电源,两极材料不同
有电源,两极材料可同可不同
有电源
素 养 提 升
电极
名称
一般情况下,
负极:较活泼金属
正极:较不活泼金属(或能导电的非金属)
阳极:与电源正极相连的一极
阴极:与电源负极相连的一极
名称同电解池,但有限制条件
阳极:必须是镀层金属
阴极:镀件
电极
反应
负极:金属失电子,发生氧化反应
正极:溶液中的阳离子得电子,发生还原反应
阳极:发生氧化反应,溶液中的阴离子失电子,或电极金属失电子
阴极:发生还原反应,溶液中的阳离子得电子
阳极:金属电极失电子
阴极:电镀液中镀层金属的阳离子得电子
电子
流向
负极 正极
电源负极 阴极
电源正极 阳极
同电解池
带电粒子
的移动
阳离子向正极移动
阴离子向负极移动
阳离子向阴极移动
阴离子向阳极移动
同电解池
是否自发
自发
不自发
不自发
主要应用
①金属的电化学腐蚀
②制造化学电源
①氯碱工业 ②电冶金
③精炼铜
①增强金属抗腐蚀能力
②增加美观和表面硬度
实质
均是发生氧化还原反应,两电极得失电子数相等
联系
原电池可以作为电解池、电镀池的电池
素 养 提 升
探究点二 新型化学电池
例2 如图T4-2(Ⅰ)为全钒电池,电池工作原理为:2H++VO2++V2+ VO2++V3++
H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
A.闭合K时,全钒电池负极区pH基本不变
B.闭合K时,铂电极的电极反应式为:
NO3?+6e-+5H2O=NH2OH+7OH-
C.全钒电池充电时,电极B上发生还原反应
D.全钒电池放电时,电极B上发生的反应为:VO2++2H++e-=VO2++H2O
?
素 养 提 升
图T4-2
D
[解析] 电池工作时,即放电时(Ⅰ)装置为原电池,放电时,反应中V2+离子被氧化,电极A应是电源的负极,负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电极B为正极,发生反应:VO2++2H++e-=VO2++H2O。接通电路时(Ⅰ)装置为原电池,(Ⅱ)装置为电解池,当闭合开关K
时,铂电极上生成NH2OH则铂电极为阴极,
石墨电极为阳极。根据此分析进行解答。
放电过程中,总反应消耗氢离子,溶液的pH
变大,A错误。
?
素 养 提 升
图T4-2
闭合K时,铂电极为阴极,发生还原反应,混合溶液为酸性溶液,不会生成OH-,电极反应式为:NO3?+6e-+7H+=NH2OH+2H2O,B错误。
充电时,电极B为阳极,发生氧化反应,C错误。
放电时电极B为正极,发生反应:
VO2++2H++e-=VO2++H2O,D正确。
?
素 养 提 升
图T4-2
[归纳小结] 新型化学电池的判断
1.新型电池正负极的判断
新型电池中负极材料元素化合价升高的物质发生氧化反应的物质正极材料元素化合价降低的物质发生还原反应的物质
?
素 养 提 升
2.新型电池“放电”“充电”时电极反应式的正误判断
(1)新型电池放电
①若给出新型电池的装置图:先找出电池的正、负极,即找出氧化剂和还原剂;再结合电解质确定出还原产物和氧化产物;最后判断相应的电极反应式的正误。
②若给出新型电池的总反应式:分析总反应式中各元素化合价的变化情况,找出氧化剂及其对应的还原产物、还原剂及其对应的氧化产物,最后考虑电解质是否参加反应,判断电极反应式的正误。
素 养 提 升
(2)新型电池充电
①充电时阴极的电极反应式是该电池放电时的负极反应式的“逆反应”。
②充电时阳极的电极反应式是该电池放电时的正极反应式的“逆反应”。
3.新型电池中离子的移动方向的判断:
正正负负,溶液中的带负电荷的阴离子要移向负极;带正电荷的阳离子要移向正极。
素 养 提 升
探究点三 电解问题的分析与判断
例3 在如图T4-3所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x、y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题:
(1)标出电源的正、负极:x为 极,y为 极。?
素 养 提 升
图T4-3
正
负
素 养 提 升
图T4-3
[解析] (1)惰性电极电解KOH溶液,实质就是电解水,所得产物为H2和O2,因为A试管中气体体积是B试管中的2倍,所以A中为H2,B中为O2,即A为阴极,B为阳极,所以x为正极,y为负极。
(2)在滤纸的C端附近,观察到的现象是
,在滤纸的D端附近,观察到的现象是 。?
素 养 提 升
图T4-3
试纸变蓝
试纸变红
[解析] (2)C为阳极,电极反应式为2I--2e-=I2,淀粉遇碘显蓝色,所以试纸变蓝,D为阴极,水电离产生的H+放电,使D极附近呈碱性,使酚酞变红。
(3)写出电极反应式:
B中 ;?
D端 。?
素 养 提 升
图T4-3
4OH--4e-=2H2O+O2↑
4H2O+4e-=2H2↑+4OH-
[解析] (3)B电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2,闭合开关S1,则电流表的指针是否发生偏转? (填“偏转”或“不偏转”)。?
素 养 提 升
图T4-3
偏转
[解析] (4)如果切断S2,闭合S1,则可由A中的H2、B中的O2与KOH溶液形成H2-O2燃料电池,把化学能变为电能,因此指针偏转。
[归纳小结] 分析电解问题的基本思路模式
1.通电前
电解池溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
2.通电后
阴离子移向阳极、阳离子移向阴极,结合放电顺序分析谁优先放电。
素 养 提 升
3.写电极反应式,并结合题目要求得出结论,如两极现象、水的电离平衡移动、离子浓度的变化、pH的变化等。
(1)阴、阳极的判断
①根据电极与电源两极相连的顺序判断。
阴极:与直流电源的负极相连接的电解池中的电极。
阳极:与直流电源的正极相连接的电解池中的电极。
素 养 提 升
②根据电极上的变化判断。
阴极:溶液中氧化性强的阳离子首先在阴极上得电子,发生还原反应,析出金属单质,电极质量增加。
阳极:溶液中还原性强的阴离子失去电子被氧化,或者活性电极本身失去电子被氧化而溶入溶液,使电极质量减小。
③根据电解质溶液里离子移动的方向判断。
在电解质溶液里阳离子总是向阴极作定向移动,阴离子总是向阳极作定向移动。
素 养 提 升
(2)判断电解后溶液的pH变化的方法
根据原溶液的酸碱性和电解产物即可对电解后溶液的pH变化作出正确的判断,其方法如下:
①若电解产物只有H2而无O2,则pH变大;
②若电解产物只有O2而无H2,则pH变小;
③若电解产物既有O2又有H2,原溶液呈酸性则pH变小,原溶液呈碱性则pH变大,原溶液呈中性则pH不变。
素 养 提 升
1.下面有关电化学的图示,完全正确的是 ( )
自 我 检 测
A B C D
图T4-4
D
[解析] 该原电池中,Cu作正极,Zn作负极,A错误;
电解池中,电源正极连接阳极,阳极失去电子,发生氧化反应,电源负极连接阴极,阴极得到电子,发生还原反应,所以粗铜应该
作阳极,失去电子,发生氧化反应,B错误;
据图可知,电源正极连接Fe作阳极,Fe失去
电子,电极反应式为:Fe-2e-=Fe2+,电源负极
连接Zn,Zn作阴极,Fe2++2e-=Fe,即在阴极上镀Fe,C错误;
电解池中,电流从电源正极流出,即碳棒为阳极,电极反应式:2Cl--2e-=Cl2↑,阴极附近生成Cl2使淀粉碘化钾溶液变蓝,铁棒为阴极,电极反应式:2H2O+2e-=2OH-+H2↑,使含有酚酞的溶液变红,D正确。
自 我 检 测
2.通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图T4-5所示,下列说法正确的是 ( )
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6
LiM1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
自 我 检 测
图T4-5
C
[解析] 放电时,电子由石墨电极流向磷酸铁锂电极,则电流由磷酸铁锂电极流向石墨电极,A错误;
根据电池结构可知,该电池的总反应方程式为M1-xFexPO4+LiC6 LiM1-xFexPO4+6C,B错误;
放电时,石墨电极为负极,负极反应式为
LiC6-e-=Li++6C,C正确;
放电时,Li+移向磷酸铁锂电极,充电时
Li+移向石墨电极,D错误。
自 我 检 测
图T4-5
3.如图T4-6,某同学设计了一个燃料电池并
探究氯碱工业的原理和粗铜的精炼原理,
其中乙装置中的X为阳离子交换膜。请按
要求回答相关问题:(1)甲烷燃料电池的负极
反应为 。?
自 我 检 测
图T4-6
CH4-8e-+10OH-=CO32?+7H2O
?
[解析] (1)甲烷燃料电池负极上发生氧化反应,即甲烷在负极上被氧化。在KOH溶液中甲烷被氧化后生成碳酸钾,负极反应为CH4-8e-+10OH-=CO32?+7H2O。
?
(2)石墨(C)极的电极反应为 。
自 我 检 测
图T4-6
2Cl--2e-=Cl2↑
[解析] (2)原电池的负极与电解池的阴极相接,铁极为阴极,则C极为阳极,在C极上发生氧化反应,电极反应为2Cl--2e-=Cl2↑。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的体积为 L;丙装置中阴极析出铜的质量为 g。?
自 我 检 测
图T4-6
4.48
12.8
[解析] (3)n(O2)=2.24?L22.4?L·mol?1=0.1 mol,甲池中正极反应为O2+4e-+2H2O=4OH-,由电子守恒知,经过甲、乙、丙装置的电子的物质的量为0.4 mol。乙池中的铁电极与甲池的负极相连,铁电极为阴极,发生还原反应,电极反应为2H2O+2e-=2OH-+H2↑,n(H2)=0.4mol2=0.2 mol,V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。丙池中精铜为阴极,发生还原反应,电极反应为Cu2++2e-=Cu,n(Cu)=0.4mol2=0.2 mol,m(Cu)=0.2 mol×64 g·mol-1=12.8 g。
?
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图T4-7)。
若用于制漂白液,a为电池的 极,电解质
溶液最好用 。?
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用
作电极。?
自 我 检 测
图T4-7
负
饱和氯化钠溶液(或饱和食盐水)
铁
[解析] (4)漂白液的有效成分是次氯酸盐,制备原理是
2Cl-+2H2O 2OH-+Cl2↑+H2↑,Cl2+2OH-=Cl-+ClO-+H2O,
气体与液体反应,最好采用逆向接触,即气体在下端产生,
碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,
上端为阴极,阴极与电源负极相连,故a极为负极,生活中常见
且廉价的氯化物是氯化钠,故电解质溶液最好用饱和氯化钠
溶液。若制备氢氧化亚铁,用硫酸钠溶液作电解质溶液,选用铁作阳极。
自 我 检 测
图T4-7
4.按如图T4-8装置实验,A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出。又测得A杯溶液中NaOH的质量分数为10.23%。试回答:
(1)电源P为 极。?
(2)b极产生气体的体积为 L(标准状况)。?
(3)c极上析出Cu的质量为 g。?
(4)d极上所发生的电极反应式:
。?
自 我 检 测
图T4-8
负
2.8
16
2H2O-4e-=O2↑+4H+
[解析] B烧杯中c极上有金属析出,说明它为阴极,由此可知,d、b为阳极,a为阴极。按照“正接阳,负接阴”的规律,电源P为负极。电解NaOH溶液的实质是电解水,a极产生H2,b极产生O2;电解CuSO4溶液时,d极产生O2,其电极反应式为2H2O-4e-=O2↑+4H+。m(NaOH)=200 g×10%=20 g。电解后
溶液的质量为20?g10.23%=195.5 g。被电解的水为200 g-195.5 g
=4.5 g,为0.25 mol。由此可知,b极产生的O2为0.125 mol,
即2.8 L。根据电子守恒,可得0.125 mol×4=n(Cu)×2,n(Cu)=
0.25 mol,即16 g。
?
自 我 检 测
图T4-8
https://www.21cnjy.com/help/help_extract.php
