2020-2021学年 高中化学新人教版选择性必修1 第4章实验活动4 简单的电镀实验课件(11张)
文档属性
| 名称 | 2020-2021学年 高中化学新人教版选择性必修1 第4章实验活动4 简单的电镀实验课件(11张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 16:39:01 | ||
图片预览




文档简介
人教(2019)版 选择性必修一
第四章 化学反应与电能
实验活动4 简单的电镀实验
实验活动4 简单的电镀实验
【实验目的】
1.认识电解原理及其在工业生产中的应用。
2.了解电镀的原理。
【实验用品】
烧杯、砂纸、导线、2~3 V的直流电源。
铁制镀件、铜片、电镀液(以CuSO4溶液为主配制)、1 mol·L-1 NaOH溶液、20%盐酸。
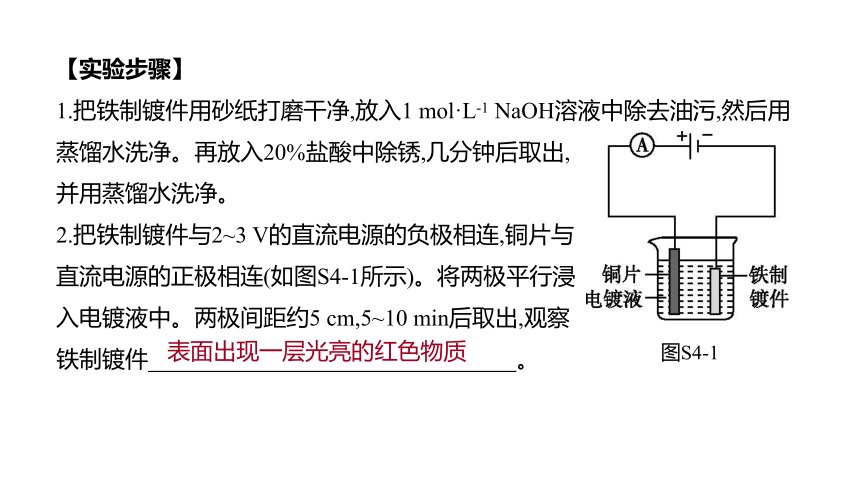
【实验步骤】
1.把铁制镀件用砂纸打磨干净,放入1 mol·L-1 NaOH溶液中除去油污,然后用蒸馏水洗净。再放入20%盐酸中除锈,几分钟后取出,
并用蒸馏水洗净。
2.把铁制镀件与2~3 V的直流电源的负极相连,铜片与
直流电源的正极相连(如图S4-1所示)。将两极平行浸
入电镀液中。两极间距约5 cm,5~10 min后取出,观察
铁制镀件 。?
图S4-1
表面出现一层光亮的红色物质
【问题和讨论】
电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直流电源的正极相连,通电后观察到的现象是什么?阳极和阴极发生的反应分别是什么?
提示:铁制镀件逐渐溶解,铜片逐渐增粗。
阳极发生的反应:Fe-2e-= Fe2+
阴极发生的反应:Cu2++2e-= Cu
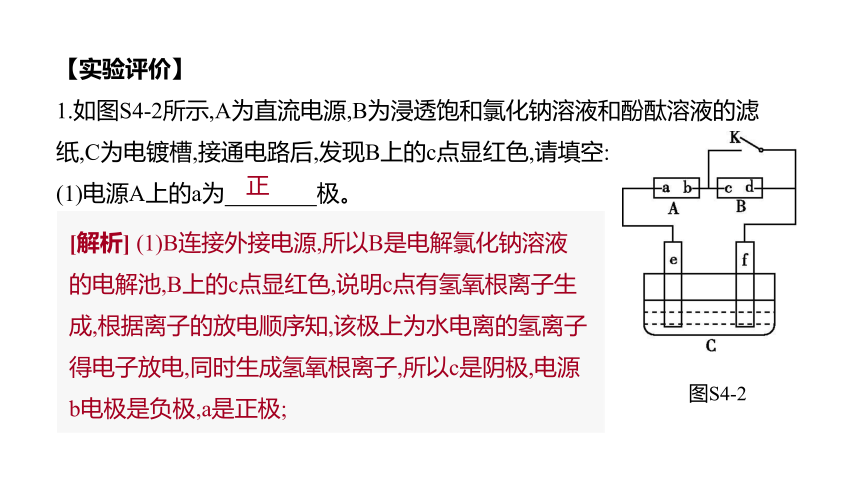
【实验评价】
1.如图S4-2所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极。?
图S4-2
正
[解析] (1)B连接外接电源,所以B是电解氯化钠溶液的电解池,B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上为水电离的氢离子得电子放电,同时生成氢氧根离子,所以c是阴极,电源b电极是负极,a是正极;
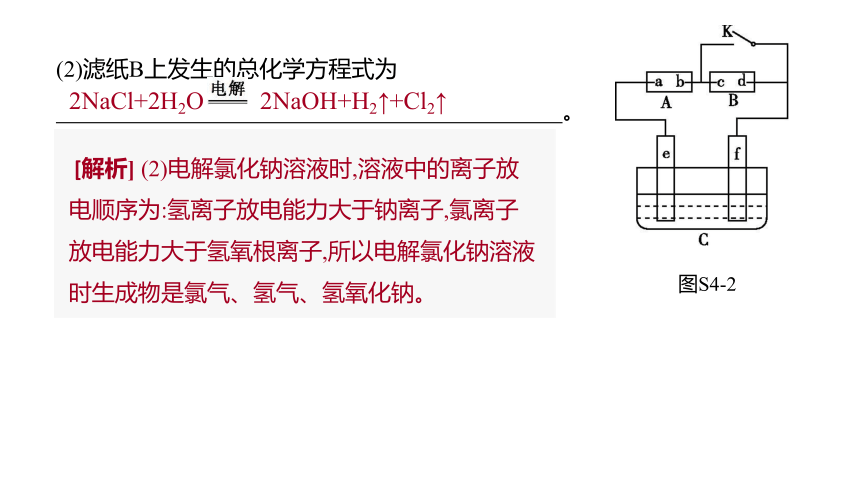
(2)滤纸B上发生的总化学方程式为
。?
图S4-2
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
[解析] (2)电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠溶液时生成物是氯气、氢气、氢氧化钠。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为 ,槽中盛放的镀液可以是 溶液。?
图S4-2
Zn-2e-=Zn2+
Zn2++2e-=Zn
ZnCl2(ZnSO4)(合理即可)
[解析] (3)电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上Zn失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极e上电极反应式为Zn-2e-=Zn2+;阴极f上的电极反应式为Zn2++2e-=Zn;电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnCl2(ZnSO4)溶液作电镀液。
2.电解原理在化学工业中有广泛应用。如图S4-3表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
①Y电极上的电极反应式为 。?
在X极附近观察到的现象是 。?
②电解总反应离子方程式为
。?
2Cl-+2H2O 2OH-+Cl2↑+H2↑
图S4-3
2Cl--2e-=Cl2↑
有气泡产生,溶液变红
[解析] (1)①Y为阳极,阴离子在阳极得到电子,电解食盐水时阳极电极反应式为2Cl--2e-=Cl2↑,X为阴极,阴极电极反应式为2H++2e-=H2↑,c(H+)减小,溶液显碱性,所以在X极可以看到有气泡产生,溶液变红。
图S4-3
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
①Y电极的材料是 (选填“纯铁”“纯铜”或“纯锌”),
电极反应式是 。电解液a选用 溶液,
电解过程中其浓度 (选填“增大”“减小”或“不变”)。?
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。?
图S4-3
纯铜
Cu-2e-=Cu2+
CuSO4
不变
0.08
[解析] (2)要在铁件的表面镀铜,铁为镀件、铜为镀层金属,
所以铁作阴极,铜作阳极,电解质溶液为硫酸铜溶液,①铁件
的表面镀铜时,铜作阳极,在阳极铜失去电子,所以Y极为纯铜,
电极反应式为Cu-2e-=Cu2+,电解过程中CuSO4浓度不变。
②电镀时阳极Cu溶解,阴极Cu析出,两极得失电子数相等,
所以溶解的铜和析出的铜质量相等,溶解的铜为5.12?g2=2.56 g,
n(Cu)=2.56?g64?g·mol?1=0.04 mol,因为Cu-2e-=Cu2+,故通过电路中的电子为2×0.04 mol=0.08 mol。
?
图S4-3
https://www.21cnjy.com/help/help_extract.php
第四章 化学反应与电能
实验活动4 简单的电镀实验
实验活动4 简单的电镀实验
【实验目的】
1.认识电解原理及其在工业生产中的应用。
2.了解电镀的原理。
【实验用品】
烧杯、砂纸、导线、2~3 V的直流电源。
铁制镀件、铜片、电镀液(以CuSO4溶液为主配制)、1 mol·L-1 NaOH溶液、20%盐酸。
【实验步骤】
1.把铁制镀件用砂纸打磨干净,放入1 mol·L-1 NaOH溶液中除去油污,然后用蒸馏水洗净。再放入20%盐酸中除锈,几分钟后取出,
并用蒸馏水洗净。
2.把铁制镀件与2~3 V的直流电源的负极相连,铜片与
直流电源的正极相连(如图S4-1所示)。将两极平行浸
入电镀液中。两极间距约5 cm,5~10 min后取出,观察
铁制镀件 。?
图S4-1
表面出现一层光亮的红色物质
【问题和讨论】
电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直流电源的正极相连,通电后观察到的现象是什么?阳极和阴极发生的反应分别是什么?
提示:铁制镀件逐渐溶解,铜片逐渐增粗。
阳极发生的反应:Fe-2e-= Fe2+
阴极发生的反应:Cu2++2e-= Cu
【实验评价】
1.如图S4-2所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极。?
图S4-2
正
[解析] (1)B连接外接电源,所以B是电解氯化钠溶液的电解池,B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上为水电离的氢离子得电子放电,同时生成氢氧根离子,所以c是阴极,电源b电极是负极,a是正极;
(2)滤纸B上发生的总化学方程式为
。?
图S4-2
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
[解析] (2)电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠溶液时生成物是氯气、氢气、氢氧化钠。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为 ,槽中盛放的镀液可以是 溶液。?
图S4-2
Zn-2e-=Zn2+
Zn2++2e-=Zn
ZnCl2(ZnSO4)(合理即可)
[解析] (3)电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上Zn失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极e上电极反应式为Zn-2e-=Zn2+;阴极f上的电极反应式为Zn2++2e-=Zn;电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnCl2(ZnSO4)溶液作电镀液。
2.电解原理在化学工业中有广泛应用。如图S4-3表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
①Y电极上的电极反应式为 。?
在X极附近观察到的现象是 。?
②电解总反应离子方程式为
。?
2Cl-+2H2O 2OH-+Cl2↑+H2↑
图S4-3
2Cl--2e-=Cl2↑
有气泡产生,溶液变红
[解析] (1)①Y为阳极,阴离子在阳极得到电子,电解食盐水时阳极电极反应式为2Cl--2e-=Cl2↑,X为阴极,阴极电极反应式为2H++2e-=H2↑,c(H+)减小,溶液显碱性,所以在X极可以看到有气泡产生,溶液变红。
图S4-3
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
①Y电极的材料是 (选填“纯铁”“纯铜”或“纯锌”),
电极反应式是 。电解液a选用 溶液,
电解过程中其浓度 (选填“增大”“减小”或“不变”)。?
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。?
图S4-3
纯铜
Cu-2e-=Cu2+
CuSO4
不变
0.08
[解析] (2)要在铁件的表面镀铜,铁为镀件、铜为镀层金属,
所以铁作阴极,铜作阳极,电解质溶液为硫酸铜溶液,①铁件
的表面镀铜时,铜作阳极,在阳极铜失去电子,所以Y极为纯铜,
电极反应式为Cu-2e-=Cu2+,电解过程中CuSO4浓度不变。
②电镀时阳极Cu溶解,阴极Cu析出,两极得失电子数相等,
所以溶解的铜和析出的铜质量相等,溶解的铜为5.12?g2=2.56 g,
n(Cu)=2.56?g64?g·mol?1=0.04 mol,因为Cu-2e-=Cu2+,故通过电路中的电子为2×0.04 mol=0.08 mol。
?
图S4-3
https://www.21cnjy.com/help/help_extract.php
