2020-2021学年高中化学新人教版选择性必修1 第三章第二节 水的电离和溶液的pH(第1课时) 课件(24张)
文档属性
| 名称 | 2020-2021学年高中化学新人教版选择性必修1 第三章第二节 水的电离和溶液的pH(第1课时) 课件(24张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-28 15:52:52 | ||
图片预览






文档简介
人教(2019)版 选择性必修一
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第1课时 水的电离
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第1课时 水的电离
1.认识水的电离。
2.了解水的离子积常数。了解水的电离平衡及影响因素。
课程目标
水的电离
[基础?初探]
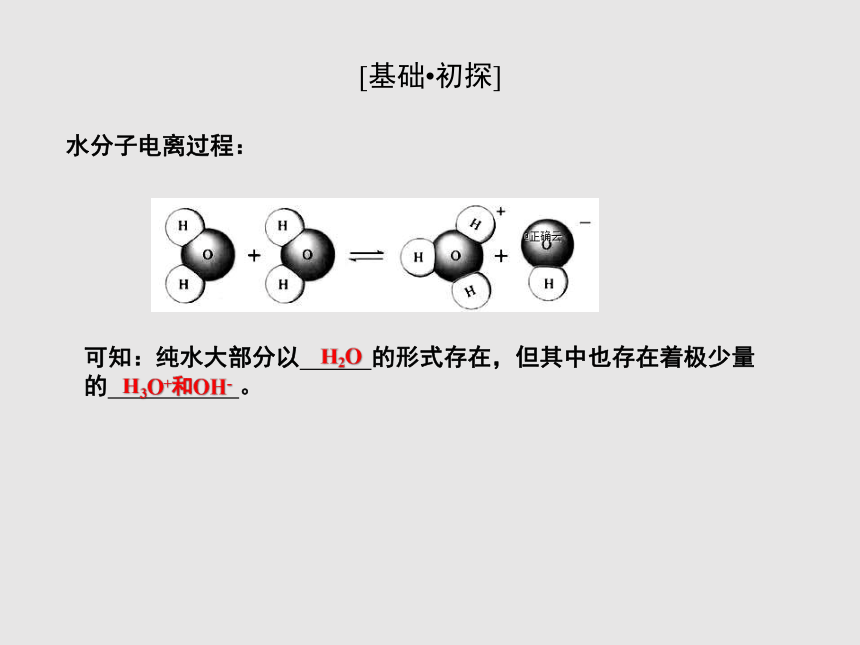
水分子电离过程:
可知:纯水大部分以 的形式存在,但其中也存在着极少量的 。
H2O
H3O+和OH-
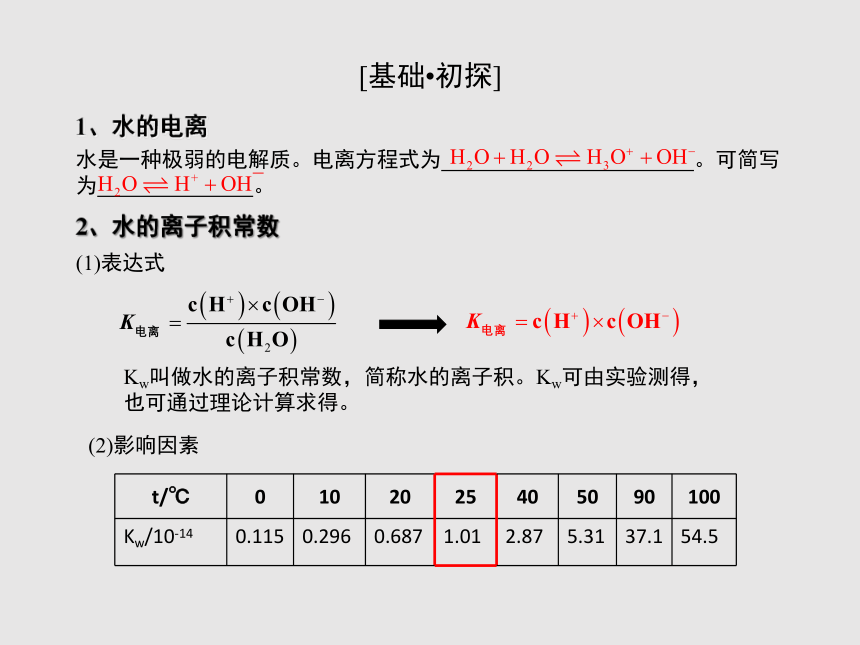
水是一种极弱的电解质。电离方程式为 。可简写为 。
[基础?初探]
2、水的离子积常数
1、水的电离
(1)表达式
Kw叫做水的离子积常数,简称水的离子积。Kw可由实验测得,也可通过理论计算求得。
(2)影响因素
{5940675A-B579-460E-94D1-54222C63F5DA}t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
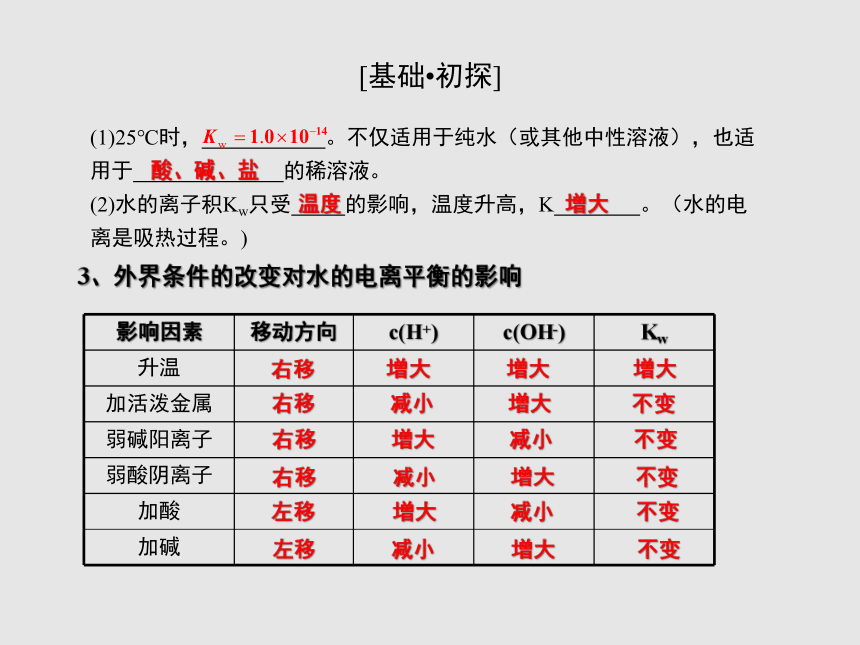
(1)25℃时, 。不仅适用于纯水(或其他中性溶液),也适用于 的稀溶液。
(2)水的离子积Kw只受 的影响,温度升高,K 。(水的电离是吸热过程。)
[基础?初探]
增大
3、外界条件的改变对水的电离平衡的影响
{5940675A-B579-460E-94D1-54222C63F5DA}影响因素
移动方向
c(H+)
c(OH-)
Kw
升温
加活泼金属
弱碱阳离子
弱酸阴离子
加酸
加碱
增大
增大
右移
增大
不变
减小
右移
增大
不变
增大
右移
减小
不变
减小
右移
增大
不变
增大
左移
减小
不变
减小
左移
增大
酸、碱、盐
温度
[课堂?专练]
×
×
×
√
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[基础?初探]
?名师点拨
水的电离平衡类题的解答步骤
{5940675A-B579-460E-94D1-54222C63F5DA}解题步骤
解题注意事项
第一步:写电
离方程式
写出水的电离方程式与水的离子积表达式,并熟悉离子积表达式中各量之间的关系
第二步:分析
加入的物质
分析加入物质后,该物质电离出的离子的性质或该物质与水反应后的离子的性质,分析这些离子对水的电离的影响
第三步:确定
合理选项
根据以上分析,对比四个选项,确定正确的答案
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[基础?初探]
?名师点拨
(1)无论水的电离程度是增大还是减小,纯水都呈中性。
(2)Kw只受温度影响,稀酸和稀碱溶液中Kw=10-14。
(3)改变c(OH-)或c(H+),只能改变水的电离程度,不能改变Kw。
(4)改变温度,Kw和水的电离程度都改变。
https://www.21cnjy.com/help/help_extract.php
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第1课时 水的电离
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第1课时 水的电离
1.认识水的电离。
2.了解水的离子积常数。了解水的电离平衡及影响因素。
课程目标
水的电离
[基础?初探]
水分子电离过程:
可知:纯水大部分以 的形式存在,但其中也存在着极少量的 。
H2O
H3O+和OH-
水是一种极弱的电解质。电离方程式为 。可简写为 。
[基础?初探]
2、水的离子积常数
1、水的电离
(1)表达式
Kw叫做水的离子积常数,简称水的离子积。Kw可由实验测得,也可通过理论计算求得。
(2)影响因素
{5940675A-B579-460E-94D1-54222C63F5DA}t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
(1)25℃时, 。不仅适用于纯水(或其他中性溶液),也适用于 的稀溶液。
(2)水的离子积Kw只受 的影响,温度升高,K 。(水的电离是吸热过程。)
[基础?初探]
增大
3、外界条件的改变对水的电离平衡的影响
{5940675A-B579-460E-94D1-54222C63F5DA}影响因素
移动方向
c(H+)
c(OH-)
Kw
升温
加活泼金属
弱碱阳离子
弱酸阴离子
加酸
加碱
增大
增大
右移
增大
不变
减小
右移
增大
不变
增大
右移
减小
不变
减小
右移
增大
不变
增大
左移
减小
不变
减小
左移
增大
酸、碱、盐
温度
[课堂?专练]
×
×
×
√
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[基础?初探]
?名师点拨
水的电离平衡类题的解答步骤
{5940675A-B579-460E-94D1-54222C63F5DA}解题步骤
解题注意事项
第一步:写电
离方程式
写出水的电离方程式与水的离子积表达式,并熟悉离子积表达式中各量之间的关系
第二步:分析
加入的物质
分析加入物质后,该物质电离出的离子的性质或该物质与水反应后的离子的性质,分析这些离子对水的电离的影响
第三步:确定
合理选项
根据以上分析,对比四个选项,确定正确的答案
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[课堂?专练]
[基础?初探]
?名师点拨
(1)无论水的电离程度是增大还是减小,纯水都呈中性。
(2)Kw只受温度影响,稀酸和稀碱溶液中Kw=10-14。
(3)改变c(OH-)或c(H+),只能改变水的电离程度,不能改变Kw。
(4)改变温度,Kw和水的电离程度都改变。
https://www.21cnjy.com/help/help_extract.php
