鲁教版选修共价键模型
图片预览





文档简介
(共16张PPT)
山东科技版选修·结构化学,高二,山东省莱芜市第五中学 耿华田,271121,weiwunengqu@;创新点:图片丰富,简单实用。
第2章 化学键与分子间作用力
第1节 共价键模型
第1课时 共价键
一.共价键形成和本质
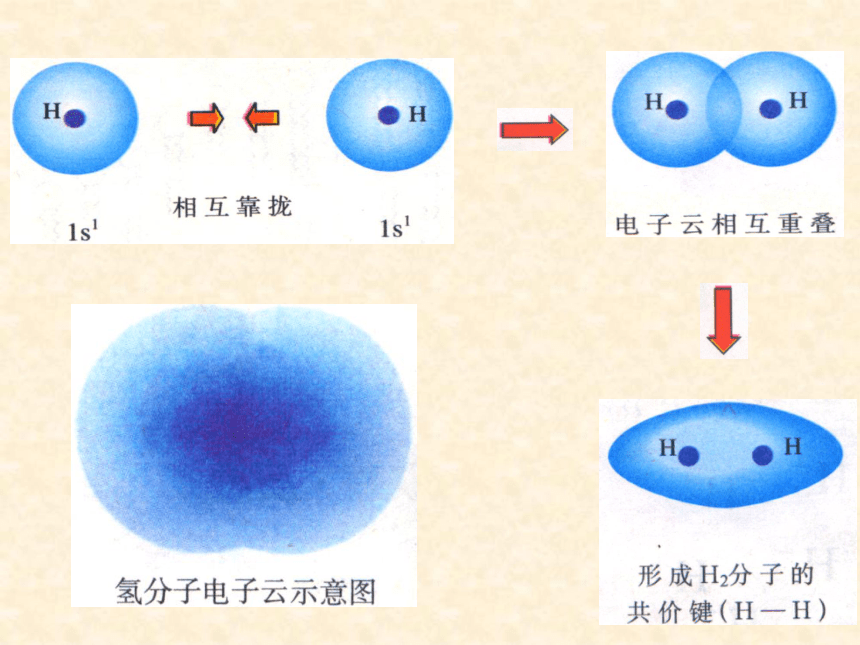
1.氢分子形成示意图
(1)氢原子间距离与能量的关系
(2)为什么会出现这种情况
a.通常电负性相同或差值小的非金属元素原子形成的化学键
b.成键原子一般有未成对电子,用来相互配对成键
c.成键原子的原子轨道在空间重叠使体系能量降低
3.共价键的形成条件
2.共价键的本质:
高概率地出现在两个原子核间的电子与
两个原子核之间的电性作用是共价键的本质
4. 共价键的分类(根据共用电子对数)
单键 双键 叁键
【巩固练习1】
下列哪组原子之间可以形成共价键?
Na和F H和C Mg和Cl
二、共价键的特征
(1)饱和性
原子有几个未成对电子就形成几个共价键
(2)方向性
共价键将尽可能沿着电子出现概率最大的方向形成
因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性
是不是所有的共价键都具有方向性?
问题:
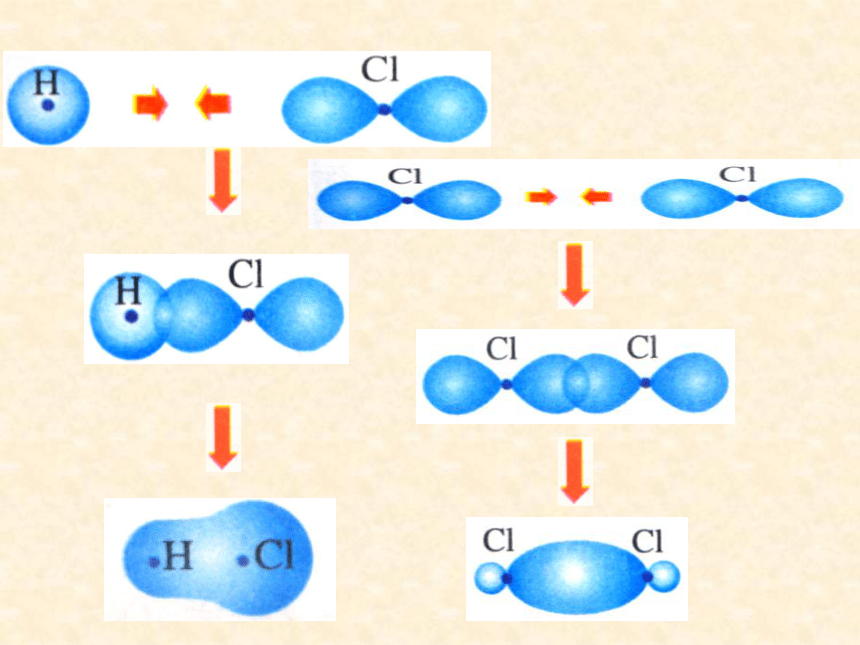
1.σ键:“头碰头”
X
+
+
s—s
X
+
+
-
px—s
+
-
-
+
X
px—px
原子轨道以头碰头方式形成的共价键,叫σ键
三、共价键的类型
σ键的类型
2.π键:“肩并肩”
+
I
X
Z
Z
pZ—pZ
原子轨道以肩并肩方式形成的共价键,叫π键
+
I
【巩固练习2】
下列分子中的共价键是σ键,还是π键?
Cl2 HBr H2S CH2=CH2
非极性键——共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
极性键——共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
四.极性键和非极性键
【巩固练习3】
下列元素原子间哪些存在共价键?
哪些属于极性键?哪些属于非极性键?
O2 HBr NH3 He
共价键的分类
根据共用电子对个数
根据原子轨道的重叠方式
根据成键原子吸引电子能力
【总结提高】
单键 双键 叁键
σ键 π键
极性键 非极性键
山东科技版选修·结构化学,高二,山东省莱芜市第五中学 耿华田,271121,weiwunengqu@;创新点:图片丰富,简单实用。
第2章 化学键与分子间作用力
第1节 共价键模型
第1课时 共价键
一.共价键形成和本质
1.氢分子形成示意图
(1)氢原子间距离与能量的关系
(2)为什么会出现这种情况
a.通常电负性相同或差值小的非金属元素原子形成的化学键
b.成键原子一般有未成对电子,用来相互配对成键
c.成键原子的原子轨道在空间重叠使体系能量降低
3.共价键的形成条件
2.共价键的本质:
高概率地出现在两个原子核间的电子与
两个原子核之间的电性作用是共价键的本质
4. 共价键的分类(根据共用电子对数)
单键 双键 叁键
【巩固练习1】
下列哪组原子之间可以形成共价键?
Na和F H和C Mg和Cl
二、共价键的特征
(1)饱和性
原子有几个未成对电子就形成几个共价键
(2)方向性
共价键将尽可能沿着电子出现概率最大的方向形成
因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性
是不是所有的共价键都具有方向性?
问题:
1.σ键:“头碰头”
X
+
+
s—s
X
+
+
-
px—s
+
-
-
+
X
px—px
原子轨道以头碰头方式形成的共价键,叫σ键
三、共价键的类型
σ键的类型
2.π键:“肩并肩”
+
I
X
Z
Z
pZ—pZ
原子轨道以肩并肩方式形成的共价键,叫π键
+
I
【巩固练习2】
下列分子中的共价键是σ键,还是π键?
Cl2 HBr H2S CH2=CH2
非极性键——共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
极性键——共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
四.极性键和非极性键
【巩固练习3】
下列元素原子间哪些存在共价键?
哪些属于极性键?哪些属于非极性键?
O2 HBr NH3 He
共价键的分类
根据共用电子对个数
根据原子轨道的重叠方式
根据成键原子吸引电子能力
【总结提高】
单键 双键 叁键
σ键 π键
极性键 非极性键
