新疆昌吉教育共同体2020-2021学年高二下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 新疆昌吉教育共同体2020-2021学年高二下学期期中考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 439.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-01 22:24:54 | ||
图片预览



文档简介
昌吉教育共同体2020-2021学年第二学期
高二年级化学学科期中质量检测试卷
满分:100分 考试时间:90分钟
可能用到的元素相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 Cu 64 Zn 65
一、选择题(每题2分,共50分)
1.下列对于电化学说法正确的是( )
A.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
B.电解精炼铜时,阳极泥中常含有金属金、银、锌等
C.可充电电池放电时,化学能转变为电能
D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
2.Cu—Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是
A.锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
B.铜极反应:2H++2e-=H2↑,锌片溶解16.25g
C.电流由锌极经导线流向铜极
D.溶液中SO42-移向铜极
3.下列有关电化学装置的说法正确的是
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
4.下列电极反应式与出现的环境相匹配的是( )
选项 电极反应式 出现的环境
A O2+4H++4e-=2H2O 酸性环境下氢氧燃料电池的负极反应
B 4OH--4e-=O2↑+2H2O 弱酸性环境下钢铁的吸氧腐蚀
C Cu-2e-=Cu2+ 用铜做电极电解硫酸铜溶液的阳极反应
D Na++e-=Na 用惰性电极电解Na2SO4溶液的阴极反应
5.近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是
A.1mol乙醇被氧化转移6mol电子
B.C2H5OH在电池的负极上参加反应
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应式为4H++O2+4e-=2H2O
6.银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O2Ag + Zn(OH)2 ,下列说法正确的是
A.放电时Ag2O参与反应的电极为负极
B.放电时正极附近的pH逐渐减小
C.充电时阴极的电极反应为:Zn(OH)2 + 2e- = Zn + 2OH-
D.充电时每生成1 mol Ag2O转移1 mol电子
7.某原电池构造如图所示。下列有关叙述正确的是( )
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.2mol电子,铜的质量理论上减小12.8g
D.原电池的总反应式为Cu +2AgNO3 ==== 2Ag +Cu(NO3)2
8.传统接触法制取硫酸能耗大,污染严重。将燃料电池引入硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如图所示。下列说法不正确的是( )
A.b为正极,电极反应式为O2+4H++4e-===2H2O
B.H+由a极通过质子交换膜向b极移动
C.该燃料电池的总反应为2SO2+O2+2H2O===2H2SO4
D.若a电极消耗标况下2.24 L SO2,理论上在c极上有6.4 g
铜析出
9.由中国近代化学启蒙者徐寿确认汉译名的下列元素中,属于d区元素的是
A.Ca B.Ni C.Zn D.Ga
10.下列各原子或离子的电子排布式错误的是
A.Mg2+1s22s22p6 B.Br 1s22s22p63s23p63d104s24p5
C.O2-1s22s22p6 D.Cr 1s22s22p63s23p63d44s2
11.下列各组表述中,两种微粒不属于同种元素原子的是
A.3p能级有一个空轨道的基态原子和核外电子排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p63d64s2的原子
D.最外层电子数是核外电子总数的1/5的原子和最外层电子排布式为4s24p5的原子
12.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5。则下列有关说法中正确的是( )
A.核电荷数最大的是③ B.原子半径最大的是①
C.电负性最小的是③ D.最外层电子数最多的是④
13.X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
元素 相关信息
X X的基态原子L层电子数是K层的2倍
Y Y的基态原子最外层电子排布式为nsnnpn+2
Z Z存在质量数为23,中子数为12的核素
W W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
下列说法不正确的是( )
A.W是Fe元素 B.X的电负性比Y的大
C.Z2Y2中阴离子和阳离子个数比为1:2 D.XY2是一种直线形分子
14.下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe2+原子的外围电子排布式为3d6
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
15.已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.元素的第一电离能:A>B>D>C
16.若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是( )
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有8个电子 D.该元素原子M电子层共有8个电子
17.下列各项叙述中正确的是 ( )
A.电子层序数越大,s原子轨道的形状相同,半径越大
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
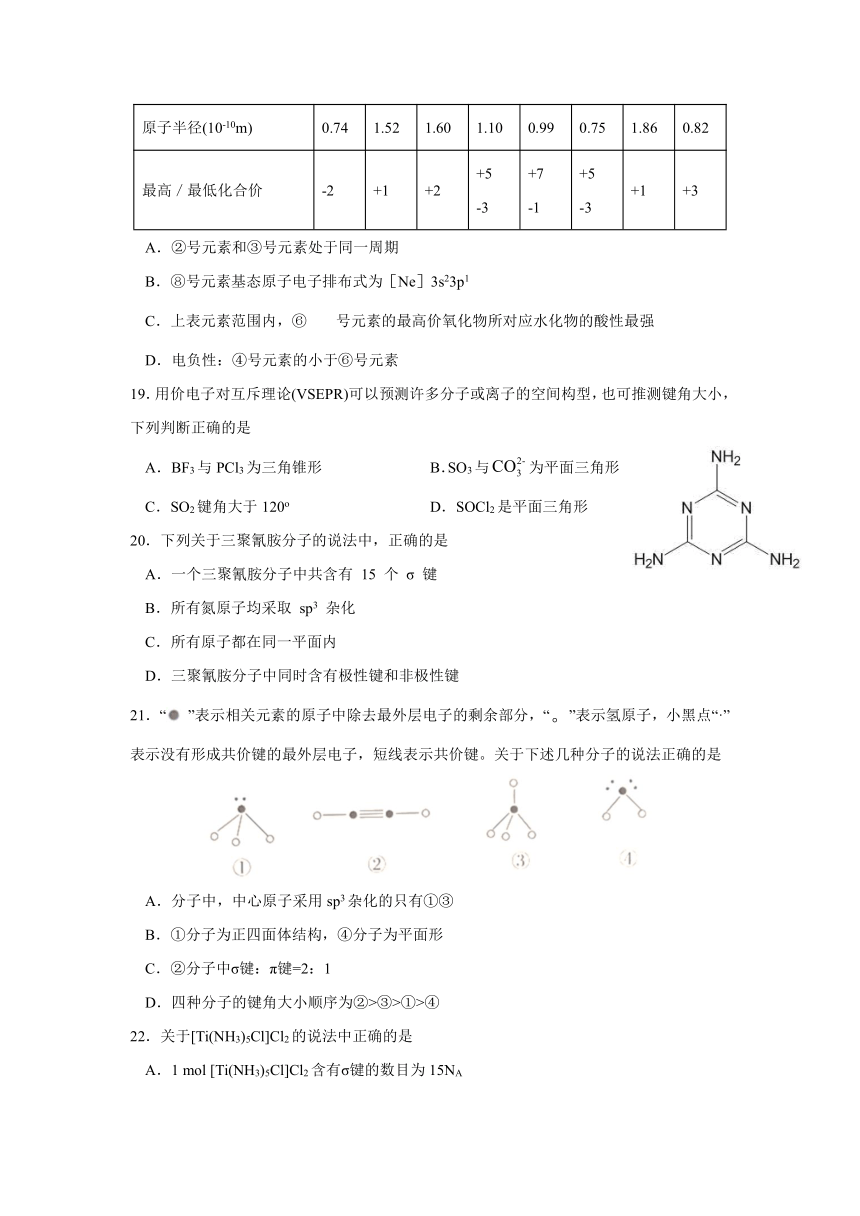
18.下表列出短周期8种元素的部分性质,其中叙述正确的是( )
原子序数 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径(10-10m) 0.74 1.52 1.60 1.10 0.99 0.75 1.86 0.82
最高/最低化合价 -2 +1 +2 +5
-3 +7
-1 +5
-3 +1 +3
A.②号元素和③号元素处于同一周期
B.⑧号元素基态原子电子排布式为[Ne]3s23p1
C.上表元素范围内,⑥号元素的最高价氧化物所对应水化物的酸性最强
D.电负性:④号元素的小于⑥号元素
19.用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.BF3与PCl3为三角锥形 B.SO3与为平面三角形
C.SO2键角大于120o D.SOCl2是平面三角形
20.下列关于三聚氰胺分子的说法中,正确的是
A.一个三聚氰胺分子中共含有 15 个 σ 键
B.所有氮原子均采取 sp3 杂化
C.所有原子都在同一平面内
D.三聚氰胺分子中同时含有极性键和非极性键
21.“ ”表示相关元素的原子中除去最外层电子的剩余部分,“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。关于下述几种分子的说法正确的是
A.分子中,中心原子采用sp3杂化的只有①③
B.①分子为正四面体结构,④分子为平面形
C.②分子中σ键:π键=2:1
D.四种分子的键角大小顺序为②>③>①>④
22.关于[Ti(NH3)5Cl]Cl2的说法中正确的是
A.1 mol [Ti(NH3)5Cl]Cl2含有σ键的数目为15NA
B.中心原子的化合价为+3价
C.中心原子的配位数是5
D.含1 mol [Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生3 mol白色沉淀
23.下列不能形成配位键的组合是
A.、 B.、 C.、H+ D.、
24.X、Y、Z 为短周期元素,X 原子最外层只有一个电子,Y 原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的 3 倍。下列 有关叙述正确的是
A.Y 的价电子排布式为3s23p4 B.简单氢化物稳定性:Y>Z
C.第一电离能:Y>Z D.X、Y两元素形成的化合物一定为离子化合物
25.X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A.EYQ4 中阴离子中心原子的杂化方式为sp3杂化
B.X、Y元素的第一电离能大小关系:XC.ZO32?的空间构型为V形
D.MO2含离子键和非极性共价键,阴阳离子之比为2:1
二、非选择题(共50分)
26.(10分)(1)如图为氢-氧燃料电池装置示意图。其中A为KOH,C为多孔惰性电极。
①在该电池工作时,a是________极(1分);b电极的电极反应方程式是______________________。(2分)
②若将进口a的燃料换成CH4,则a电极的电极方程式为_________________________________。(2分)
(2)如图为氯碱工业电解饱和氯化钠溶液的装置示意图。
①电解时,电解池总反应的离子反应方程式为___________。(2分)
②逸出的气体D是___________(1分);流出的物质G是___________(1分)。
③该电解池中离子交换膜属于_______________________(填“阳离子交换膜”或“阴离子交换膜”)(1分)。
27.(共10分,每空1分)A、B、C、D、E、F、G代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为________。此元素简单氢化物的空间构型为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的基态原子的电子式为____________________________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的价电子排布图为__________________________。
(4)E为元素周期表前四周期基态原子未成对电子最多的元素,E元素的价电子排布式为_____________。
(5)F为33号元素,其基态原子的电子排布式为[Ar]__________________。
(6)G元素为第四周期与O同主族的元素,其最高价氧化物对应水化物的化学式为________,此物质中G原子的杂化类型为_____________。
28.(共10分,每空1分)(1)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
①K4[Fe(CN)6]中的作用力除C、N原子间的共价键外,还有___________和_______________。
②黄血盐中N原子的杂化方式为____________;C、N、O的电负性由大到小的排序为_______________。
(2)新型储氢材料是开发利用氢能的研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
①基态Cl原子有_____种空间运动状态的电子,属于____区(填“s”或“p”或“d”或“f”)
②LiBH4由Li+和BH4-构成,与BH4-互为等电子体的分子为__________,Li、Be、B元素的第一电离能由大到小排列顺序为________。
③LiH中,离子半径:Li+_________H-(填“>”、“=”或“<”)。
④某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1 I4/kJ·mol-1
580 1820 2750 11600
M是_________(填元素符号)。
(10分)
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。(2分,其它空1分)
A.[Ne] B.[Ne] C.[Ne] D.[Ne]
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(3)Cu2+基态核外电子排布式为__________________。
(4)Mn位于元素周期表中第四周期________族,基态Mn原子核外未成对电子有________个。
(5)丙酮()分子中碳原子轨道的杂化类型是_____、______。
(6)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是___________。
30.(10分)(1)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(2)NH4H2PO4中,P的杂化轨道与O的2p轨道形成_______键(填σ或π)。
(3)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。
(4)H2S的空间构型为________;结合等电子体的知识判断离子的空间构型为________。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子中心原子的杂化形式为________。LiAlH4中,存在______________(2分,其它空1分)(填标号)。
A.离子键 B.σ键 C.π键 D.配位键
高二年级化学学科期中质量检测试卷
满分:100分 考试时间:90分钟
可能用到的元素相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 Cu 64 Zn 65
一、选择题(每题2分,共50分)
1.下列对于电化学说法正确的是( )
A.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
B.电解精炼铜时,阳极泥中常含有金属金、银、锌等
C.可充电电池放电时,化学能转变为电能
D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
2.Cu—Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是
A.锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
B.铜极反应:2H++2e-=H2↑,锌片溶解16.25g
C.电流由锌极经导线流向铜极
D.溶液中SO42-移向铜极
3.下列有关电化学装置的说法正确的是
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
4.下列电极反应式与出现的环境相匹配的是( )
选项 电极反应式 出现的环境
A O2+4H++4e-=2H2O 酸性环境下氢氧燃料电池的负极反应
B 4OH--4e-=O2↑+2H2O 弱酸性环境下钢铁的吸氧腐蚀
C Cu-2e-=Cu2+ 用铜做电极电解硫酸铜溶液的阳极反应
D Na++e-=Na 用惰性电极电解Na2SO4溶液的阴极反应
5.近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是
A.1mol乙醇被氧化转移6mol电子
B.C2H5OH在电池的负极上参加反应
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应式为4H++O2+4e-=2H2O
6.银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O2Ag + Zn(OH)2 ,下列说法正确的是
A.放电时Ag2O参与反应的电极为负极
B.放电时正极附近的pH逐渐减小
C.充电时阴极的电极反应为:Zn(OH)2 + 2e- = Zn + 2OH-
D.充电时每生成1 mol Ag2O转移1 mol电子
7.某原电池构造如图所示。下列有关叙述正确的是( )
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.2mol电子,铜的质量理论上减小12.8g
D.原电池的总反应式为Cu +2AgNO3 ==== 2Ag +Cu(NO3)2
8.传统接触法制取硫酸能耗大,污染严重。将燃料电池引入硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如图所示。下列说法不正确的是( )
A.b为正极,电极反应式为O2+4H++4e-===2H2O
B.H+由a极通过质子交换膜向b极移动
C.该燃料电池的总反应为2SO2+O2+2H2O===2H2SO4
D.若a电极消耗标况下2.24 L SO2,理论上在c极上有6.4 g
铜析出
9.由中国近代化学启蒙者徐寿确认汉译名的下列元素中,属于d区元素的是
A.Ca B.Ni C.Zn D.Ga
10.下列各原子或离子的电子排布式错误的是
A.Mg2+1s22s22p6 B.Br 1s22s22p63s23p63d104s24p5
C.O2-1s22s22p6 D.Cr 1s22s22p63s23p63d44s2
11.下列各组表述中,两种微粒不属于同种元素原子的是
A.3p能级有一个空轨道的基态原子和核外电子排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p63d64s2的原子
D.最外层电子数是核外电子总数的1/5的原子和最外层电子排布式为4s24p5的原子
12.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5。则下列有关说法中正确的是( )
A.核电荷数最大的是③ B.原子半径最大的是①
C.电负性最小的是③ D.最外层电子数最多的是④
13.X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
元素 相关信息
X X的基态原子L层电子数是K层的2倍
Y Y的基态原子最外层电子排布式为nsnnpn+2
Z Z存在质量数为23,中子数为12的核素
W W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
下列说法不正确的是( )
A.W是Fe元素 B.X的电负性比Y的大
C.Z2Y2中阴离子和阳离子个数比为1:2 D.XY2是一种直线形分子
14.下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe2+原子的外围电子排布式为3d6
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
15.已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.元素的第一电离能:A>B>D>C
16.若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是( )
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有8个电子 D.该元素原子M电子层共有8个电子
17.下列各项叙述中正确的是 ( )
A.电子层序数越大,s原子轨道的形状相同,半径越大
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
18.下表列出短周期8种元素的部分性质,其中叙述正确的是( )
原子序数 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径(10-10m) 0.74 1.52 1.60 1.10 0.99 0.75 1.86 0.82
最高/最低化合价 -2 +1 +2 +5
-3 +7
-1 +5
-3 +1 +3
A.②号元素和③号元素处于同一周期
B.⑧号元素基态原子电子排布式为[Ne]3s23p1
C.上表元素范围内,⑥号元素的最高价氧化物所对应水化物的酸性最强
D.电负性:④号元素的小于⑥号元素
19.用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.BF3与PCl3为三角锥形 B.SO3与为平面三角形
C.SO2键角大于120o D.SOCl2是平面三角形
20.下列关于三聚氰胺分子的说法中,正确的是
A.一个三聚氰胺分子中共含有 15 个 σ 键
B.所有氮原子均采取 sp3 杂化
C.所有原子都在同一平面内
D.三聚氰胺分子中同时含有极性键和非极性键
21.“ ”表示相关元素的原子中除去最外层电子的剩余部分,“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。关于下述几种分子的说法正确的是
A.分子中,中心原子采用sp3杂化的只有①③
B.①分子为正四面体结构,④分子为平面形
C.②分子中σ键:π键=2:1
D.四种分子的键角大小顺序为②>③>①>④
22.关于[Ti(NH3)5Cl]Cl2的说法中正确的是
A.1 mol [Ti(NH3)5Cl]Cl2含有σ键的数目为15NA
B.中心原子的化合价为+3价
C.中心原子的配位数是5
D.含1 mol [Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生3 mol白色沉淀
23.下列不能形成配位键的组合是
A.、 B.、 C.、H+ D.、
24.X、Y、Z 为短周期元素,X 原子最外层只有一个电子,Y 原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的 3 倍。下列 有关叙述正确的是
A.Y 的价电子排布式为3s23p4 B.简单氢化物稳定性:Y>Z
C.第一电离能:Y>Z D.X、Y两元素形成的化合物一定为离子化合物
25.X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A.EYQ4 中阴离子中心原子的杂化方式为sp3杂化
B.X、Y元素的第一电离能大小关系:X
D.MO2含离子键和非极性共价键,阴阳离子之比为2:1
二、非选择题(共50分)
26.(10分)(1)如图为氢-氧燃料电池装置示意图。其中A为KOH,C为多孔惰性电极。
①在该电池工作时,a是________极(1分);b电极的电极反应方程式是______________________。(2分)
②若将进口a的燃料换成CH4,则a电极的电极方程式为_________________________________。(2分)
(2)如图为氯碱工业电解饱和氯化钠溶液的装置示意图。
①电解时,电解池总反应的离子反应方程式为___________。(2分)
②逸出的气体D是___________(1分);流出的物质G是___________(1分)。
③该电解池中离子交换膜属于_______________________(填“阳离子交换膜”或“阴离子交换膜”)(1分)。
27.(共10分,每空1分)A、B、C、D、E、F、G代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为________。此元素简单氢化物的空间构型为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的基态原子的电子式为____________________________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的价电子排布图为__________________________。
(4)E为元素周期表前四周期基态原子未成对电子最多的元素,E元素的价电子排布式为_____________。
(5)F为33号元素,其基态原子的电子排布式为[Ar]__________________。
(6)G元素为第四周期与O同主族的元素,其最高价氧化物对应水化物的化学式为________,此物质中G原子的杂化类型为_____________。
28.(共10分,每空1分)(1)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
①K4[Fe(CN)6]中的作用力除C、N原子间的共价键外,还有___________和_______________。
②黄血盐中N原子的杂化方式为____________;C、N、O的电负性由大到小的排序为_______________。
(2)新型储氢材料是开发利用氢能的研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
①基态Cl原子有_____种空间运动状态的电子,属于____区(填“s”或“p”或“d”或“f”)
②LiBH4由Li+和BH4-构成,与BH4-互为等电子体的分子为__________,Li、Be、B元素的第一电离能由大到小排列顺序为________。
③LiH中,离子半径:Li+_________H-(填“>”、“=”或“<”)。
④某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1 I4/kJ·mol-1
580 1820 2750 11600
M是_________(填元素符号)。
(10分)
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。(2分,其它空1分)
A.[Ne] B.[Ne] C.[Ne] D.[Ne]
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(3)Cu2+基态核外电子排布式为__________________。
(4)Mn位于元素周期表中第四周期________族,基态Mn原子核外未成对电子有________个。
(5)丙酮()分子中碳原子轨道的杂化类型是_____、______。
(6)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是___________。
30.(10分)(1)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(2)NH4H2PO4中,P的杂化轨道与O的2p轨道形成_______键(填σ或π)。
(3)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。
(4)H2S的空间构型为________;结合等电子体的知识判断离子的空间构型为________。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子中心原子的杂化形式为________。LiAlH4中,存在______________(2分,其它空1分)(填标号)。
A.离子键 B.σ键 C.π键 D.配位键
同课章节目录
