河北省沧州市河间第四高中2020-2021学年高一下学期期中考试化学试卷 Word版含答案
文档属性
| 名称 | 河北省沧州市河间第四高中2020-2021学年高一下学期期中考试化学试卷 Word版含答案 | 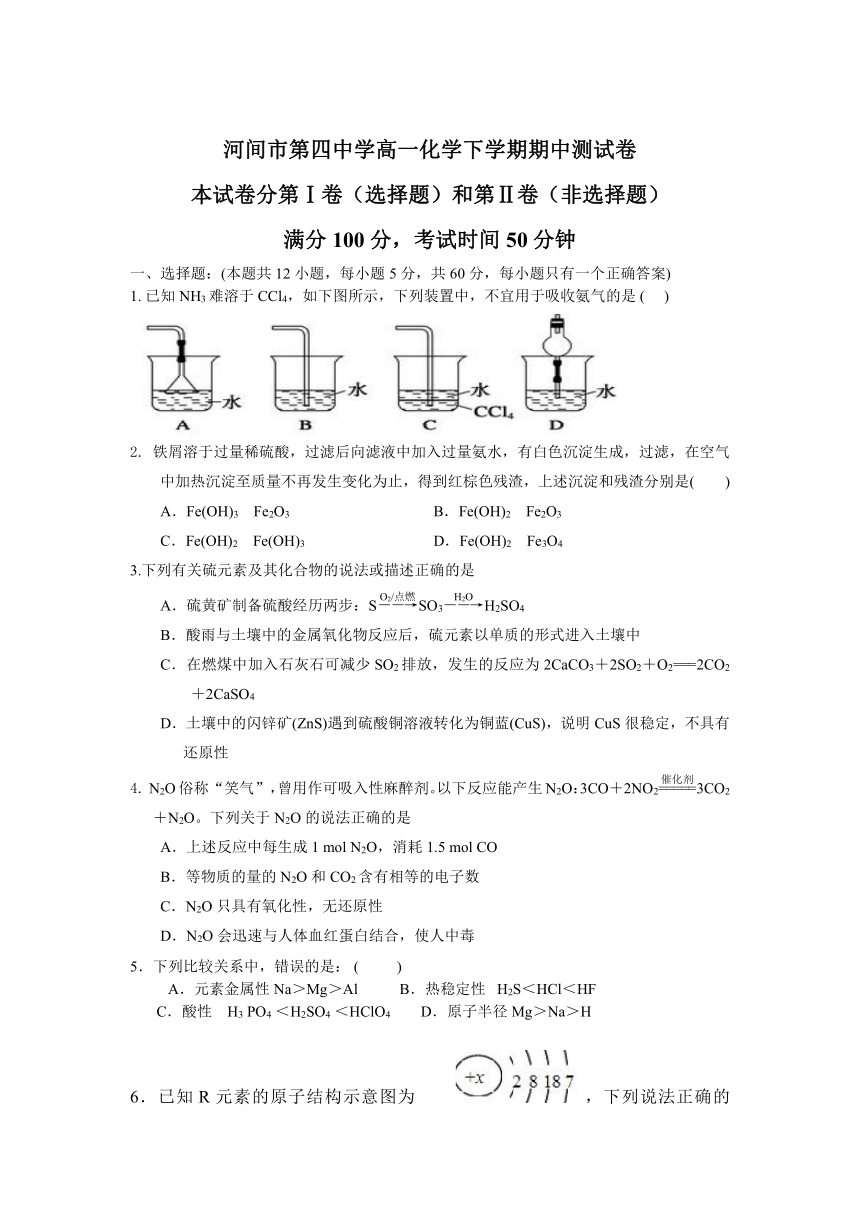 | |
| 格式 | doc | ||
| 文件大小 | 162.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-02 11:39:12 | ||
图片预览


文档简介
河间市第四中学高一化学下学期期中测试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)
满分100分,考试时间50分钟
一、选择题:(本题共12小题,每小题5分,共60分,每小题只有一个正确答案)?
1.?已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨气的是?(?????)?
2. 铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
3.下列有关硫元素及其化合物的说法或描述正确的是
A.硫黄矿制备硫酸经历两步:SSO3H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2===2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
4. N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO23CO2+N2O。下列关于N2O的说法正确的是
A.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
5.下列比较关系中,错误的是:?( )?
A.元素金属性?Na>Mg>Al???????????B.热稳定性???H2S<HCl<HF????????
?C.酸性????H3?PO4?<H2SO4?<HClO4????????D.原子半径Mg>Na>H??
6.已知R元素的原子结构示意图为???????,下列说法正确的是?( )
A.R元素的原子序数为36?????????????????B.R元素是第4周期元素?
C.R元素的最高正化合价为+8????????????D.R元素的原子在反应中易失去电子?
7.下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子:
C. 硫离子的结构示意图:
D.CaCL2的形成过程︰Cl?+ ?Ca? +?Cl︰→[︰Cl︰]-Ca2+[︰Cl︰]-
8. 有X、Y、Z三种元素,已知:(1)Xm+、Yn+和Za—具有相同的电子层结构;?
(2)m>n,由此推知正确的是(?? ???)?
??A、原子半径:X>?Y>Z????????????B、离子半径:Z>X>Y?
??C、原子序数:X>Y>Z????????????D、原子所在的周期数:X=Y=Z?
9.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是 ( )
A.1∶2∶1 B.2∶1∶1
C.1∶3∶1 D.1∶1∶3
10. 要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
11. 在标准状况下将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为 ( )
A.0.8 mol B.0.6 mol
C.0.11 mol D.无法计算
12. 汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2―→2NO+2O,②2NO+O2―→2NO2,③O+O2―→O3。下列对该反应过程及生成物叙述正确的是 ( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
第Ⅱ卷(非选择题)
13 、(40分)下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。?
(1)10种元素中,化学性质最不活泼的是???_________?????????。?
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是??________?????。?
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是?__________??????。?
(4)元素⑦的氢化物的化学式为?______________________?;该氢化物常温下和②单质反应的化学方程式是??????______________________;若该氢化物和元素⑧的单质反应,则化学方程式为????__________________________________________。?
(5)⑨的最高价氧化物对应水化物的化学式为?_______________??????;①和⑨两元素形成化合物的电子式为???_________________?;该化合物灼烧时火焰颜色为?????_____________??;该化合物的溶液与元素⑧的单质反应的离子方程式为?______________________________________。?
14、制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是________,a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式
________________________________________________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________________________________________________________________________。
(4)写出E中发生反应的化学方程式_______________________________________。
高一化学下学期期中测试卷答案
1 2 3 4 5 6
B B C B D B
7 8 9 10 11 12
B C D C C A
14答案 (1)微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一稳定的段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2△,2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg△,Mg3N2
(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(或把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)
满分100分,考试时间50分钟
一、选择题:(本题共12小题,每小题5分,共60分,每小题只有一个正确答案)?
1.?已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨气的是?(?????)?
2. 铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
3.下列有关硫元素及其化合物的说法或描述正确的是
A.硫黄矿制备硫酸经历两步:SSO3H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2===2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
4. N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO23CO2+N2O。下列关于N2O的说法正确的是
A.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
5.下列比较关系中,错误的是:?( )?
A.元素金属性?Na>Mg>Al???????????B.热稳定性???H2S<HCl<HF????????
?C.酸性????H3?PO4?<H2SO4?<HClO4????????D.原子半径Mg>Na>H??
6.已知R元素的原子结构示意图为???????,下列说法正确的是?( )
A.R元素的原子序数为36?????????????????B.R元素是第4周期元素?
C.R元素的最高正化合价为+8????????????D.R元素的原子在反应中易失去电子?
7.下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子:
C. 硫离子的结构示意图:
D.CaCL2的形成过程︰Cl?+ ?Ca? +?Cl︰→[︰Cl︰]-Ca2+[︰Cl︰]-
8. 有X、Y、Z三种元素,已知:(1)Xm+、Yn+和Za—具有相同的电子层结构;?
(2)m>n,由此推知正确的是(?? ???)?
??A、原子半径:X>?Y>Z????????????B、离子半径:Z>X>Y?
??C、原子序数:X>Y>Z????????????D、原子所在的周期数:X=Y=Z?
9.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是 ( )
A.1∶2∶1 B.2∶1∶1
C.1∶3∶1 D.1∶1∶3
10. 要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
11. 在标准状况下将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为 ( )
A.0.8 mol B.0.6 mol
C.0.11 mol D.无法计算
12. 汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2―→2NO+2O,②2NO+O2―→2NO2,③O+O2―→O3。下列对该反应过程及生成物叙述正确的是 ( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
第Ⅱ卷(非选择题)
13 、(40分)下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。?
(1)10种元素中,化学性质最不活泼的是???_________?????????。?
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是??________?????。?
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是?__________??????。?
(4)元素⑦的氢化物的化学式为?______________________?;该氢化物常温下和②单质反应的化学方程式是??????______________________;若该氢化物和元素⑧的单质反应,则化学方程式为????__________________________________________。?
(5)⑨的最高价氧化物对应水化物的化学式为?_______________??????;①和⑨两元素形成化合物的电子式为???_________________?;该化合物灼烧时火焰颜色为?????_____________??;该化合物的溶液与元素⑧的单质反应的离子方程式为?______________________________________。?
14、制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是________,a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式
________________________________________________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________________________________________________________________________。
(4)写出E中发生反应的化学方程式_______________________________________。
高一化学下学期期中测试卷答案
1 2 3 4 5 6
B B C B D B
7 8 9 10 11 12
B C D C C A
14答案 (1)微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一稳定的段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2△,2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg△,Mg3N2
(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(或把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁
同课章节目录
