2020-2021学年高一下苏教版(2019)必修第二册《专题9+金属与人类文明》单元测试卷
文档属性
| 名称 | 2020-2021学年高一下苏教版(2019)必修第二册《专题9+金属与人类文明》单元测试卷 |  | |
| 格式 | docx | ||
| 文件大小 | 179.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-03 11:19:16 | ||
图片预览



文档简介
苏教版(2019)必修第二册《专题9
金属与人类文明》2021年单元测试卷
一.选择题(共17小题,满分51分,每小题3分)
1.(3分)向100mL
Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是( )
A.a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时溶液中溶质的物质的量浓度为0.5
mol?L﹣1
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1:1
2.(3分)图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42﹣向a极移动
C.图Ⅱ中若a、b间连接电源,则a连接正极
D.图Ⅱ中若a、b间用导线连接,则X可以是铜
3.(3分)将amol铁片(打磨后)投入含1mol
FeCl3、1mol
CuCl2的溶液中,下列说法错误的是( )
A.铁片完全溶解时,有2amol电子发生转移
B.只有当a>0.5时,才有可能析出铜单质
C.整个反应过程只发生了置换反应
D.铁片溶解过程中没有气体产生
4.(3分)一定温度下,向装有CuCl2溶液的烧杯中投入一小块金属钠,充分反应,下列有关现象的描述不正确的是( )
A.钠浮于液面,熔成小球
B.四处游动,发出嘶嘶响声
C.溶液的颜色逐渐变浅
D.烧杯底部有红色固体生成
5.(3分)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
6.(3分)用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
7.(3分)现有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉.它们两两之间发生的反应最多有( )
A.3个
B.4个
C.5个
D.6个
8.(3分)向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42﹣全部沉淀时,铝元素的主要存在形式为( )
A.AlO2﹣
B.Al3+
C.Al(OH)3
D.Al(OH)3和Al3+
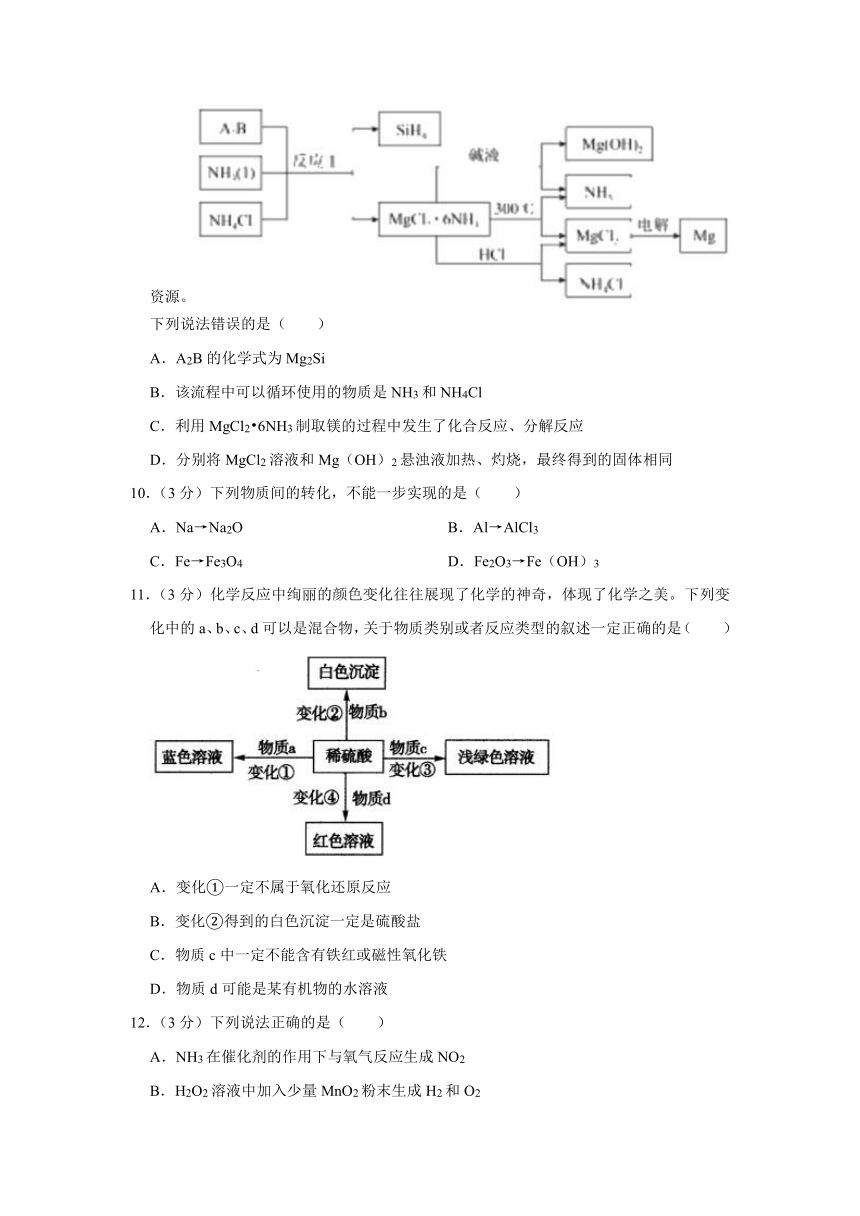
9.(3分)如图,图中反应①是制备SiH4的一种方法,其副产物MgCl2?6NH3是优质的镁资源。
下列说法错误的是( )
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2?6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
10.(3分)下列物质间的转化,不能一步实现的是( )
A.Na→Na2O
B.Al→AlCl3
C.Fe→Fe3O4
D.Fe2O3→Fe(OH)3
11.(3分)化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是( )
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
12.(3分)下列说法正确的是( )
A.NH3在催化剂的作用下与氧气反应生成NO2
B.H2O2溶液中加入少量MnO2粉末生成H2和O2
C.FeS2在沸腾炉中与O2反应生成Fe3O4
D.过量的铁在氯气中燃烧可得FeCl3
13.(3分)食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:IO3﹣+5I﹣+6H+=3I2+3H2O验证食盐中存在IO3﹣.根据上述反应,下列说法错误的是( )
A.IO3﹣作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3﹣>I2
D.每生成3mol
I2,转移电子的物质的量为6mol
14.(3分)下列有关铁的氧化物的叙述中正确的是( )
A.FeO、Fe2O3、Fe3O4都是黑色固体
B.FeO、Fe3O4都有磁性
C.FeO、Fe2O3都属于碱性氧化物
D.Fe2O3、Fe3O4都只有氧化性
15.(3分)化学与生活息息相关,下列说法不正确的是( )
A.淀粉属于多糖
B.天然药物无毒副作用,可以长期服用
C.与铜质水龙头连接处的铁质水管更易被腐蚀
D.医疗垃圾有多种致病微生物,可用高温焚烧处理
16.(3分)用打磨过的铝片进行如图所示实验,分断合理的是( )
A.①中铝片没有发生化学反应
B.②中产生的气泡是氢气
C.②中加水程释过程中,仅发生了氧化还原反应
D.③中沉淀溶解的离子方程式是:Al(OH)3+OH﹣═AlO2﹣+2H2O
17.(3分)下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液
B.硫酸铜溶液
C.氯气
D.稀盐酸
二.填空题(共3小题,满分49分)
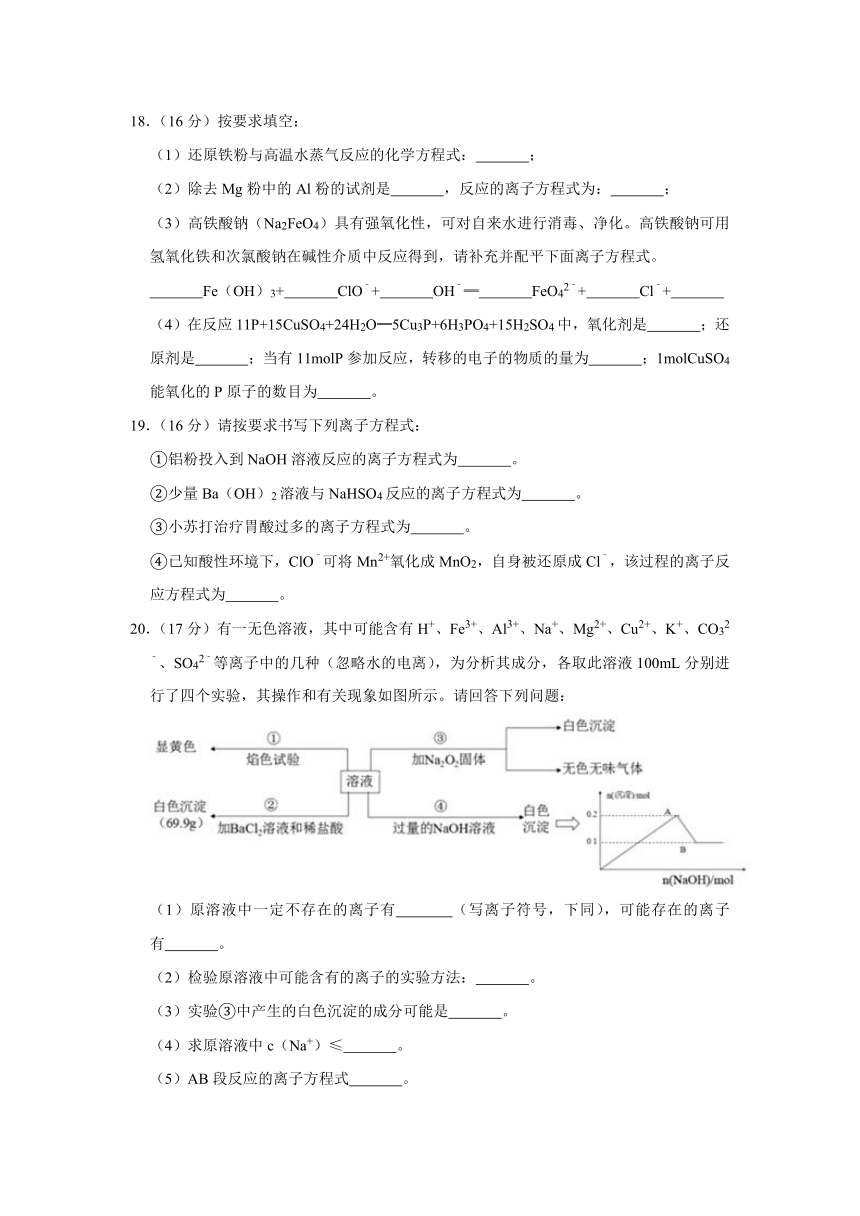
18.(16分)按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式:
;
(2)除去Mg粉中的Al粉的试剂是
,反应的离子方程式为:
;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
Fe(OH)3+
ClO﹣+
OH﹣═
FeO42﹣+
Cl﹣+
(4)在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,氧化剂是
;还原剂是
;当有11molP参加反应,转移的电子的物质的量为
;1molCuSO4能氧化的P原子的数目为
。
19.(16分)请按要求书写下列离子方程式:
①铝粉投入到NaOH溶液反应的离子方程式为
。
②少量Ba(OH)2溶液与NaHSO4反应的离子方程式为
。
③小苏打治疗胃酸过多的离子方程式为
。
④已知酸性环境下,ClO﹣可将Mn2+氧化成MnO2,自身被还原成Cl﹣,该过程的离子反应方程式为
。
20.(17分)有一无色溶液,其中可能含有H+、Fe3+、Al3+、Na+、Mg2+、Cu2+、K+、CO32﹣、SO42﹣等离子中的几种(忽略水的电离),为分析其成分,各取此溶液100mL分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
(1)原溶液中一定不存在的离子有
(写离子符号,下同),可能存在的离子有
。
(2)检验原溶液中可能含有的离子的实验方法:
。
(3)实验③中产生的白色沉淀的成分可能是
。
(4)求原溶液中c(Na+)≤
。
(5)AB段反应的离子方程式
。
苏教版(2019)必修第二册《专题9
金属与人类文明》2021年单元测试卷
参考答案与试题解析
一.选择题(共17小题,满分51分,每小题3分)
1.(3分)向100mL
Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是( )
A.a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时溶液中溶质的物质的量浓度为0.5
mol?L﹣1
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1:1
【分析】由氧化性的强弱(Fe3+>Cu2+)及图象变化可知:①0~5.6gFe发生Fe+2Fe3+=3Fe2+,②0.56g~1.68gFe时,剩余物为1.28g,而1.28gCu的物质的量为0.02mol,此时发生Fe+Cu2+=Cu+Fe2+;③加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加1.84g﹣1.28g=0.56g,所以此时溶液中不含Cu2+、反应完全,以此来解答。
【解答】解:A.0~5.6gFe发生Fe+2Fe3+=3Fe2+,a点时溶液中阳离子为Cu2+和Fe2+、Fe3+,故A正确;
B.由图可知加入铁粉0.56g~1.68g时,n(Fe)0.02mol,剩余物为1.28g,即1.28gCu的物质的量为0.02mol,此时发生Fe+Cu2+=Cu+Fe2+,故B正确;
C.由图象可知原溶液中Fe3+为0.02mol,即Fe2(SO4)3为0.01mol,n(SO42﹣)1=3n[Fe2(SO4)3]=0.03mol,Cu2+为0.02mol,即CuSO4为0.02mol,n(SO42﹣)2=2n(CuSO4)=0.02mol,当加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加1.84g﹣1.28g=0.56g,溶液中不含Cu2+,溶液中溶质为FeSO4,n(SO42﹣)=0.02mol+0.03mol=0.05mol,SO42﹣守恒有n(FeSO4)=n(SO42﹣)=0.05mol,所以c点溶液中溶质的物质的量浓度为0.5mol/L,故C正确;
D.由上述分析可知原溶液中Fe3+为0.02mol,则Fe2(SO4)3为0.01mol,Cu2+为0.02mol,则CuSO4为0.02mol,所以原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比=物质的量之比为1:2,故D错误;
故选:D。
【点评】本题考查氧化还原反应的计算,为高频考点,把握反应的先后顺序、反应与图象的对应关系为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大。
2.(3分)图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42﹣向a极移动
C.图Ⅱ中若a、b间连接电源,则a连接正极
D.图Ⅱ中若a、b间用导线连接,则X可以是铜
【分析】A.粗铜的精炼中,粗铜作阳极,纯铜作阴极;
B.电解时,电解质溶液中阴离子向阳极移动;
C.外加电流的阴极保护法中,被保护的金属连接原电池负极;
D.牺牲阳极的阴极保护法中,被保护的金属作原电池正极。
【解答】解:A.粗铜的精炼中,粗铜作阳极,纯铜作阴极,所以阴极a为纯铜,故A正确;
B.电解时,电解质溶液中阴离子向阳极移动,所以I中硫酸根离子向阳极b电极移动,故B错误;
C.外加电流的阴极保护法中,被保护的金属连接原电池负极,所以图Ⅱ中如果a、b间连接电源,则a连接负极,故C错误;
D.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,图Ⅱ中如果a、b间用导线连接,则X作负极,其活泼性大于铁,故D错误;
故选:A。
【点评】本题考查了原电池和电解池原理,涉及电镀及金属的腐蚀与防护,明确哪种电极被保护、哪种电极被腐蚀是解本题关键,题目难度不大。
3.(3分)将amol铁片(打磨后)投入含1mol
FeCl3、1mol
CuCl2的溶液中,下列说法错误的是( )
A.铁片完全溶解时,有2amol电子发生转移
B.只有当a>0.5时,才有可能析出铜单质
C.整个反应过程只发生了置换反应
D.铁片溶解过程中没有气体产生
【分析】A.铁与铁离子和铜离子反应都生成亚铁离子;
B.铁离子氧化性强于铜离子,铁先与铁离子反应;
C.铁与铁离子反应生成亚铁离子为化合反应;
D.铁与铁离子反应生成亚铁离子,与铜离子反应生成铜和亚铁离子。
【解答】解:A.amol铁片(打磨后)投入含1mol
FeCl3、1mol
CuCl2的溶液中,铁完全反应生成amol亚铁离子,转移2amol电子,故A正确;
B.铁离子氧化性强于铜离子,铁先与铁离子反应,1mol
FeCl3需要消耗0.5mol铁,所以只有当a>0.5时,才有可能析出铜单质,故B正确;
C.整个反应过程发生了化合反应和置换反应,故C错误;
D.铁与铁离子反应生成亚铁离子,与铜离子反应生成铜和亚铁离子,过程中没有氢气生成,故D正确。
故选:C。
【点评】本题考查了铁的性质,熟悉铁离子与铜离子氧化性强弱,反应先后顺序是解题关键,题目难度不大。
4.(3分)一定温度下,向装有CuCl2溶液的烧杯中投入一小块金属钠,充分反应,下列有关现象的描述不正确的是( )
A.钠浮于液面,熔成小球
B.四处游动,发出嘶嘶响声
C.溶液的颜色逐渐变浅
D.烧杯底部有红色固体生成
【分析】依据钠投入到盛有CuCl2溶液的烧杯里,发生反应有:2Na+2H2O=2NaOH+H2↑、2NaOH+CuCl2=Cu(OH)2↓+2NaCl,结合钠的密度小于水,与水反应放热,熔点低的性质判断解答。
【解答】解:钠的密度小于水,与水反应放热,熔点低,向装有CuCl2溶液的烧杯中投入一小块金属钠,发生反应有:2Na+2H2O=2NaOH+H2↑、2NaOH+CuCl2=Cu(OH)2↓+2NaCl,既有Na与H2O反应现象,又有NaOH与CuCl2反应现象。所以现象为:钠浮在液面上,与溶液剧烈反应,熔成小球,四处游动,发出嘶嘶声,有气泡冒出,有蓝色沉淀生成,溶液的颜色逐渐变浅,看不到的现象为:溶液底部有红色固体生成;
故选:D。
【点评】本题考查了元素化合物知识,熟悉钠的性质是解题关键,注意钠与盐溶液反应实质:先于水反应,生成氢氧化钠再与盐反应,题目难度不大。
5.(3分)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
【分析】令各物质的质量分别为1g,根据方程式计算当体系中无固体物质时消耗碱的物质的量.
A、铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
B、氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O;
C、AlCl3与氢氧化钠反应为Al3++4OH﹣=AlO2﹣+2H2O;
D、Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+2H2O。
【解答】解:令各物质的质量分别为1g,
A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1gAl消耗NaOH质量1.48g;
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,1g氢氧化铝消耗氢氧化钠质量0.51g;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,1g氯化铝消耗氢氧化钠质量1.2g;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,1g氧化铝消耗氢氧化钠的质量0.78g,
相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,
故选:B。
【点评】本题考查铝及其化合物的性质、化学方程式有关计算,难度不大,注意基础知识的掌握。
6.(3分)用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
【分析】根据自来水一般都是通入氯气消毒,氯气和水反应生成盐酸和次氯酸:Cl2+H2O?HCl+HClO,次氯酸见光分解.
【解答】解:自来水在Cl2消毒中发生反应:Cl2+H2O=HCl+HClO,次氯酸见光分解,放在阳光里晒一下就是为了将次氯酸分解使盐酸挥发出去,2HClO2HCl+O2↑以免将金鱼致死。故选:D。
【点评】本题注重了化学与生活的联系,学生应学会利用化学知识来解决生活中常见的问题.
7.(3分)现有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉.它们两两之间发生的反应最多有( )
A.3个
B.4个
C.5个
D.6个
【分析】能发生置换反应只有Fe与盐酸,然后结合复分解反应发生的条件分析发生的复分解反应即可解答.
【解答】解:NaHCO3溶液分别与NaOH溶液、盐酸反应,有2种;
NaOH溶液与盐酸反应,有1种;
盐酸与铁粉发生置换反应,有1种,
即以上四种物质两两反应可发生4个反应,
故选:B。
【点评】本题考查物质之间的反应,侧重置换反应和复分解反应的考查,注意两两组合的方式为解答的关键,从前向后组合不容易遗漏,题目难度不大.
8.(3分)向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42﹣全部沉淀时,铝元素的主要存在形式为( )
A.AlO2﹣
B.Al3+
C.Al(OH)3
D.Al(OH)3和Al3+
【分析】明矾的化学式为KAl(SO4)2?12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42﹣,根据反应:SO42﹣+Ba2+=BaSO4↓,Al3++4OH﹣=AlO2﹣+2H2O判断.
【解答】解:明矾的化学式为KAl(SO4)2?12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42﹣,由反应SO42﹣+Ba2+=BaSO4↓可知,使SO42﹣全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH﹣,则发生Al3++4OH﹣=AlO2﹣+2H2O,所以最后溶液中存在AlO2﹣,
故选:A。
【点评】本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42﹣全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH﹣物质的量的关系判断反应产物.
9.(3分)如图,图中反应①是制备SiH4的一种方法,其副产物MgCl2?6NH3是优质的镁资源。
下列说法错误的是( )
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2?6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
【分析】由反应①可知A2B应为Mg2Si,与氨气、氯化铵反应生成SiH4和MgCl2?6NH3,MgCl2?6NH3加入碱液,可生成Mg(OH)2,MgCl2?6NH3加热时不稳定,可分解生成氨气,同时生成氯化镁,电解熔融的氯化镁,可生成镁,用于工业冶炼,而MgCl2?6NH3与盐酸反应,可生成氯化镁、氯化铵,其中氨气、氯化铵可用于反应①而循环使用,以此解答该题。
【解答】解:A、A2B的化学式为Mg2Si,故A正确;
B、如在溶液中,则可生成氢氧化镁沉淀,由流程可知MgCl2?6NH3分别加热、与盐酸反应,可生成氨气、氯化铵,可用于反应①而循环使用,故B正确;
C、利用MgCl2?6NH3制取镁,先加热分解生成氨气和氯化镁,然后再电解熔融的氯化镁,可生成镁和氯气,都发生分解反应,故C错误;
D、分别将MgCl2溶液和Mg(OH)2悬浊液加热,灼烧,都生成氧化镁,最终得到的固体相同,故D正确;
故选:C。
【点评】本题以物质的制备流程为载体考查元素化合物知识,题目侧重考查学生的分析能力、实验能力以及元素化合物知识综合理解和运用,难度中等,注意把握题给信息以及物质的性质。
10.(3分)下列物质间的转化,不能一步实现的是( )
A.Na→Na2O
B.Al→AlCl3
C.Fe→Fe3O4
D.Fe2O3→Fe(OH)3
【分析】A.钠常温下与氧气反应生成氧化钠;
B.铝与盐酸反应生成氯化铝和氢气;
C.铁在氧气中燃烧生成四氧化三铁;
D.氧化铁与水不反应。
【解答】解:A.钠常温下与氧气反应生成氧化钠,所以Na→Na2O可以一步实现,故A不选;
B.铝与盐酸反应生成氯化铝和氢气,所以Al→AlCl3可以一步实现,故B不选;
C.铁在氧气中燃烧生成四氧化三铁,所以Fe→Fe3O4可以一步实现,故C不选;
D.氧化铁与水不反应,所以Fe2O3→Fe(OH)3不能一步实现,故D选。
故选:D。
【点评】本题考查了元素化合物知识,熟悉相关金属单质及其化合物的性质是解题关键,题目难度不大。
11.(3分)化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是( )
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
【分析】根据框图信息,蓝色溶液中含有铜离子,说明物质a为含铜元素的化合物且能与硫酸反应;浅绿色溶液中含有亚铁离子,可知物质c中含有铁元素,铁单质及亚铁盐等都能与硫酸反应;物质b与硫酸产生白色沉淀,可能是硫酸盐沉淀,也可能是硅酸沉淀;物质d与硫酸反应产生红色溶液,结合酸的通性判断可能是指示剂变色导致,结合以上分析确定。
【解答】解:A.氧化铜、氢氧化铜都可以与硫酸发生反应产生硫酸铜使溶液呈蓝色,但不是氧化还原反应,故A错误;
B.物质b与硫酸产生白色沉淀,可能是硫酸根形成的硫酸钡等,也可以是氢离子与硅酸结合产生的硅酸沉淀,故B错误;
C.物质c可能是铁粉和铁红或磁性氧化铁的混合物,铁红和磁性氧化铁与硫酸产生硫酸铁,硫酸铁与铁粉反应最终得到浅绿色的硫酸亚铁,故C错误;
D.硫酸是强酸具有酸的通性,能使指示剂变色,如硫酸遇到石蕊变红,石蕊是有机物,故D正确;
故选:D。
【点评】本题考查酸的基本性质,酸具有酸的通性,包括使指示剂变色、与活泼金属反应、与金属氧化物反应、与碱反应、与某些盐反应等。
12.(3分)下列说法正确的是( )
A.NH3在催化剂的作用下与氧气反应生成NO2
B.H2O2溶液中加入少量MnO2粉末生成H2和O2
C.FeS2在沸腾炉中与O2反应生成Fe3O4
D.过量的铁在氯气中燃烧可得FeCl3
【分析】A.氨气催化氧化生成一氧化氮;
B.过氧化氢在二氧化锰催化作用下分解生成水和氧气;
C.FeS2在沸腾炉中与O2反应生成三氧化二铁和二氧化硫;
D.铁与氯气反应生成氯化铁。
【解答】解:A.NH3在催化剂的作用下与氧气反应生成NO,故A错误;
B.过氧化氢在二氧化锰催化作用下分解生成水和氧气,故B错误;
C.FeS2在沸腾炉中与O2反应生成三氧化二铁和二氧化硫,故C错误;
D.过量的铁在氯气中燃烧可得FeCl3,故D正确。
故选:D。
【点评】本题考查了元素化合物知识,明确氨气及铁及铁的化合物性质是解题关键,题目难度不大。
13.(3分)食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:IO3﹣+5I﹣+6H+=3I2+3H2O验证食盐中存在IO3﹣.根据上述反应,下列说法错误的是( )
A.IO3﹣作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3﹣>I2
D.每生成3mol
I2,转移电子的物质的量为6mol
【分析】反应:IO3﹣+5I﹣+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价+5价变化为0价做氧化剂,碘离子化合价﹣1价变化为0价升高做还原剂,则反应中氧化剂和还原剂的物质的量之比为1:5,由此分析解答。
【解答】解:反应:IO3﹣+5I﹣+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价+5价变化为0价做氧化剂,碘离子化合价﹣1价变化为0价升高做还原剂,
A、IO3﹣作氧化剂,发生还原反应,故A正确;
B、I2既是氧化产物又是还原产物,故B正确;
C、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,所以该条件下氧化性:IO3﹣>I2,故C正确;
D、每生成3mol
I2,转移电子的物质的量为5mol,故D错误;
故选:D。
【点评】本题考查了氧化还原反应概念的分析判断、周期表中递变规律的理解应用,掌握基础是解题关键,题目难度中等。
14.(3分)下列有关铁的氧化物的叙述中正确的是( )
A.FeO、Fe2O3、Fe3O4都是黑色固体
B.FeO、Fe3O4都有磁性
C.FeO、Fe2O3都属于碱性氧化物
D.Fe2O3、Fe3O4都只有氧化性
【分析】A.Fe2O3是红棕色的物质,俗称铁红;
B.FeO、Fe2O3没有磁性;
C.和酸反应生成盐和水的氧化物为碱性氧化物;
D.处于中间价态的铁元素既有氧化性又有还原性。
【解答】解:A.铁的氧化物FeO、Fe3O4都是黑色,但是Fe2O3是红棕色的物质,俗称铁红,故A错误;
B.铁的氧化物中FeO、Fe2O3没有磁性,Fe3O4有磁性,又叫磁性氧化铁,故B错误;
C.FeO、Fe2O3和酸反应生成盐和水,都属于碱性氧化物,故C正确;
D.四氧化三铁中的铁元素有两个是+3价,一个是+2价,故四氧化三铁既有氧化性,又有还原性,故D错误;
故选:C。
【点评】本题考查铁的氧化物的性质,题目较简单,识记铁的氧化物的基本性质是解题的关键。
15.(3分)化学与生活息息相关,下列说法不正确的是( )
A.淀粉属于多糖
B.天然药物无毒副作用,可以长期服用
C.与铜质水龙头连接处的铁质水管更易被腐蚀
D.医疗垃圾有多种致病微生物,可用高温焚烧处理
【分析】A.淀粉、纤维素都是多糖;
B.是药物三分毒;
C.铜和铁和水溶液构成原电池;
D.加热可使蛋白质变性。
【解答】解:A.淀粉、纤维素都可以水解生成单糖,它们属于多糖,故A正确;
B.是药物三分毒,不可长期服用,损害肝肾,故B错误;
C.铜、铁和水溶液构成原电池,铁比铜活泼,铁质水管更易被腐蚀,故C正确;
D.加热可使蛋白质变性,医疗垃圾有多种致病微生物,可用高温焚烧处理,故D正确。
故选:B。
【点评】本题考查有机物分类、药物的使用、原电池原理、蛋白质变性等,难度不大,注意天然药物有的本身就有很大的毒性,不可长期服用。
16.(3分)用打磨过的铝片进行如图所示实验,分断合理的是( )
A.①中铝片没有发生化学反应
B.②中产生的气泡是氢气
C.②中加水程释过程中,仅发生了氧化还原反应
D.③中沉淀溶解的离子方程式是:Al(OH)3+OH﹣═AlO2﹣+2H2O
【分析】A.常温下Al遇浓硝酸发生钝化;
B.加水稀释后,稀硝酸除去表面的氧化膜,然后Al与稀硝酸发生氧化还原反应;
C.硝酸先与金属氧化物反应;
D.铝离子与碱反应生成沉淀,且氢氧化铝具有两性,可溶于强碱。
【解答】解:A.常温下Al遇浓硝酸发生钝化,发生氧化还原反应生成致密的氧化膜阻止反应的进一步发生,故A错误;
B.加水稀释后,稀硝酸除去表面的氧化膜,然后Al与稀硝酸发生氧化还原反应,则气体为NO,故B错误;
C.②中加水程释过程中,硝酸先与金属氧化物反应,为非氧化还原反应,然后Al与稀硝酸发生氧化还原反应,故C错误;
D.铝离子与碱反应生成沉淀,且氢氧化铝具有两性,可溶于强碱,则③中沉淀溶解的离子方程式是Al(OH)3+OH﹣═AlO2﹣+2H2O,故D正确;
故选:D。
【点评】本题考查Al的性质,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
17.(3分)下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液
B.硫酸铜溶液
C.氯气
D.稀盐酸
【分析】A.铁和氯化铁反应生成氯化亚铁;
B.金属铁置换铜生成的是Fe2+;
C.氯气能将铁氧化为Fe3+;
D.铁与稀酸反应置换氢气生成的是Fe2+。
【解答】解:A.氯化铁将铁氧化为+2价,离子方程式为2Fe3++Fe═3Fe2+,故A不选;
B.铁置换铜的反应中Fe被氧化为+2价,离子方程式为Cu2++Fe═Cu+Fe2+,故B不选;
C.铁和氯气化合生成氯化铁,Fe直接被氯气氧化为+3价,化学方程式为2Fe+3Cl2═2FeCl3,故C选;
D.铁和稀盐酸反应生成Fe2+,离子方程式为Fe+2H+═Fe2++H2↑,故D不选;
故选:C。
【点评】本题考查了金属铁与一些氧化剂的反应,对此考生应注意区分,Fe与强氧化剂比如Cl2反应时生成Fe3+,与氧化性弱的如H+、Cu2+等反应时生成Fe2+,本题难度不大。
二.填空题(共3小题,满分49分)
18.(16分)按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式: 3Fe+4H2O(g)Fe3O4+4H2 ;
(2)除去Mg粉中的Al粉的试剂是 氢氧化钠溶液 ,反应的离子方程式为: 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ ;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
2 Fe(OH)3+ 3 ClO﹣+ 4 OH﹣═ 2 FeO42﹣+ 3 Cl﹣+ 5H2O
(4)在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,氧化剂是 P、CuSO4 ;还原剂是 P ;当有11molP参加反应,转移的电子的物质的量为 30mol ;1molCuSO4能氧化的P原子的数目为 0.2NA 。
【分析】(1)铁与高温水蒸气反应生成四氧化三铁和氢气;
(2)根据Al片和Mg片的性质差别分析;
(3)Fe(OH)3是还原剂,ClO﹣是氧化剂,FeO42﹣是氧化产物,Cl﹣是还原产物,根据得失电子数守恒、电荷守恒和质量守恒来分析;
(4)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,P元素的化合价由0降低为﹣3价,P元素的化合价由0升高为+5价,Cu元素的化合价由+2价降低为+1价,以此来解答。
【解答】解:(1)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2:3Fe+4H2O(g)Fe3O4+4H2;
故答案为:3Fe+4H2O(g)Fe3O4+4H2;
(2)Mg和Al都是金属,都和酸反应,但铝和氢氧化钠溶液反应,镁和氢氧化钠溶液不反应,所以可以选取氢氧化钠溶液作除杂剂,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:氢氧化钠溶液;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)Fe(OH)3是还原剂,ClO﹣是氧化剂,FeO42﹣是氧化产物,由Fe(OH)3到FeO42﹣铁元素失3e﹣,由ClO﹣到Cl﹣得2e﹣,根据得失电子数守恒可知,Fe(OH)3和FeO42﹣的计量数为2,ClO﹣和Cl﹣的计量数为3,再根据电荷守恒和质量守恒可知,OH﹣的计量数为4,产物中缺5H2O,
故答案为:2、3、4、2、3、5H2O;
(4)P、Cu元素的化合价降低,则P、CuSO4是氧化剂,P元素的化合价由0升高为+5价,P是还原剂;
由原子守恒可知,11molP参加反应,被氧化的P为6mol,则转移的电子为6mol×5=30mol;由反应可知,转移30mol电子消耗11molP,15molCuSO4和5molP来一起氧化6molP,其中1mol
CuSO4可以氧化0.2molP,即0.2NA个P原子。
故答案为:P、CuSO4;P;30mol;0.2NA。
【点评】本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从元素的化合价角度分析,题目难度不大。
19.(16分)请按要求书写下列离子方程式:
①铝粉投入到NaOH溶液反应的离子方程式为 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ 。
②少量Ba(OH)2溶液与NaHSO4反应的离子方程式为 Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O 。
③小苏打治疗胃酸过多的离子方程式为 HCO3﹣+H+=CO2↑+H2O 。
④已知酸性环境下,ClO﹣可将Mn2+氧化成MnO2,自身被还原成Cl﹣,该过程的离子反应方程式为 ClO﹣+Mn2++H2O=MnO2↓+2H++Cl﹣ 。
【分析】①铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
②氢氧化钡少量,离子方程式按照氢氧化钡的化学式组成书写;
③碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;
④酸性环境下,ClO﹣可将Mn2+氧化成MnO2,自身被还原成Cl﹣,结合电子守恒、质量守恒书写离子方程式。
【解答】解:①Al与NaOH溶液反应生成NaAlO2和H2,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
②Ba(OH)2少量可把Ba(OH)2看做1,即只有1个Ba2+和2个OH﹣,NaHSO4可以完全电离成Na+、H+和SO42﹣,离子方程式为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,
故答案为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O;
③小苏打是NaHCO3,胃酸的主要成分是盐酸,离子方程式为:HCO3﹣+H+=CO2↑+H2O,
故答案为:HCO3﹣+H+=CO2↑+H2O;
④根据题意,反应物有ClO﹣和Mn2+,产物有MnO2和Cl﹣,Cl得到2e﹣,Mn2+失去2e﹣,转移电子守恒,根据电荷守恒,产物需要阳离子H+,则反应物需要用H2O配平,离子方程式为:ClO﹣+Mn2++H2O=MnO2↓+2H++Cl﹣,
故答案为:ClO﹣+Mn2++H2O=MnO2↓+2H++Cl﹣。
【点评】本题考查离子方程式的书写,明确发生反应实质为解答关键,注意掌握离子方程式的书写原则,试题侧重考查学生的分析能力及规范答题能力,题目难度不大。
20.(17分)有一无色溶液,其中可能含有H+、Fe3+、Al3+、Na+、Mg2+、Cu2+、K+、CO32﹣、SO42﹣等离子中的几种(忽略水的电离),为分析其成分,各取此溶液100mL分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
(1)原溶液中一定不存在的离子有 H+、Fe3+、Cu2+、CO32﹣ (写离子符号,下同),可能存在的离子有 K+ 。
(2)检验原溶液中可能含有的离子的实验方法: 焰色试验 。
(3)实验③中产生的白色沉淀的成分可能是 Mg(OH)2或Al(OH)3和Mg(OH)2 。
(4)求原溶液中c(Na+)≤ 1mol/L 。
(5)AB段反应的离子方程式 Al(OH)3+OH﹣=AlO2﹣+2H2O 。
【分析】原溶液无色,则不含有Fe3+、Cu2+;
焰色试验,火焰呈黄色,说明溶液中含有Na+;
加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42﹣离子,物质的量为0.3mol;
加入过量NaOH溶液时,由实验④的图象可知:加入NaOH时立即生成沉淀,则原溶液中不含有H+,生成白色沉淀的量与加入NaOH的量的先增大后减小,最后不再变化,则原溶液中含有Mg2+、Al3+,根据共存可知一定不含CO32﹣,n(Al3+)=n[Al(OH)3]=0.2mol﹣0.1mol=0.1mol,n(Mg2+)=n[Mg(OH)2]=0.1mol;
综上:原溶液100mL中一定含有0.1molAl3+、0.1molMg2+、Na+、0.3molSO42﹣,一定不含H+、Fe3+、Cu2+、CO32﹣,可能含有的离子有K+,据此分析解答。
【解答】解:(1)由上述分析可知,原溶液中一定含有Al3+、Mg2+、Na+、SO42﹣,一定不含H+、Fe3+、Cu2+、CO32﹣,可能含有的离子有K+,
故答案为:H+、Fe3+、Cu2+、CO32﹣;K+;
(2)溶液中可能含有的离子为K+,检验K+常用焰色试验,
故答案为:焰色试验;
(3)实验③中加入过氧化钠固体,过氧化钠和水反应生成氢氧化钠,氢氧化钠和铝离子生成氢氧化铝沉淀,和镁离子生成氢氧化镁沉淀,反应中产生的白色沉淀的成分可能是Mg(OH)2或Al(OH)3和Mg(OH)2,
故答案为:Mg(OH)2或Al(OH)3和Mg(OH)2;
(4)原溶液100mL中一定含有0.1molAl3+、0.1molMg2+、Na+、0.3molSO42﹣,可能含有的离子有K+,负电荷总量为0.3mol×2=0.6mol,正电荷总量为0.1mol×3+0.1mol×2=0.5mol<0.6mol,所以n(Na+)≤0.6mol﹣0.5mol=0.1mol,c(Na+)1mol/L,
故答案为:1mol/L;
(5)加入过量氢氧化钠,氢氧化铝溶解,发生Al(OH)3+OH﹣=AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O。
【点评】本题考查了常见离子的检验,为高频考点和常见题型,侧重考查学生的分析能力、实验能力,根据反应现象正确推断存在的离子为解题的关键,注意掌握离子的特征反应、电荷守恒关系的计算应用,题目难度中等。
金属与人类文明》2021年单元测试卷
一.选择题(共17小题,满分51分,每小题3分)
1.(3分)向100mL
Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是( )
A.a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时溶液中溶质的物质的量浓度为0.5
mol?L﹣1
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1:1
2.(3分)图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42﹣向a极移动
C.图Ⅱ中若a、b间连接电源,则a连接正极
D.图Ⅱ中若a、b间用导线连接,则X可以是铜
3.(3分)将amol铁片(打磨后)投入含1mol
FeCl3、1mol
CuCl2的溶液中,下列说法错误的是( )
A.铁片完全溶解时,有2amol电子发生转移
B.只有当a>0.5时,才有可能析出铜单质
C.整个反应过程只发生了置换反应
D.铁片溶解过程中没有气体产生
4.(3分)一定温度下,向装有CuCl2溶液的烧杯中投入一小块金属钠,充分反应,下列有关现象的描述不正确的是( )
A.钠浮于液面,熔成小球
B.四处游动,发出嘶嘶响声
C.溶液的颜色逐渐变浅
D.烧杯底部有红色固体生成
5.(3分)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
6.(3分)用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
7.(3分)现有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉.它们两两之间发生的反应最多有( )
A.3个
B.4个
C.5个
D.6个
8.(3分)向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42﹣全部沉淀时,铝元素的主要存在形式为( )
A.AlO2﹣
B.Al3+
C.Al(OH)3
D.Al(OH)3和Al3+
9.(3分)如图,图中反应①是制备SiH4的一种方法,其副产物MgCl2?6NH3是优质的镁资源。
下列说法错误的是( )
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2?6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
10.(3分)下列物质间的转化,不能一步实现的是( )
A.Na→Na2O
B.Al→AlCl3
C.Fe→Fe3O4
D.Fe2O3→Fe(OH)3
11.(3分)化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是( )
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
12.(3分)下列说法正确的是( )
A.NH3在催化剂的作用下与氧气反应生成NO2
B.H2O2溶液中加入少量MnO2粉末生成H2和O2
C.FeS2在沸腾炉中与O2反应生成Fe3O4
D.过量的铁在氯气中燃烧可得FeCl3
13.(3分)食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:IO3﹣+5I﹣+6H+=3I2+3H2O验证食盐中存在IO3﹣.根据上述反应,下列说法错误的是( )
A.IO3﹣作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3﹣>I2
D.每生成3mol
I2,转移电子的物质的量为6mol
14.(3分)下列有关铁的氧化物的叙述中正确的是( )
A.FeO、Fe2O3、Fe3O4都是黑色固体
B.FeO、Fe3O4都有磁性
C.FeO、Fe2O3都属于碱性氧化物
D.Fe2O3、Fe3O4都只有氧化性
15.(3分)化学与生活息息相关,下列说法不正确的是( )
A.淀粉属于多糖
B.天然药物无毒副作用,可以长期服用
C.与铜质水龙头连接处的铁质水管更易被腐蚀
D.医疗垃圾有多种致病微生物,可用高温焚烧处理
16.(3分)用打磨过的铝片进行如图所示实验,分断合理的是( )
A.①中铝片没有发生化学反应
B.②中产生的气泡是氢气
C.②中加水程释过程中,仅发生了氧化还原反应
D.③中沉淀溶解的离子方程式是:Al(OH)3+OH﹣═AlO2﹣+2H2O
17.(3分)下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液
B.硫酸铜溶液
C.氯气
D.稀盐酸
二.填空题(共3小题,满分49分)
18.(16分)按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式:
;
(2)除去Mg粉中的Al粉的试剂是
,反应的离子方程式为:
;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
Fe(OH)3+
ClO﹣+
OH﹣═
FeO42﹣+
Cl﹣+
(4)在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,氧化剂是
;还原剂是
;当有11molP参加反应,转移的电子的物质的量为
;1molCuSO4能氧化的P原子的数目为
。
19.(16分)请按要求书写下列离子方程式:
①铝粉投入到NaOH溶液反应的离子方程式为
。
②少量Ba(OH)2溶液与NaHSO4反应的离子方程式为
。
③小苏打治疗胃酸过多的离子方程式为
。
④已知酸性环境下,ClO﹣可将Mn2+氧化成MnO2,自身被还原成Cl﹣,该过程的离子反应方程式为
。
20.(17分)有一无色溶液,其中可能含有H+、Fe3+、Al3+、Na+、Mg2+、Cu2+、K+、CO32﹣、SO42﹣等离子中的几种(忽略水的电离),为分析其成分,各取此溶液100mL分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
(1)原溶液中一定不存在的离子有
(写离子符号,下同),可能存在的离子有
。
(2)检验原溶液中可能含有的离子的实验方法:
。
(3)实验③中产生的白色沉淀的成分可能是
。
(4)求原溶液中c(Na+)≤
。
(5)AB段反应的离子方程式
。
苏教版(2019)必修第二册《专题9
金属与人类文明》2021年单元测试卷
参考答案与试题解析
一.选择题(共17小题,满分51分,每小题3分)
1.(3分)向100mL
Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是( )
A.a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时溶液中溶质的物质的量浓度为0.5
mol?L﹣1
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1:1
【分析】由氧化性的强弱(Fe3+>Cu2+)及图象变化可知:①0~5.6gFe发生Fe+2Fe3+=3Fe2+,②0.56g~1.68gFe时,剩余物为1.28g,而1.28gCu的物质的量为0.02mol,此时发生Fe+Cu2+=Cu+Fe2+;③加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加1.84g﹣1.28g=0.56g,所以此时溶液中不含Cu2+、反应完全,以此来解答。
【解答】解:A.0~5.6gFe发生Fe+2Fe3+=3Fe2+,a点时溶液中阳离子为Cu2+和Fe2+、Fe3+,故A正确;
B.由图可知加入铁粉0.56g~1.68g时,n(Fe)0.02mol,剩余物为1.28g,即1.28gCu的物质的量为0.02mol,此时发生Fe+Cu2+=Cu+Fe2+,故B正确;
C.由图象可知原溶液中Fe3+为0.02mol,即Fe2(SO4)3为0.01mol,n(SO42﹣)1=3n[Fe2(SO4)3]=0.03mol,Cu2+为0.02mol,即CuSO4为0.02mol,n(SO42﹣)2=2n(CuSO4)=0.02mol,当加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加1.84g﹣1.28g=0.56g,溶液中不含Cu2+,溶液中溶质为FeSO4,n(SO42﹣)=0.02mol+0.03mol=0.05mol,SO42﹣守恒有n(FeSO4)=n(SO42﹣)=0.05mol,所以c点溶液中溶质的物质的量浓度为0.5mol/L,故C正确;
D.由上述分析可知原溶液中Fe3+为0.02mol,则Fe2(SO4)3为0.01mol,Cu2+为0.02mol,则CuSO4为0.02mol,所以原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比=物质的量之比为1:2,故D错误;
故选:D。
【点评】本题考查氧化还原反应的计算,为高频考点,把握反应的先后顺序、反应与图象的对应关系为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大。
2.(3分)图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42﹣向a极移动
C.图Ⅱ中若a、b间连接电源,则a连接正极
D.图Ⅱ中若a、b间用导线连接,则X可以是铜
【分析】A.粗铜的精炼中,粗铜作阳极,纯铜作阴极;
B.电解时,电解质溶液中阴离子向阳极移动;
C.外加电流的阴极保护法中,被保护的金属连接原电池负极;
D.牺牲阳极的阴极保护法中,被保护的金属作原电池正极。
【解答】解:A.粗铜的精炼中,粗铜作阳极,纯铜作阴极,所以阴极a为纯铜,故A正确;
B.电解时,电解质溶液中阴离子向阳极移动,所以I中硫酸根离子向阳极b电极移动,故B错误;
C.外加电流的阴极保护法中,被保护的金属连接原电池负极,所以图Ⅱ中如果a、b间连接电源,则a连接负极,故C错误;
D.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,图Ⅱ中如果a、b间用导线连接,则X作负极,其活泼性大于铁,故D错误;
故选:A。
【点评】本题考查了原电池和电解池原理,涉及电镀及金属的腐蚀与防护,明确哪种电极被保护、哪种电极被腐蚀是解本题关键,题目难度不大。
3.(3分)将amol铁片(打磨后)投入含1mol
FeCl3、1mol
CuCl2的溶液中,下列说法错误的是( )
A.铁片完全溶解时,有2amol电子发生转移
B.只有当a>0.5时,才有可能析出铜单质
C.整个反应过程只发生了置换反应
D.铁片溶解过程中没有气体产生
【分析】A.铁与铁离子和铜离子反应都生成亚铁离子;
B.铁离子氧化性强于铜离子,铁先与铁离子反应;
C.铁与铁离子反应生成亚铁离子为化合反应;
D.铁与铁离子反应生成亚铁离子,与铜离子反应生成铜和亚铁离子。
【解答】解:A.amol铁片(打磨后)投入含1mol
FeCl3、1mol
CuCl2的溶液中,铁完全反应生成amol亚铁离子,转移2amol电子,故A正确;
B.铁离子氧化性强于铜离子,铁先与铁离子反应,1mol
FeCl3需要消耗0.5mol铁,所以只有当a>0.5时,才有可能析出铜单质,故B正确;
C.整个反应过程发生了化合反应和置换反应,故C错误;
D.铁与铁离子反应生成亚铁离子,与铜离子反应生成铜和亚铁离子,过程中没有氢气生成,故D正确。
故选:C。
【点评】本题考查了铁的性质,熟悉铁离子与铜离子氧化性强弱,反应先后顺序是解题关键,题目难度不大。
4.(3分)一定温度下,向装有CuCl2溶液的烧杯中投入一小块金属钠,充分反应,下列有关现象的描述不正确的是( )
A.钠浮于液面,熔成小球
B.四处游动,发出嘶嘶响声
C.溶液的颜色逐渐变浅
D.烧杯底部有红色固体生成
【分析】依据钠投入到盛有CuCl2溶液的烧杯里,发生反应有:2Na+2H2O=2NaOH+H2↑、2NaOH+CuCl2=Cu(OH)2↓+2NaCl,结合钠的密度小于水,与水反应放热,熔点低的性质判断解答。
【解答】解:钠的密度小于水,与水反应放热,熔点低,向装有CuCl2溶液的烧杯中投入一小块金属钠,发生反应有:2Na+2H2O=2NaOH+H2↑、2NaOH+CuCl2=Cu(OH)2↓+2NaCl,既有Na与H2O反应现象,又有NaOH与CuCl2反应现象。所以现象为:钠浮在液面上,与溶液剧烈反应,熔成小球,四处游动,发出嘶嘶声,有气泡冒出,有蓝色沉淀生成,溶液的颜色逐渐变浅,看不到的现象为:溶液底部有红色固体生成;
故选:D。
【点评】本题考查了元素化合物知识,熟悉钠的性质是解题关键,注意钠与盐溶液反应实质:先于水反应,生成氢氧化钠再与盐反应,题目难度不大。
5.(3分)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
【分析】令各物质的质量分别为1g,根据方程式计算当体系中无固体物质时消耗碱的物质的量.
A、铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
B、氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O;
C、AlCl3与氢氧化钠反应为Al3++4OH﹣=AlO2﹣+2H2O;
D、Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+2H2O。
【解答】解:令各物质的质量分别为1g,
A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1gAl消耗NaOH质量1.48g;
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,1g氢氧化铝消耗氢氧化钠质量0.51g;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,1g氯化铝消耗氢氧化钠质量1.2g;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,1g氧化铝消耗氢氧化钠的质量0.78g,
相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,
故选:B。
【点评】本题考查铝及其化合物的性质、化学方程式有关计算,难度不大,注意基础知识的掌握。
6.(3分)用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
【分析】根据自来水一般都是通入氯气消毒,氯气和水反应生成盐酸和次氯酸:Cl2+H2O?HCl+HClO,次氯酸见光分解.
【解答】解:自来水在Cl2消毒中发生反应:Cl2+H2O=HCl+HClO,次氯酸见光分解,放在阳光里晒一下就是为了将次氯酸分解使盐酸挥发出去,2HClO2HCl+O2↑以免将金鱼致死。故选:D。
【点评】本题注重了化学与生活的联系,学生应学会利用化学知识来解决生活中常见的问题.
7.(3分)现有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉.它们两两之间发生的反应最多有( )
A.3个
B.4个
C.5个
D.6个
【分析】能发生置换反应只有Fe与盐酸,然后结合复分解反应发生的条件分析发生的复分解反应即可解答.
【解答】解:NaHCO3溶液分别与NaOH溶液、盐酸反应,有2种;
NaOH溶液与盐酸反应,有1种;
盐酸与铁粉发生置换反应,有1种,
即以上四种物质两两反应可发生4个反应,
故选:B。
【点评】本题考查物质之间的反应,侧重置换反应和复分解反应的考查,注意两两组合的方式为解答的关键,从前向后组合不容易遗漏,题目难度不大.
8.(3分)向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42﹣全部沉淀时,铝元素的主要存在形式为( )
A.AlO2﹣
B.Al3+
C.Al(OH)3
D.Al(OH)3和Al3+
【分析】明矾的化学式为KAl(SO4)2?12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42﹣,根据反应:SO42﹣+Ba2+=BaSO4↓,Al3++4OH﹣=AlO2﹣+2H2O判断.
【解答】解:明矾的化学式为KAl(SO4)2?12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42﹣,由反应SO42﹣+Ba2+=BaSO4↓可知,使SO42﹣全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH﹣,则发生Al3++4OH﹣=AlO2﹣+2H2O,所以最后溶液中存在AlO2﹣,
故选:A。
【点评】本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42﹣全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH﹣物质的量的关系判断反应产物.
9.(3分)如图,图中反应①是制备SiH4的一种方法,其副产物MgCl2?6NH3是优质的镁资源。
下列说法错误的是( )
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2?6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
【分析】由反应①可知A2B应为Mg2Si,与氨气、氯化铵反应生成SiH4和MgCl2?6NH3,MgCl2?6NH3加入碱液,可生成Mg(OH)2,MgCl2?6NH3加热时不稳定,可分解生成氨气,同时生成氯化镁,电解熔融的氯化镁,可生成镁,用于工业冶炼,而MgCl2?6NH3与盐酸反应,可生成氯化镁、氯化铵,其中氨气、氯化铵可用于反应①而循环使用,以此解答该题。
【解答】解:A、A2B的化学式为Mg2Si,故A正确;
B、如在溶液中,则可生成氢氧化镁沉淀,由流程可知MgCl2?6NH3分别加热、与盐酸反应,可生成氨气、氯化铵,可用于反应①而循环使用,故B正确;
C、利用MgCl2?6NH3制取镁,先加热分解生成氨气和氯化镁,然后再电解熔融的氯化镁,可生成镁和氯气,都发生分解反应,故C错误;
D、分别将MgCl2溶液和Mg(OH)2悬浊液加热,灼烧,都生成氧化镁,最终得到的固体相同,故D正确;
故选:C。
【点评】本题以物质的制备流程为载体考查元素化合物知识,题目侧重考查学生的分析能力、实验能力以及元素化合物知识综合理解和运用,难度中等,注意把握题给信息以及物质的性质。
10.(3分)下列物质间的转化,不能一步实现的是( )
A.Na→Na2O
B.Al→AlCl3
C.Fe→Fe3O4
D.Fe2O3→Fe(OH)3
【分析】A.钠常温下与氧气反应生成氧化钠;
B.铝与盐酸反应生成氯化铝和氢气;
C.铁在氧气中燃烧生成四氧化三铁;
D.氧化铁与水不反应。
【解答】解:A.钠常温下与氧气反应生成氧化钠,所以Na→Na2O可以一步实现,故A不选;
B.铝与盐酸反应生成氯化铝和氢气,所以Al→AlCl3可以一步实现,故B不选;
C.铁在氧气中燃烧生成四氧化三铁,所以Fe→Fe3O4可以一步实现,故C不选;
D.氧化铁与水不反应,所以Fe2O3→Fe(OH)3不能一步实现,故D选。
故选:D。
【点评】本题考查了元素化合物知识,熟悉相关金属单质及其化合物的性质是解题关键,题目难度不大。
11.(3分)化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是( )
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
【分析】根据框图信息,蓝色溶液中含有铜离子,说明物质a为含铜元素的化合物且能与硫酸反应;浅绿色溶液中含有亚铁离子,可知物质c中含有铁元素,铁单质及亚铁盐等都能与硫酸反应;物质b与硫酸产生白色沉淀,可能是硫酸盐沉淀,也可能是硅酸沉淀;物质d与硫酸反应产生红色溶液,结合酸的通性判断可能是指示剂变色导致,结合以上分析确定。
【解答】解:A.氧化铜、氢氧化铜都可以与硫酸发生反应产生硫酸铜使溶液呈蓝色,但不是氧化还原反应,故A错误;
B.物质b与硫酸产生白色沉淀,可能是硫酸根形成的硫酸钡等,也可以是氢离子与硅酸结合产生的硅酸沉淀,故B错误;
C.物质c可能是铁粉和铁红或磁性氧化铁的混合物,铁红和磁性氧化铁与硫酸产生硫酸铁,硫酸铁与铁粉反应最终得到浅绿色的硫酸亚铁,故C错误;
D.硫酸是强酸具有酸的通性,能使指示剂变色,如硫酸遇到石蕊变红,石蕊是有机物,故D正确;
故选:D。
【点评】本题考查酸的基本性质,酸具有酸的通性,包括使指示剂变色、与活泼金属反应、与金属氧化物反应、与碱反应、与某些盐反应等。
12.(3分)下列说法正确的是( )
A.NH3在催化剂的作用下与氧气反应生成NO2
B.H2O2溶液中加入少量MnO2粉末生成H2和O2
C.FeS2在沸腾炉中与O2反应生成Fe3O4
D.过量的铁在氯气中燃烧可得FeCl3
【分析】A.氨气催化氧化生成一氧化氮;
B.过氧化氢在二氧化锰催化作用下分解生成水和氧气;
C.FeS2在沸腾炉中与O2反应生成三氧化二铁和二氧化硫;
D.铁与氯气反应生成氯化铁。
【解答】解:A.NH3在催化剂的作用下与氧气反应生成NO,故A错误;
B.过氧化氢在二氧化锰催化作用下分解生成水和氧气,故B错误;
C.FeS2在沸腾炉中与O2反应生成三氧化二铁和二氧化硫,故C错误;
D.过量的铁在氯气中燃烧可得FeCl3,故D正确。
故选:D。
【点评】本题考查了元素化合物知识,明确氨气及铁及铁的化合物性质是解题关键,题目难度不大。
13.(3分)食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:IO3﹣+5I﹣+6H+=3I2+3H2O验证食盐中存在IO3﹣.根据上述反应,下列说法错误的是( )
A.IO3﹣作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3﹣>I2
D.每生成3mol
I2,转移电子的物质的量为6mol
【分析】反应:IO3﹣+5I﹣+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价+5价变化为0价做氧化剂,碘离子化合价﹣1价变化为0价升高做还原剂,则反应中氧化剂和还原剂的物质的量之比为1:5,由此分析解答。
【解答】解:反应:IO3﹣+5I﹣+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价+5价变化为0价做氧化剂,碘离子化合价﹣1价变化为0价升高做还原剂,
A、IO3﹣作氧化剂,发生还原反应,故A正确;
B、I2既是氧化产物又是还原产物,故B正确;
C、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,所以该条件下氧化性:IO3﹣>I2,故C正确;
D、每生成3mol
I2,转移电子的物质的量为5mol,故D错误;
故选:D。
【点评】本题考查了氧化还原反应概念的分析判断、周期表中递变规律的理解应用,掌握基础是解题关键,题目难度中等。
14.(3分)下列有关铁的氧化物的叙述中正确的是( )
A.FeO、Fe2O3、Fe3O4都是黑色固体
B.FeO、Fe3O4都有磁性
C.FeO、Fe2O3都属于碱性氧化物
D.Fe2O3、Fe3O4都只有氧化性
【分析】A.Fe2O3是红棕色的物质,俗称铁红;
B.FeO、Fe2O3没有磁性;
C.和酸反应生成盐和水的氧化物为碱性氧化物;
D.处于中间价态的铁元素既有氧化性又有还原性。
【解答】解:A.铁的氧化物FeO、Fe3O4都是黑色,但是Fe2O3是红棕色的物质,俗称铁红,故A错误;
B.铁的氧化物中FeO、Fe2O3没有磁性,Fe3O4有磁性,又叫磁性氧化铁,故B错误;
C.FeO、Fe2O3和酸反应生成盐和水,都属于碱性氧化物,故C正确;
D.四氧化三铁中的铁元素有两个是+3价,一个是+2价,故四氧化三铁既有氧化性,又有还原性,故D错误;
故选:C。
【点评】本题考查铁的氧化物的性质,题目较简单,识记铁的氧化物的基本性质是解题的关键。
15.(3分)化学与生活息息相关,下列说法不正确的是( )
A.淀粉属于多糖
B.天然药物无毒副作用,可以长期服用
C.与铜质水龙头连接处的铁质水管更易被腐蚀
D.医疗垃圾有多种致病微生物,可用高温焚烧处理
【分析】A.淀粉、纤维素都是多糖;
B.是药物三分毒;
C.铜和铁和水溶液构成原电池;
D.加热可使蛋白质变性。
【解答】解:A.淀粉、纤维素都可以水解生成单糖,它们属于多糖,故A正确;
B.是药物三分毒,不可长期服用,损害肝肾,故B错误;
C.铜、铁和水溶液构成原电池,铁比铜活泼,铁质水管更易被腐蚀,故C正确;
D.加热可使蛋白质变性,医疗垃圾有多种致病微生物,可用高温焚烧处理,故D正确。
故选:B。
【点评】本题考查有机物分类、药物的使用、原电池原理、蛋白质变性等,难度不大,注意天然药物有的本身就有很大的毒性,不可长期服用。
16.(3分)用打磨过的铝片进行如图所示实验,分断合理的是( )
A.①中铝片没有发生化学反应
B.②中产生的气泡是氢气
C.②中加水程释过程中,仅发生了氧化还原反应
D.③中沉淀溶解的离子方程式是:Al(OH)3+OH﹣═AlO2﹣+2H2O
【分析】A.常温下Al遇浓硝酸发生钝化;
B.加水稀释后,稀硝酸除去表面的氧化膜,然后Al与稀硝酸发生氧化还原反应;
C.硝酸先与金属氧化物反应;
D.铝离子与碱反应生成沉淀,且氢氧化铝具有两性,可溶于强碱。
【解答】解:A.常温下Al遇浓硝酸发生钝化,发生氧化还原反应生成致密的氧化膜阻止反应的进一步发生,故A错误;
B.加水稀释后,稀硝酸除去表面的氧化膜,然后Al与稀硝酸发生氧化还原反应,则气体为NO,故B错误;
C.②中加水程释过程中,硝酸先与金属氧化物反应,为非氧化还原反应,然后Al与稀硝酸发生氧化还原反应,故C错误;
D.铝离子与碱反应生成沉淀,且氢氧化铝具有两性,可溶于强碱,则③中沉淀溶解的离子方程式是Al(OH)3+OH﹣═AlO2﹣+2H2O,故D正确;
故选:D。
【点评】本题考查Al的性质,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
17.(3分)下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液
B.硫酸铜溶液
C.氯气
D.稀盐酸
【分析】A.铁和氯化铁反应生成氯化亚铁;
B.金属铁置换铜生成的是Fe2+;
C.氯气能将铁氧化为Fe3+;
D.铁与稀酸反应置换氢气生成的是Fe2+。
【解答】解:A.氯化铁将铁氧化为+2价,离子方程式为2Fe3++Fe═3Fe2+,故A不选;
B.铁置换铜的反应中Fe被氧化为+2价,离子方程式为Cu2++Fe═Cu+Fe2+,故B不选;
C.铁和氯气化合生成氯化铁,Fe直接被氯气氧化为+3价,化学方程式为2Fe+3Cl2═2FeCl3,故C选;
D.铁和稀盐酸反应生成Fe2+,离子方程式为Fe+2H+═Fe2++H2↑,故D不选;
故选:C。
【点评】本题考查了金属铁与一些氧化剂的反应,对此考生应注意区分,Fe与强氧化剂比如Cl2反应时生成Fe3+,与氧化性弱的如H+、Cu2+等反应时生成Fe2+,本题难度不大。
二.填空题(共3小题,满分49分)
18.(16分)按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式: 3Fe+4H2O(g)Fe3O4+4H2 ;
(2)除去Mg粉中的Al粉的试剂是 氢氧化钠溶液 ,反应的离子方程式为: 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ ;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
2 Fe(OH)3+ 3 ClO﹣+ 4 OH﹣═ 2 FeO42﹣+ 3 Cl﹣+ 5H2O
(4)在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,氧化剂是 P、CuSO4 ;还原剂是 P ;当有11molP参加反应,转移的电子的物质的量为 30mol ;1molCuSO4能氧化的P原子的数目为 0.2NA 。
【分析】(1)铁与高温水蒸气反应生成四氧化三铁和氢气;
(2)根据Al片和Mg片的性质差别分析;
(3)Fe(OH)3是还原剂,ClO﹣是氧化剂,FeO42﹣是氧化产物,Cl﹣是还原产物,根据得失电子数守恒、电荷守恒和质量守恒来分析;
(4)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,P元素的化合价由0降低为﹣3价,P元素的化合价由0升高为+5价,Cu元素的化合价由+2价降低为+1价,以此来解答。
【解答】解:(1)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2:3Fe+4H2O(g)Fe3O4+4H2;
故答案为:3Fe+4H2O(g)Fe3O4+4H2;
(2)Mg和Al都是金属,都和酸反应,但铝和氢氧化钠溶液反应,镁和氢氧化钠溶液不反应,所以可以选取氢氧化钠溶液作除杂剂,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:氢氧化钠溶液;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)Fe(OH)3是还原剂,ClO﹣是氧化剂,FeO42﹣是氧化产物,由Fe(OH)3到FeO42﹣铁元素失3e﹣,由ClO﹣到Cl﹣得2e﹣,根据得失电子数守恒可知,Fe(OH)3和FeO42﹣的计量数为2,ClO﹣和Cl﹣的计量数为3,再根据电荷守恒和质量守恒可知,OH﹣的计量数为4,产物中缺5H2O,
故答案为:2、3、4、2、3、5H2O;
(4)P、Cu元素的化合价降低,则P、CuSO4是氧化剂,P元素的化合价由0升高为+5价,P是还原剂;
由原子守恒可知,11molP参加反应,被氧化的P为6mol,则转移的电子为6mol×5=30mol;由反应可知,转移30mol电子消耗11molP,15molCuSO4和5molP来一起氧化6molP,其中1mol
CuSO4可以氧化0.2molP,即0.2NA个P原子。
故答案为:P、CuSO4;P;30mol;0.2NA。
【点评】本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从元素的化合价角度分析,题目难度不大。
19.(16分)请按要求书写下列离子方程式:
①铝粉投入到NaOH溶液反应的离子方程式为 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ 。
②少量Ba(OH)2溶液与NaHSO4反应的离子方程式为 Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O 。
③小苏打治疗胃酸过多的离子方程式为 HCO3﹣+H+=CO2↑+H2O 。
④已知酸性环境下,ClO﹣可将Mn2+氧化成MnO2,自身被还原成Cl﹣,该过程的离子反应方程式为 ClO﹣+Mn2++H2O=MnO2↓+2H++Cl﹣ 。
【分析】①铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
②氢氧化钡少量,离子方程式按照氢氧化钡的化学式组成书写;
③碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;
④酸性环境下,ClO﹣可将Mn2+氧化成MnO2,自身被还原成Cl﹣,结合电子守恒、质量守恒书写离子方程式。
【解答】解:①Al与NaOH溶液反应生成NaAlO2和H2,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
②Ba(OH)2少量可把Ba(OH)2看做1,即只有1个Ba2+和2个OH﹣,NaHSO4可以完全电离成Na+、H+和SO42﹣,离子方程式为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,
故答案为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O;
③小苏打是NaHCO3,胃酸的主要成分是盐酸,离子方程式为:HCO3﹣+H+=CO2↑+H2O,
故答案为:HCO3﹣+H+=CO2↑+H2O;
④根据题意,反应物有ClO﹣和Mn2+,产物有MnO2和Cl﹣,Cl得到2e﹣,Mn2+失去2e﹣,转移电子守恒,根据电荷守恒,产物需要阳离子H+,则反应物需要用H2O配平,离子方程式为:ClO﹣+Mn2++H2O=MnO2↓+2H++Cl﹣,
故答案为:ClO﹣+Mn2++H2O=MnO2↓+2H++Cl﹣。
【点评】本题考查离子方程式的书写,明确发生反应实质为解答关键,注意掌握离子方程式的书写原则,试题侧重考查学生的分析能力及规范答题能力,题目难度不大。
20.(17分)有一无色溶液,其中可能含有H+、Fe3+、Al3+、Na+、Mg2+、Cu2+、K+、CO32﹣、SO42﹣等离子中的几种(忽略水的电离),为分析其成分,各取此溶液100mL分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
(1)原溶液中一定不存在的离子有 H+、Fe3+、Cu2+、CO32﹣ (写离子符号,下同),可能存在的离子有 K+ 。
(2)检验原溶液中可能含有的离子的实验方法: 焰色试验 。
(3)实验③中产生的白色沉淀的成分可能是 Mg(OH)2或Al(OH)3和Mg(OH)2 。
(4)求原溶液中c(Na+)≤ 1mol/L 。
(5)AB段反应的离子方程式 Al(OH)3+OH﹣=AlO2﹣+2H2O 。
【分析】原溶液无色,则不含有Fe3+、Cu2+;
焰色试验,火焰呈黄色,说明溶液中含有Na+;
加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42﹣离子,物质的量为0.3mol;
加入过量NaOH溶液时,由实验④的图象可知:加入NaOH时立即生成沉淀,则原溶液中不含有H+,生成白色沉淀的量与加入NaOH的量的先增大后减小,最后不再变化,则原溶液中含有Mg2+、Al3+,根据共存可知一定不含CO32﹣,n(Al3+)=n[Al(OH)3]=0.2mol﹣0.1mol=0.1mol,n(Mg2+)=n[Mg(OH)2]=0.1mol;
综上:原溶液100mL中一定含有0.1molAl3+、0.1molMg2+、Na+、0.3molSO42﹣,一定不含H+、Fe3+、Cu2+、CO32﹣,可能含有的离子有K+,据此分析解答。
【解答】解:(1)由上述分析可知,原溶液中一定含有Al3+、Mg2+、Na+、SO42﹣,一定不含H+、Fe3+、Cu2+、CO32﹣,可能含有的离子有K+,
故答案为:H+、Fe3+、Cu2+、CO32﹣;K+;
(2)溶液中可能含有的离子为K+,检验K+常用焰色试验,
故答案为:焰色试验;
(3)实验③中加入过氧化钠固体,过氧化钠和水反应生成氢氧化钠,氢氧化钠和铝离子生成氢氧化铝沉淀,和镁离子生成氢氧化镁沉淀,反应中产生的白色沉淀的成分可能是Mg(OH)2或Al(OH)3和Mg(OH)2,
故答案为:Mg(OH)2或Al(OH)3和Mg(OH)2;
(4)原溶液100mL中一定含有0.1molAl3+、0.1molMg2+、Na+、0.3molSO42﹣,可能含有的离子有K+,负电荷总量为0.3mol×2=0.6mol,正电荷总量为0.1mol×3+0.1mol×2=0.5mol<0.6mol,所以n(Na+)≤0.6mol﹣0.5mol=0.1mol,c(Na+)1mol/L,
故答案为:1mol/L;
(5)加入过量氢氧化钠,氢氧化铝溶解,发生Al(OH)3+OH﹣=AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O。
【点评】本题考查了常见离子的检验,为高频考点和常见题型,侧重考查学生的分析能力、实验能力,根据反应现象正确推断存在的离子为解题的关键,注意掌握离子的特征反应、电荷守恒关系的计算应用,题目难度中等。
