化学:2.2《化学能与电能》第二个课时
文档属性
| 名称 | 化学:2.2《化学能与电能》第二个课时 |  | |
| 格式 | zip | ||
| 文件大小 | 798.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-09 15:25:46 | ||
图片预览




文档简介
(共19张PPT)
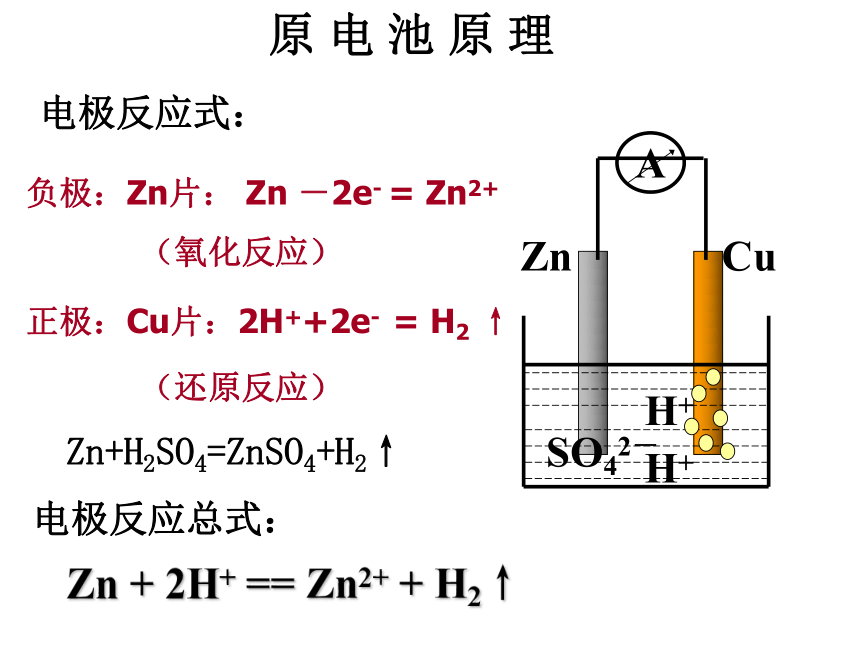
原 电 池 原 理
A
Zn
Cu
SO42-
H+
H+
电极反应式:
负极:Zn片: Zn -2e- = Zn2+
(氧化反应)
正极:Cu片:2H++2e- = H2 ↑
(还原反应)
Zn+H2SO4=ZnSO4+H2↑
电极反应总式:
Zn + 2H+ == Zn2+ + H2↑
知识要点 实例
概念
实质
构成前提
构成条件
电极构成
把化学能转变为电能的装置
化学能直接转变为电能
能自发地发生氧化还原反应
两极一液一连线
负极:还原性相对较强的材料
正极:还原性相对较弱的材料
活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
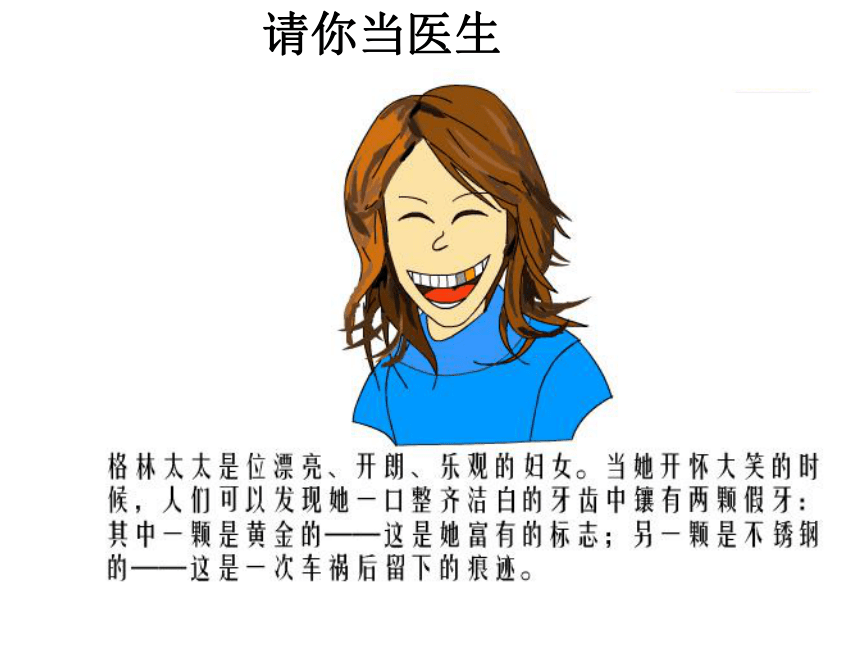
请你当医生
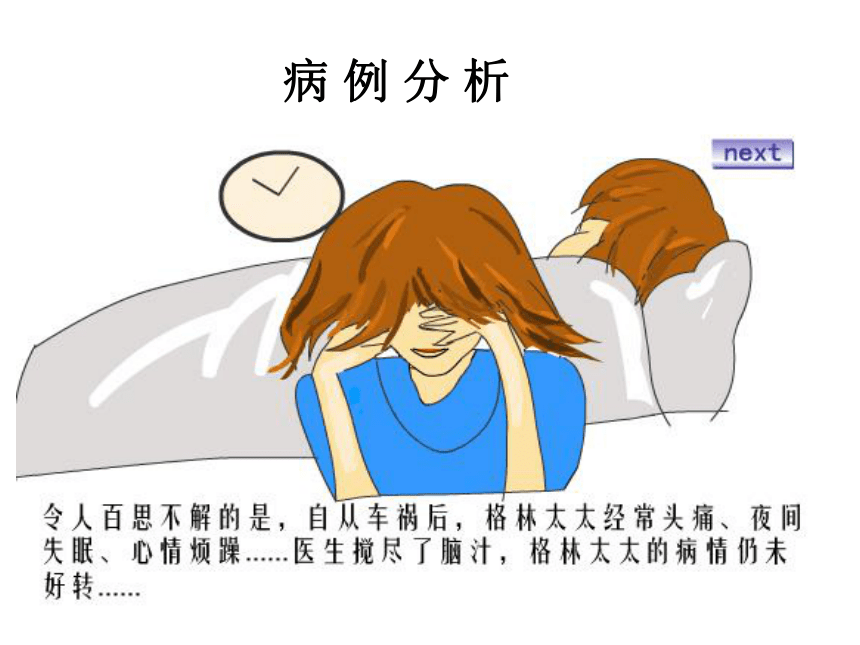
病 例 分 析
病 例 分 析
你能为她开一个药方吗?
二、发展中的化学电源
2、充电电池
铅蓄电池结构
充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时又逆向进行,使生成物恢复原状,如此充放电可循环进行,至一定周期后终止。
汽车用蓄电池
(1)铅蓄电池
(2)镍-镉碱性蓄电池 P38
(3)新一代可充电的绿色电池——锂离子电池
特点:高能电池,电压高,质量轻,贮存时间长等。
用途:电脑、手表、心脏起搏器等。
(3)燃料电池
氢氧燃料电池结构
氢氧燃料电池:
负极:
2H2+4OH— -4e— =4H2O
(氧化反应)
正极:
O2+H2O+4e—=4OH—(还原反应)
总反应:2H2+O2=2H2O
2. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )。
A. X>Y>Z B. X>Z>Y
C. Y>X>Z D. Y>Z>X
巩 固 练 习
C
3.
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
( D )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
练 习
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
练习4:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
Ag
Fe
Zn Zn-2e - = Zn2+
Cu Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
Fe Fe-2e - = Fe 2+
Ag 2H++2e - = H2↑
Fe+2H+ = Fe 2+ +H2↑
I
e-
e-
I
请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: .
1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属
拓 展:
Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu
欢迎提出
宝贵意见
原 电 池 原 理
A
Zn
Cu
SO42-
H+
H+
电极反应式:
负极:Zn片: Zn -2e- = Zn2+
(氧化反应)
正极:Cu片:2H++2e- = H2 ↑
(还原反应)
Zn+H2SO4=ZnSO4+H2↑
电极反应总式:
Zn + 2H+ == Zn2+ + H2↑
知识要点 实例
概念
实质
构成前提
构成条件
电极构成
把化学能转变为电能的装置
化学能直接转变为电能
能自发地发生氧化还原反应
两极一液一连线
负极:还原性相对较强的材料
正极:还原性相对较弱的材料
活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
请你当医生
病 例 分 析
病 例 分 析
你能为她开一个药方吗?
二、发展中的化学电源
2、充电电池
铅蓄电池结构
充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时又逆向进行,使生成物恢复原状,如此充放电可循环进行,至一定周期后终止。
汽车用蓄电池
(1)铅蓄电池
(2)镍-镉碱性蓄电池 P38
(3)新一代可充电的绿色电池——锂离子电池
特点:高能电池,电压高,质量轻,贮存时间长等。
用途:电脑、手表、心脏起搏器等。
(3)燃料电池
氢氧燃料电池结构
氢氧燃料电池:
负极:
2H2+4OH— -4e— =4H2O
(氧化反应)
正极:
O2+H2O+4e—=4OH—(还原反应)
总反应:2H2+O2=2H2O
2. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )。
A. X>Y>Z B. X>Z>Y
C. Y>X>Z D. Y>Z>X
巩 固 练 习
C
3.
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
( D )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
练 习
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
练习4:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
Ag
Fe
Zn Zn-2e - = Zn2+
Cu Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
Fe Fe-2e - = Fe 2+
Ag 2H++2e - = H2↑
Fe+2H+ = Fe 2+ +H2↑
I
e-
e-
I
请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: .
1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属
拓 展:
Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu
欢迎提出
宝贵意见
