研究有机化合物的一般步骤和方法
文档属性
| 名称 | 研究有机化合物的一般步骤和方法 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-09 00:00:00 | ||
图片预览











文档简介
(共59张PPT)
第四节 研究有机化合物的一般步骤和方法
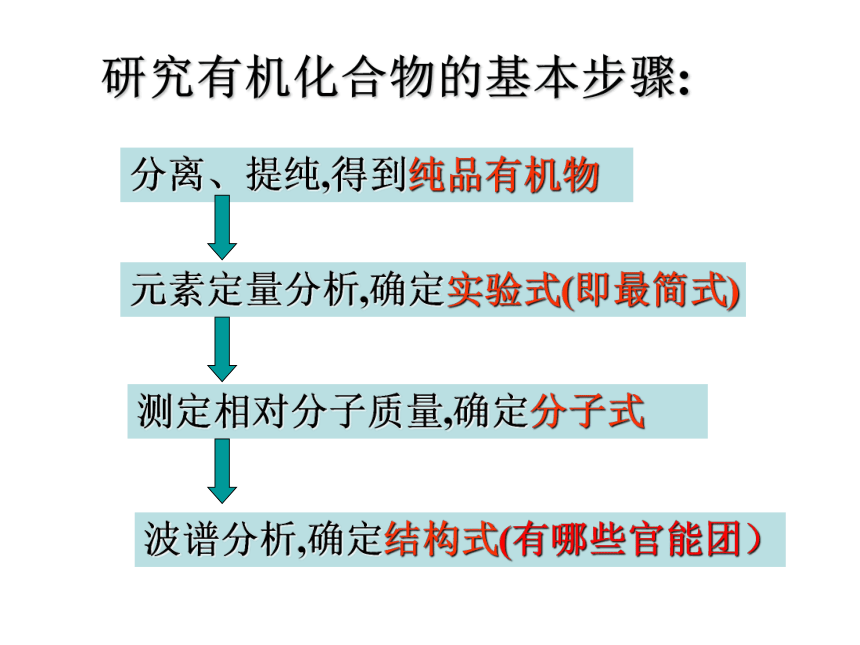
研究有机化合物的基本步骤:
分离、提纯,得到纯品有机物
元素定量分析,确定实验式(即最简式)
测定相对分子质量,确定分子式
波谱分析,确定结构式(有哪些官能团)
【思考与交流】
1、常用的分离、提纯物质的方法有哪些?
(过滤,蒸发,蒸馏,萃取,分液,重结晶,渗析等)
2、归纳分离、提纯物质的总的原则是什么?
不引入新杂质;不减少提纯物质的量
①提纯过程中不引入新的杂质(不增);
②不减少被提纯的物质(不减);
③被提纯物质要恢复原状(复原);
④被提纯物质与杂质容易分离(易分);
⑤除杂试剂应过量且过量试剂必须除尽;
⑥分离与提纯方法简便易行等原则。
⑦途径最佳(步骤少、转化率高、无负产物等)
一、分离、提纯
2、物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的
常用物理方法
蒸馏 (提纯液体有机物)
重结晶(提纯固体有机物)
萃取(将有机物从一种溶剂转移到另一种溶剂中,在加以分离)
色谱法(利用吸附剂对不同有机物吸附作用不同,分离提纯有机物)
1、化学方法:一般是加入或通过某种试剂进行化学反应。
1、蒸馏:
(2)蒸馏提纯的条件
有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)
(1)蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
(3)蒸馏的注意事项:
. 温度计水银球的部位(蒸馏烧瓶支管处)
烧瓶中放少量沸石或碎瓷片(防止暴沸)
进出水方向(下进上出)
烧瓶中所盛放液体不能超过1/3
蒸馏烧瓶
冷凝管
温度计
尾接管
冷水
热水
使用前要检查装置的气密性!
锥形瓶
铁圈石棉网
铁架台
1、大家知道的用蒸馏的方法分离、提纯物质的实验或生产有哪些?
2、实验室进行蒸馏时,用到的仪器(玻璃仪器、硅酸盐仪器)有哪些?
3、这样得到的酒精是否就是无水酒精?怎样才能得到无水酒精?
制蒸馏水、制无水酒精、分离原油,分离不同沸点的石油产品等。
【思考与交流】
仪器:温度计,蒸馏烧瓶,石棉网,铁架台,酒精灯,冷凝管,牛角管,锥形瓶
不是。要在酒精中先加入生石灰再蒸馏,才能制得无水酒精。
【思考与交流】
1、下列实验的步骤是什么?
提纯KNO3、NaCl混合物中的KNO3
(应用重结晶法)
提纯NaCl 、KNO3 混合物中的NaCl
(蒸发,过滤)
选择溶剂的条件
杂质在此溶剂中溶解度很小或很大
被提纯的有机物在此溶剂中的溶解度,受温度的影
响较大
⑴定义:
重结晶是使固体物质从溶液中以晶体状态析出的过程,是提纯、分离固体物质的重要方法之一。
2、重结晶(提纯固体有机物)
2、重结晶
1、加热溶解
2、趁热过滤
3、冷却结晶
在苯甲酸重结晶的实验
(不是,因温度过低,杂质的溶解度也会降低,部分杂质
也会析出,达不到提纯的目的;温度极低时,水也会结
晶,不利于实验进行.)
(3)阅读课本P18,归纳重结晶的步骤:
1、加热溶解
2、趁热过滤
3、冷却结晶
在苯甲酸重结晶的实验中,滤液放置冷却可以结晶出纯净的苯甲酸晶体。请你思考并与同学交流:温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
学与问
【思考与交流】
(1)如何提取溴水中的溴?
(2)实验原理是什么?
(3)用到的实验仪器(玻璃仪器)有哪些?
(4)如何选取萃取剂?
(5)这样得到的溴纯净吗?如果不纯,如何处理?
(6)实验过程要注意哪些问题?
3、萃取
萃取
固—液萃取
液—液萃取
萃取:用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法
萃取的原理:利用混合物中一种溶质在不同溶剂里的溶解度的不同
萃取的条件:(1)萃取剂和原溶剂互不相溶和不发生化学反应
(2)溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取和分液
分液是把两种互不相溶、密度不同的液体分开的方法。
主要仪器:分液漏斗、烧杯、铁架台、铁圈
操作过程:
振荡
静置
分液
待液体分层后, 将分液漏斗上的玻璃塞打开,从下端口放出下层溶液,从上端口倒出上层溶液。
查漏
加液
[练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,硝基苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水
BD
D
3、下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)酒精(水) (2)壬烷(己烷)
(3)KNO3(NaCl) (4)乙酸乙酯(乙醇)
(5)甲烷(乙烯) (6)NaCl(泥沙)
(7)溴水(水) (8)CO2(HCl)
答案:⑴、⑵、⑷用蒸馏法;⑶用重结晶法;
⑸、⑻用洗气法;⑺用萃取,分液法;
⑹过滤法
[练习4]某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质(如下表),确定通过下列步骤回收乙醇和乙酸。
物质丙酮、乙酸乙酯、乙醇、乙酸沸点(℃)56.2、77.06、78、117.9①向废液中加入烧碱溶液,调整溶液的pH=10
②将混和液放入蒸馏器中缓缓加热
③收集温度在70~85℃时的馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧使溶液的pH=10的目的是 ;
(2)在70~85℃时的馏出物的主要成份是 ;
(3)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是 。
将乙酸与碱反应先分离
乙酸乙酯和乙醇
2CH3COONa+H2SO4=Na2SO4+2CH3COOH
硫酸钠
第四节 研究有机化合物的一般步骤和方法
有机物(不纯)
有机物(纯净)
分离 提纯
研究有机化合物的一般步骤
确定实验式
元素定量分析
确定化学式
测定相对
分子质量
确定结构式
化学性质波谱分析
蒸馏
重结晶
萃取
有机物(纯净)
确定 分子式
?
首先要确定有机物中含有哪些元素
如何用实验的方法确定乙醇的组成元素
二、元素分析与相对分子质量的测定
元素定量分析的原理:
将一定量的有机物燃烧,分解为简单的无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即确定其实验式(又称为最简式)
定量分析确定物质的步骤:
计算组成各原子的整数比
(确定实验式)
测定相对分子质量
(确定分子式)
鉴定分子结构(确定物质)
有机物分子式的确定
1、有机物组成元素的确定
5.8g某有机物完全燃烧,生成CO2 13.2g , H2O 5.4g .含有哪些元素
含碳3.6g(0.3mol)
含氢0.6g(0.6mol)
含氧1.6g(0.1mol)
能否直接确定含有氧 如何确定
能否直接确定该有机物的分子式
C3H6O
若要确定它的分子式,还需要什么条件?
相对分子质量
相对分子质量116,58n=116 n=2 ∴分子式C6H12O2
2、实验式和分子式的区别
实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。
分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。
例题2:实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
答案:实验式是CH3,分子式是C2H6
3、相对分子质量的求法:
思路:求1摩尔物质的质量(摩尔质量)
⑴、已知标准状况下气体的密度,求分子量
密度的单位是:克/升 (g/L)
摩尔质量=22.4 L/mol g/L
分子量= 22.4
⑵、已知相对密度(D),求分子量
相同条件下,气体的分子量之比=密度之比=相对密度。
M1
M2
=
1
2
=
D
如:某气体对氢气的相对密度是17,则该气体的分子量为
又如:某气体对空气的相对密度是1.5,则该气体的分子量为
34
44
确定相对分子质量的方法有
① M = m/n
② M2 = DM1
③ M = 22.4 ρ
3.相对分子质量的确定——质谱法
测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。
观察谱图
【思考与交流】
1、质荷比是什么?
2、如何确定有机物
的相对分子质量?
M = 46
由于分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中的质荷比最大的就是未知物的相对分子质量
2、相对分子质量的测定——质谱法
原理:用高能电子流轰击样品,使分子失去电子变成带正电荷的分子离子和碎片离子,在磁场的作用下,由于它们的相对质量不同而使其到达检测器的时间也先后不同,其结果被记录为质谱图。
乙醇的质谱图
相对丰度(RA)——以图中最强的离子峰(基峰)高为100%,其它峰的峰高则用相对于基峰的百分数表示。
29
CH3CH2+
CH2=OH+
CH3CH=OH+
CH3CH2OH+
100%
0
60%
20%
50
30
20
质荷比最大的数据表示未知物A的相对分子质量46
[练习1].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷 C 丙烷 D 乙烯
B
[练习]某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%, 则其实验式是( )。
②确定分子式:下图是该有机物的质谱图,则其相对分子质量为( ),分子式为( )。
C4H10O
74
C4H10O
3、确定相对分子质量的方法有哪些?
(1)M = m/n
(2)M1 = DM2
(3)M = 22.4L/mol ρg/L
特殊方法:
部分有机物的实验式中H已达饱和,则该有机物的实验式就是分子式。(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得
练习:某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%。
试求该未知物A的实验式。
若要确定它的分子式,还需要什么条件?
C2H6O
不需条件C2H6O
第四节 研究有机化合物的一般步骤和方法
分子结构的鉴定
有机物的性质
结构式
(确定有机物的官能团)
分子式
计算不饱和度
推测可能的官能团
写出可能的同分异构体
利用官能团的特征性质,通过化学实验确定。
当化合物结构比较复杂时,若用化学方法,时间长、浪费试剂,因此科学上常常需要采取一些物理方法。与鉴定有机物结构有关的物理方法有红外光谱、核磁共振谱等。
1、红外光谱
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生震动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,我们就可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
三、分子结构的鉴定
可以获得化学键和官能团的信息
CH3CH2OH的红外光谱
[例2]下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:
C—O—C
C=O
不对称CH3
CH3COOCH2CH3
[练习2]有一有机物的相对分子质量为74,确定分子结构,请写出该分子的结构简式
C—O—C
对称CH3
对称CH2
CH3CH2OCH2CH3
2、核磁共振氢谱
对于CH3CH2OH、CH3—O—CH3这两种物质来说,除了氧原子的位置、连接方式不同外,碳原子、氢原子的连接方式也不同、所处的环境不同,即等效碳、等效氢的种数不同。
分析、观察核磁共振氢谱的谱图,交流如何根据核磁共振氢谱确定有机物的结构。
不同化学环境的氢原子(等效氢原子)因产生共振时吸收的频率不同,被核磁共振仪记录下来的吸收峰的个数面积不同。
吸收峰的个数=氢原子类型数目。
吸收峰的面积比=各类型氢原子数目比。
[练习]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是
A HCHO B CH3OH C HCOOH D CH3COOCH3
A
[练习3] 分子式为C3H6O2的二元混合物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断混合物的组成可能是(写结构简式) 。
CH3COOCH3和CH3CH2COOH
参考结构式,分析核磁谱图,回答下列问题:
分子中共有 种化学环境不同的氢原子;
谱线最高者表示有 个环境相同氢原子,谱线
最低者表示有 个环境相同氢原子,结构式中
的Et表示烷烃基,从什么图谱中可以推断结构
式中的这个烷烃基是 。
8
3
1
-CH2CH3
一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱列如下图:
①写出该有机物的分子式:
②写出该有机物的可能的结构简式:
C4H6O
CH2=CCHO
CH3
某同学为测定维生素C(可能含C、H或C、H、O)中碳、氢的质量分数,取维生素C样品研碎,称取该样品0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是 ,氢的质量分数是 。
(2)维生素C中是否含有氧元素?为什么?
(3)试求维生素C的实验式:
C3H4O3
n(H2O)=0.144g÷18g/mol=0.008mol
n(CO2)=0.528g÷44g/mol=0.012mol
[(0.012×12)g÷0.352g]×100%=40.91%
[(0.008×2)g÷0.352g]×100%=4.55%
40.91%
4.55%
有,因C、H含量<100% ,含O%=54.54%
n(C):n(H):n(O)=0.012:0.016:(0.352×54.54%)÷16
=0.012:0.016:0.012=3:4:3 Vc最简式为C3H4O3
O
CH2 CH CH C = O
OH OH C = C
OH OH
(3)若维生素C的相对分子质量为176,请写出
它的可能结构简式
最简式: C3H4O3 (12×3+1×4+16×3)n=176 n = 2
∴分子式:C6H8O6 ;结构简式为:
3、吗啡和海洛因都是严格查禁的毒品。吗啡分子含C:71.58%,H:6.67%,N:4.91%,其余为O。已知其相对分子质量不超300。试求出:
(1)吗啡的相对分子质量为?吗啡的分子式为 ? (2)已知海洛因是吗啡的二乙酸酯。试求:海洛因的相对分子质量为?海洛因的分子式为?
解析:n(C):n(H):n(N):n(O) = (71.58÷12):(6.67÷1):(4.91÷14):(1-71.58%-6.67%-4.91%)÷16 =17:19:1:3。
最简式:C17H19O3N ,式量为285;从相对分子质量不超过300分析,最简式就是分子式
C17H19O3N + 2CH3COOH →海洛因+2H2O,所以海洛因分子为C21H23O5N,式量为369。
第四节 研究有机化合物的一般步骤和方法
研究有机化合物的基本步骤:
分离、提纯,得到纯品有机物
元素定量分析,确定实验式(即最简式)
测定相对分子质量,确定分子式
波谱分析,确定结构式(有哪些官能团)
【思考与交流】
1、常用的分离、提纯物质的方法有哪些?
(过滤,蒸发,蒸馏,萃取,分液,重结晶,渗析等)
2、归纳分离、提纯物质的总的原则是什么?
不引入新杂质;不减少提纯物质的量
①提纯过程中不引入新的杂质(不增);
②不减少被提纯的物质(不减);
③被提纯物质要恢复原状(复原);
④被提纯物质与杂质容易分离(易分);
⑤除杂试剂应过量且过量试剂必须除尽;
⑥分离与提纯方法简便易行等原则。
⑦途径最佳(步骤少、转化率高、无负产物等)
一、分离、提纯
2、物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的
常用物理方法
蒸馏 (提纯液体有机物)
重结晶(提纯固体有机物)
萃取(将有机物从一种溶剂转移到另一种溶剂中,在加以分离)
色谱法(利用吸附剂对不同有机物吸附作用不同,分离提纯有机物)
1、化学方法:一般是加入或通过某种试剂进行化学反应。
1、蒸馏:
(2)蒸馏提纯的条件
有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)
(1)蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
(3)蒸馏的注意事项:
. 温度计水银球的部位(蒸馏烧瓶支管处)
烧瓶中放少量沸石或碎瓷片(防止暴沸)
进出水方向(下进上出)
烧瓶中所盛放液体不能超过1/3
蒸馏烧瓶
冷凝管
温度计
尾接管
冷水
热水
使用前要检查装置的气密性!
锥形瓶
铁圈石棉网
铁架台
1、大家知道的用蒸馏的方法分离、提纯物质的实验或生产有哪些?
2、实验室进行蒸馏时,用到的仪器(玻璃仪器、硅酸盐仪器)有哪些?
3、这样得到的酒精是否就是无水酒精?怎样才能得到无水酒精?
制蒸馏水、制无水酒精、分离原油,分离不同沸点的石油产品等。
【思考与交流】
仪器:温度计,蒸馏烧瓶,石棉网,铁架台,酒精灯,冷凝管,牛角管,锥形瓶
不是。要在酒精中先加入生石灰再蒸馏,才能制得无水酒精。
【思考与交流】
1、下列实验的步骤是什么?
提纯KNO3、NaCl混合物中的KNO3
(应用重结晶法)
提纯NaCl 、KNO3 混合物中的NaCl
(蒸发,过滤)
选择溶剂的条件
杂质在此溶剂中溶解度很小或很大
被提纯的有机物在此溶剂中的溶解度,受温度的影
响较大
⑴定义:
重结晶是使固体物质从溶液中以晶体状态析出的过程,是提纯、分离固体物质的重要方法之一。
2、重结晶(提纯固体有机物)
2、重结晶
1、加热溶解
2、趁热过滤
3、冷却结晶
在苯甲酸重结晶的实验
(不是,因温度过低,杂质的溶解度也会降低,部分杂质
也会析出,达不到提纯的目的;温度极低时,水也会结
晶,不利于实验进行.)
(3)阅读课本P18,归纳重结晶的步骤:
1、加热溶解
2、趁热过滤
3、冷却结晶
在苯甲酸重结晶的实验中,滤液放置冷却可以结晶出纯净的苯甲酸晶体。请你思考并与同学交流:温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
学与问
【思考与交流】
(1)如何提取溴水中的溴?
(2)实验原理是什么?
(3)用到的实验仪器(玻璃仪器)有哪些?
(4)如何选取萃取剂?
(5)这样得到的溴纯净吗?如果不纯,如何处理?
(6)实验过程要注意哪些问题?
3、萃取
萃取
固—液萃取
液—液萃取
萃取:用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法
萃取的原理:利用混合物中一种溶质在不同溶剂里的溶解度的不同
萃取的条件:(1)萃取剂和原溶剂互不相溶和不发生化学反应
(2)溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取和分液
分液是把两种互不相溶、密度不同的液体分开的方法。
主要仪器:分液漏斗、烧杯、铁架台、铁圈
操作过程:
振荡
静置
分液
待液体分层后, 将分液漏斗上的玻璃塞打开,从下端口放出下层溶液,从上端口倒出上层溶液。
查漏
加液
[练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,硝基苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水
BD
D
3、下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)酒精(水) (2)壬烷(己烷)
(3)KNO3(NaCl) (4)乙酸乙酯(乙醇)
(5)甲烷(乙烯) (6)NaCl(泥沙)
(7)溴水(水) (8)CO2(HCl)
答案:⑴、⑵、⑷用蒸馏法;⑶用重结晶法;
⑸、⑻用洗气法;⑺用萃取,分液法;
⑹过滤法
[练习4]某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质(如下表),确定通过下列步骤回收乙醇和乙酸。
物质丙酮、乙酸乙酯、乙醇、乙酸沸点(℃)56.2、77.06、78、117.9①向废液中加入烧碱溶液,调整溶液的pH=10
②将混和液放入蒸馏器中缓缓加热
③收集温度在70~85℃时的馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧使溶液的pH=10的目的是 ;
(2)在70~85℃时的馏出物的主要成份是 ;
(3)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是 。
将乙酸与碱反应先分离
乙酸乙酯和乙醇
2CH3COONa+H2SO4=Na2SO4+2CH3COOH
硫酸钠
第四节 研究有机化合物的一般步骤和方法
有机物(不纯)
有机物(纯净)
分离 提纯
研究有机化合物的一般步骤
确定实验式
元素定量分析
确定化学式
测定相对
分子质量
确定结构式
化学性质波谱分析
蒸馏
重结晶
萃取
有机物(纯净)
确定 分子式
?
首先要确定有机物中含有哪些元素
如何用实验的方法确定乙醇的组成元素
二、元素分析与相对分子质量的测定
元素定量分析的原理:
将一定量的有机物燃烧,分解为简单的无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即确定其实验式(又称为最简式)
定量分析确定物质的步骤:
计算组成各原子的整数比
(确定实验式)
测定相对分子质量
(确定分子式)
鉴定分子结构(确定物质)
有机物分子式的确定
1、有机物组成元素的确定
5.8g某有机物完全燃烧,生成CO2 13.2g , H2O 5.4g .含有哪些元素
含碳3.6g(0.3mol)
含氢0.6g(0.6mol)
含氧1.6g(0.1mol)
能否直接确定含有氧 如何确定
能否直接确定该有机物的分子式
C3H6O
若要确定它的分子式,还需要什么条件?
相对分子质量
相对分子质量116,58n=116 n=2 ∴分子式C6H12O2
2、实验式和分子式的区别
实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。
分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。
例题2:实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
答案:实验式是CH3,分子式是C2H6
3、相对分子质量的求法:
思路:求1摩尔物质的质量(摩尔质量)
⑴、已知标准状况下气体的密度,求分子量
密度的单位是:克/升 (g/L)
摩尔质量=22.4 L/mol g/L
分子量= 22.4
⑵、已知相对密度(D),求分子量
相同条件下,气体的分子量之比=密度之比=相对密度。
M1
M2
=
1
2
=
D
如:某气体对氢气的相对密度是17,则该气体的分子量为
又如:某气体对空气的相对密度是1.5,则该气体的分子量为
34
44
确定相对分子质量的方法有
① M = m/n
② M2 = DM1
③ M = 22.4 ρ
3.相对分子质量的确定——质谱法
测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。
观察谱图
【思考与交流】
1、质荷比是什么?
2、如何确定有机物
的相对分子质量?
M = 46
由于分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中的质荷比最大的就是未知物的相对分子质量
2、相对分子质量的测定——质谱法
原理:用高能电子流轰击样品,使分子失去电子变成带正电荷的分子离子和碎片离子,在磁场的作用下,由于它们的相对质量不同而使其到达检测器的时间也先后不同,其结果被记录为质谱图。
乙醇的质谱图
相对丰度(RA)——以图中最强的离子峰(基峰)高为100%,其它峰的峰高则用相对于基峰的百分数表示。
29
CH3CH2+
CH2=OH+
CH3CH=OH+
CH3CH2OH+
100%
0
60%
20%
50
30
20
质荷比最大的数据表示未知物A的相对分子质量46
[练习1].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷 C 丙烷 D 乙烯
B
[练习]某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%, 则其实验式是( )。
②确定分子式:下图是该有机物的质谱图,则其相对分子质量为( ),分子式为( )。
C4H10O
74
C4H10O
3、确定相对分子质量的方法有哪些?
(1)M = m/n
(2)M1 = DM2
(3)M = 22.4L/mol ρg/L
特殊方法:
部分有机物的实验式中H已达饱和,则该有机物的实验式就是分子式。(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得
练习:某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%。
试求该未知物A的实验式。
若要确定它的分子式,还需要什么条件?
C2H6O
不需条件C2H6O
第四节 研究有机化合物的一般步骤和方法
分子结构的鉴定
有机物的性质
结构式
(确定有机物的官能团)
分子式
计算不饱和度
推测可能的官能团
写出可能的同分异构体
利用官能团的特征性质,通过化学实验确定。
当化合物结构比较复杂时,若用化学方法,时间长、浪费试剂,因此科学上常常需要采取一些物理方法。与鉴定有机物结构有关的物理方法有红外光谱、核磁共振谱等。
1、红外光谱
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生震动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,我们就可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
三、分子结构的鉴定
可以获得化学键和官能团的信息
CH3CH2OH的红外光谱
[例2]下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:
C—O—C
C=O
不对称CH3
CH3COOCH2CH3
[练习2]有一有机物的相对分子质量为74,确定分子结构,请写出该分子的结构简式
C—O—C
对称CH3
对称CH2
CH3CH2OCH2CH3
2、核磁共振氢谱
对于CH3CH2OH、CH3—O—CH3这两种物质来说,除了氧原子的位置、连接方式不同外,碳原子、氢原子的连接方式也不同、所处的环境不同,即等效碳、等效氢的种数不同。
分析、观察核磁共振氢谱的谱图,交流如何根据核磁共振氢谱确定有机物的结构。
不同化学环境的氢原子(等效氢原子)因产生共振时吸收的频率不同,被核磁共振仪记录下来的吸收峰的个数面积不同。
吸收峰的个数=氢原子类型数目。
吸收峰的面积比=各类型氢原子数目比。
[练习]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是
A HCHO B CH3OH C HCOOH D CH3COOCH3
A
[练习3] 分子式为C3H6O2的二元混合物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断混合物的组成可能是(写结构简式) 。
CH3COOCH3和CH3CH2COOH
参考结构式,分析核磁谱图,回答下列问题:
分子中共有 种化学环境不同的氢原子;
谱线最高者表示有 个环境相同氢原子,谱线
最低者表示有 个环境相同氢原子,结构式中
的Et表示烷烃基,从什么图谱中可以推断结构
式中的这个烷烃基是 。
8
3
1
-CH2CH3
一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱列如下图:
①写出该有机物的分子式:
②写出该有机物的可能的结构简式:
C4H6O
CH2=CCHO
CH3
某同学为测定维生素C(可能含C、H或C、H、O)中碳、氢的质量分数,取维生素C样品研碎,称取该样品0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是 ,氢的质量分数是 。
(2)维生素C中是否含有氧元素?为什么?
(3)试求维生素C的实验式:
C3H4O3
n(H2O)=0.144g÷18g/mol=0.008mol
n(CO2)=0.528g÷44g/mol=0.012mol
[(0.012×12)g÷0.352g]×100%=40.91%
[(0.008×2)g÷0.352g]×100%=4.55%
40.91%
4.55%
有,因C、H含量<100% ,含O%=54.54%
n(C):n(H):n(O)=0.012:0.016:(0.352×54.54%)÷16
=0.012:0.016:0.012=3:4:3 Vc最简式为C3H4O3
O
CH2 CH CH C = O
OH OH C = C
OH OH
(3)若维生素C的相对分子质量为176,请写出
它的可能结构简式
最简式: C3H4O3 (12×3+1×4+16×3)n=176 n = 2
∴分子式:C6H8O6 ;结构简式为:
3、吗啡和海洛因都是严格查禁的毒品。吗啡分子含C:71.58%,H:6.67%,N:4.91%,其余为O。已知其相对分子质量不超300。试求出:
(1)吗啡的相对分子质量为?吗啡的分子式为 ? (2)已知海洛因是吗啡的二乙酸酯。试求:海洛因的相对分子质量为?海洛因的分子式为?
解析:n(C):n(H):n(N):n(O) = (71.58÷12):(6.67÷1):(4.91÷14):(1-71.58%-6.67%-4.91%)÷16 =17:19:1:3。
最简式:C17H19O3N ,式量为285;从相对分子质量不超过300分析,最简式就是分子式
C17H19O3N + 2CH3COOH →海洛因+2H2O,所以海洛因分子为C21H23O5N,式量为369。
