湖北省武汉市部分重点中学2020-2021学年高一下学期期中联考化学试题 Word版含答案
文档属性
| 名称 | 湖北省武汉市部分重点中学2020-2021学年高一下学期期中联考化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-05 08:41:23 | ||
图片预览



文档简介
武汉市部分重点中学2020-2021学年度下学期期中联考
高一化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Fe-56 Cu-64
一、选择题(本题共15小题,每小题3分,共计45分。在每小题给出的四个选项中,只有一项符合题目要求。)
1. 钧瓷是中国古代五大名瓷之一,以其独特的釉料及烧制方法而闻名于世。下列钧瓷的制作工艺中,主要发生了化学变化的是( )
A.掘泥 B.做坯 C.画坯 D.烧炉
A. A B. B C. C D. D
2. 下列物质性质与用途的对应关系不正确的是
选项 性质 用途
A NaClO具有强氧化性 抗击疫情中杀灭新冠病毒
B Si硬度大 “华为麒麟980”手机中芯片
C 浓硫酸具有吸水性 干燥剂
D 液氨汽化时要吸收大量的热 制冷剂
A. A B. B C. C D. D
3. 下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中久置是否变质,可以先加硝酸酸化,再加氯化钡溶液
③锌与稀硝酸反应主要得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸只能将铁氧化为Fe2+
⑤婺州窑胎体原料为高岭土[Al2Si2O5(OH)4],用氧化物形式表示为:Al2O3·2SiO2·2H2O
⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
⑦制玻璃的主要原料是纯碱、石灰石和石英砂
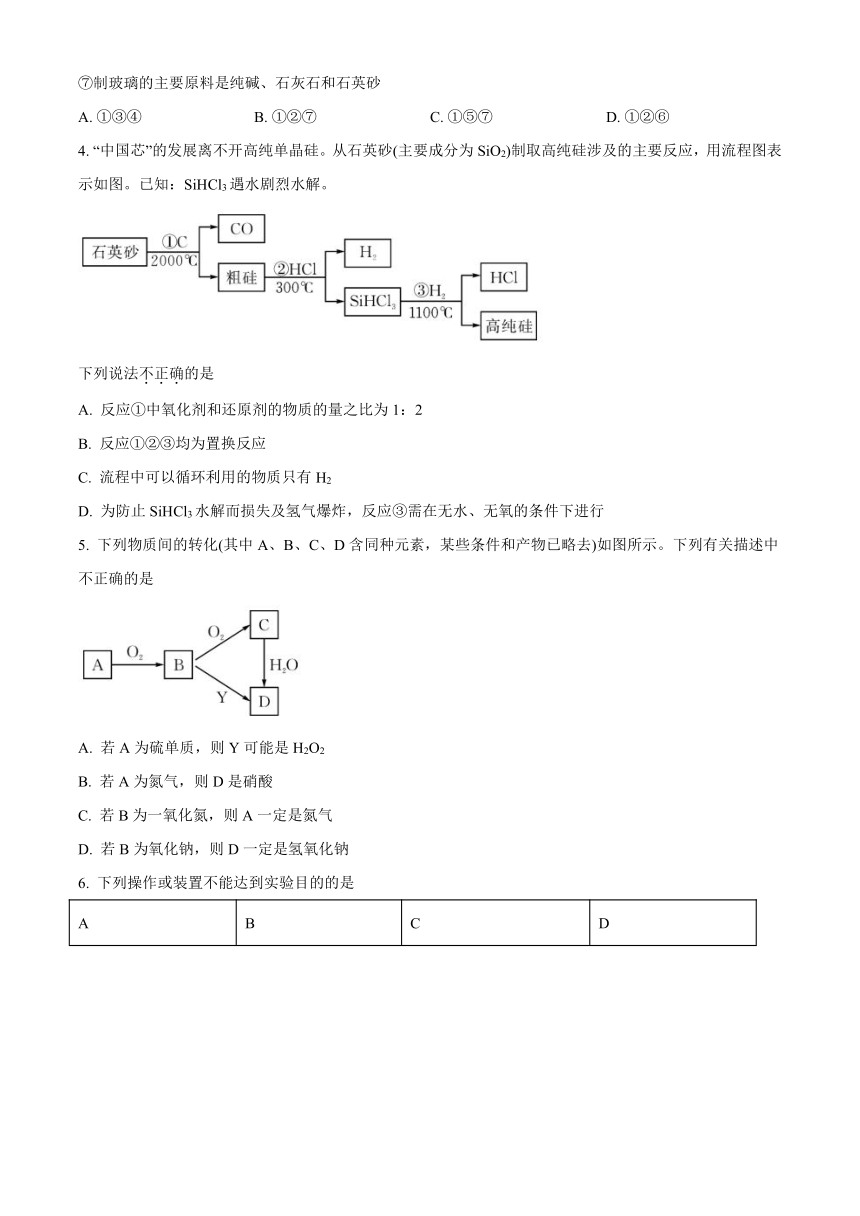
A. ①③④ B. ①②⑦ C. ①⑤⑦ D. ①②⑥
4. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应,用流程图表示如图。已知:SiHCl3遇水剧烈水解。
下列说法不正确的是
A. 反应①中氧化剂和还原剂的物质的量之比为1:2
B. 反应①②③均为置换反应
C. 流程中可以循环利用的物质只有H2
D. 为防止SiHCl3水解而损失及氢气爆炸,反应③需在无水、无氧的条件下进行
5. 下列物质间的转化(其中A、B、C、D含同种元素,某些条件和产物已略去)如图所示。下列有关描述中不正确的是
A. 若A为硫单质,则Y可能是H2O2
B. 若A为氮气,则D是硝酸
C. 若B为一氧化氮,则A一定是氮气
D. 若B为氧化钠,则D一定是氢氧化钠
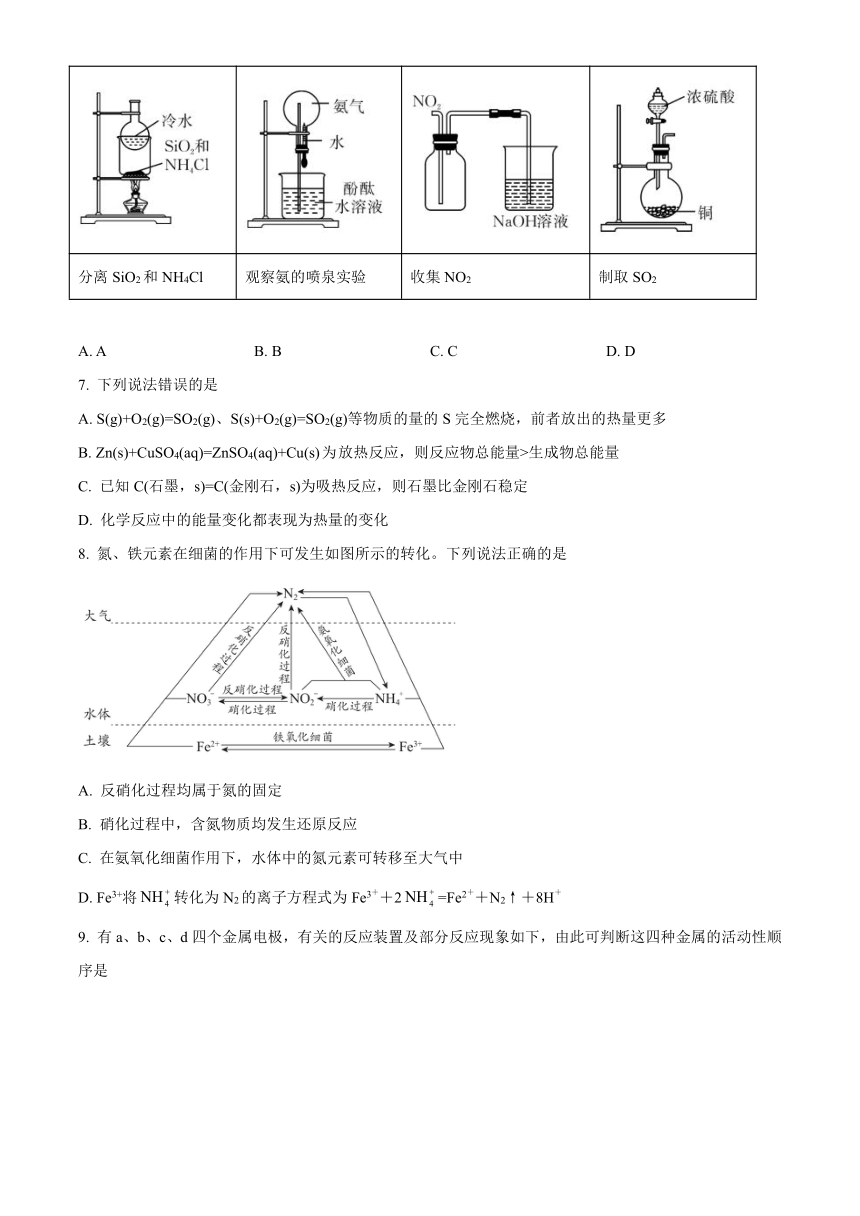
6. 下列操作或装置不能达到实验目的的是
A B C D
分离SiO2和NH4Cl 观察氨的喷泉实验 收集NO2 制取SO2
A. A B. B C. C D. D
7. 下列说法错误的是
A. S(g)+O2(g)=SO2(g)、S(s)+O2(g)=SO2(g)等物质的量的S完全燃烧,前者放出的热量更多
B. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)放热反应,则反应物总能量>生成物总能量
C. 已知C(石墨,s)=C(金刚石,s)为吸热反应,则石墨比金刚石稳定
D. 化学反应中的能量变化都表现为热量的变化
8. 氮、铁元素在细菌的作用下可发生如图所示的转化。下列说法正确的是
A. 反硝化过程均属于氮的固定
B. 硝化过程中,含氮物质均发生还原反应
C. 在氨氧化细菌作用下,水体中的氮元素可转移至大气中
D. Fe3+将转化为N2的离子方程式为Fe3++2=Fe2++N2↑+8H+
9. 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是
实验装置
部分实验现象 a极质量减小,b极质量增加 c极有气体产生,b极无变化 d极溶解,c极有气体产生 电流计指示,导线中电流从d极流向a极
A. b>c>d>a B. a>d>c>b C. d>a>b>c D. a>b>d>c
10. 在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
11. 氯酸钾和亚硫酸氢钾溶液能发生如下反应ClO+3HSO=3SO+Cl-+3H+。已知该反应的反应速率随c(H+)的增大而增大。如图所示为用ClO在单位时间内物质的量浓度变化表示的该反应的v—t图。下列说法不正确的是
A. 反应开始时速率增大可能是c(H+)增大所致
B. 纵坐标为v(Cl-)的v—t曲线与图中曲线一致
C. 图中阴影部分的面积表示t1~t2时间内ClO的物质的量减少量
D. 后期反应速率下降可能的主要原因是反应物浓度减小
12. 已知2Fe3++2I-→2Fe2++I2,为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol?L-1KI溶液,向其中加主0.1mol?L-1的FeCl31mL,充分反应,下列实验操作能检验该反应是否存在限度的是
A. 再滴加AgNO3溶液,观察是否有黄色沉淀产生
B. 再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C. 再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D. 再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成红色
13. 可逆反应2NO22NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭恒容条件下,气体密度不变
⑥密闭恒容条件下,混气平均相对分子质量不变
A. ①③④⑤ B. ②③ C. ①④⑥ D. ①②④⑥
14. 不同催化剂下合成氨反应的历程如图,吸附在催化剂表面的物种用“*”表示。下列说法错误的是
A. 工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
B. 常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
C. 反应过程中升温、加压均能加快合成氨反应的速率
D. 催化剂A的催化效率比B更好
15. 将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2气体1.344L(标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,金属离子全部沉淀,下列说法中正确的是
A. 该硝酸的物质的量浓度为12.0mol/L
B. 该合金中铜与镁的物质的量之比为1:2
C. 加入氢氧化钠后产生的沉淀质量为2.54g
D. 加入NaOH溶液的体积为600mL
二、非选择题(本题共4小题,合计55分。)
16. 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。“价—类”二维图基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
(1)A的化学式是__。
(2)C有毒,写出实验室用足量的NaOH溶液吸收C的化学方程式___。
(3)C→D→E以及C→F→E都是造成酸雨的可能途径,请写出酸雨的一种危害__。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。
可选用的实验药品如下:
①Na2SO3溶液;②浓硫酸;③Na2S溶液;④稀硫酸;⑤酸性KMnO4溶液;⑥品红溶液;⑦铜片
实验序号 预期转化 选择试剂(填序号) 证明实现转化的现象
ⅰ →
ⅱ
①、③、④ 淡黄色沉淀
ⅲ → ②、⑦、⑥
(4)实验ⅰ选择的试剂是①和___(填序号),该转化利用了Na2SO3的____性。
(5)实验ⅱ实现了+4价和-2价S向0价S的转化,写出该转化反应的离子方程式___。
(6)实验ⅲ中发生反应的化学方程式是___,证明实现该转化的现象是___。
17. 亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2(A中加热装置已略去)。
查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性KMnO4氧化成NO。
(1)装置中仪器a的名称为___。
(2)A中滴入浓硝酸之前,应先通入一段时间N2,目的是___。A中发生反应的化学方程式是___。
(3)装置B中Cu的作用是___。
(4)装置C中盛放的试剂是__。
(5)装置E的作用是___。
(6)写出NO被酸性KMnO4氧化的离子方程式___。
18. Ⅰ.(1)下列变化中属于吸热反应的是__(填字母序号)。
①液态水汽化②将胆矾加热变为白色粉末③苛性钠固体溶于水;④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥干冰升华
A.①② B.②④ C.③ D.①⑥
Ⅱ.蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)CO2(g)+4H2(g)。若1molCH4气体完全反应时,吸收akJ热量。
化学键 C—H H—H H—O
键能kJ/mol b c d
(2)写出甲烷的结构式___。
(3)C=O的键能为___kJ/mol(用含a、b、c、d的式子表示)。
(4)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应.测得甲烷物质的量随时间变化如表所示。0~10min内用水蒸气的浓度变化表示该反应的平均速率为v(H2O)=___。
时间/min 0 10 20 40 50 60
n(CH4)/mol 0.50 0.35 0.25 0.10 0.10 0.10
(5)若想加快该反应的速率,可采取的措施有___(任写一项即可)。
(6)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数比为1:4
C.混合气体密度保持不变
D.生成1molCO2的同时,有4molH—H键断裂
19. 人们应用原电池原理制作了多种电池,以满足不同的需要。请回答下列问题。
(1)请你利用下列反应Cu+2Ag+=2Ag+Cu2+设计一个化学电池,并回答下列问题:
①该电池负极材料是___,电解质溶液是__。
②在外电路中,电子方向是从___极到____极。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池。在这两个原电池中,负极分别为___。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将__能转化为__能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。在紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为__。
(4)目前正在研发的高能量密度燃料电池车,是以肼(N2H4)燃料电池作为动力来源,电池结构如图所示。
①起始时正极区与负极区KOH溶液浓度相同,工作一段时间后,KOH浓度较大的是___(填“正”或“负”)极区。
②该电池负极的电极反应式为___。
武汉市部分重点中学2020-2021学年度下学期期中联考
高一化学试卷 答案版
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Fe-56 Cu-64
一、选择题(本题共15小题,每小题3分,共计45分。在每小题给出的四个选项中,只有一项符合题目要求。)
1. 钧瓷是中国古代五大名瓷之一,以其独特的釉料及烧制方法而闻名于世。下列钧瓷的制作工艺中,主要发生了化学变化的是( )
A.掘泥 B.做坯 C.画坯 D.烧炉
A. A B. B C. C D. D
【答案】D
2. 下列物质性质与用途的对应关系不正确的是
选项 性质 用途
A NaClO具有强氧化性 抗击疫情中杀灭新冠病毒
B Si硬度大 “华为麒麟980”手机中芯片
C 浓硫酸具有吸水性 干燥剂
D 液氨汽化时要吸收大量的热 制冷剂
A. A B. B C. C D. D
【答案】B
3. 下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中久置是否变质,可以先加硝酸酸化,再加氯化钡溶液
③锌与稀硝酸反应主要得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸只能将铁氧化为Fe2+
⑤婺州窑胎体原料为高岭土[Al2Si2O5(OH)4],用氧化物形式表示为:Al2O3·2SiO2·2H2O
⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
⑦制玻璃的主要原料是纯碱、石灰石和石英砂
A. ①③④ B. ①②⑦ C. ①⑤⑦ D. ①②⑥
【答案】C
4. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应,用流程图表示如图。已知:SiHCl3遇水剧烈水解。
下列说法不正确的是
A. 反应①中氧化剂和还原剂的物质的量之比为1:2
B. 反应①②③均为置换反应
C. 流程中可以循环利用的物质只有H2
D. 为防止SiHCl3水解而损失及氢气爆炸,反应③需在无水、无氧的条件下进行
【答案】C
5. 下列物质间的转化(其中A、B、C、D含同种元素,某些条件和产物已略去)如图所示。下列有关描述中不正确的是
A. 若A为硫单质,则Y可能是H2O2
B. 若A为氮气,则D是硝酸
C. 若B为一氧化氮,则A一定是氮气
D. 若B为氧化钠,则D一定是氢氧化钠
【答案】C
6. 下列操作或装置不能达到实验目的的是
A B C D
分离SiO2和NH4Cl 观察氨的喷泉实验 收集NO2 制取SO2
A. A B. B C. C D. D
【答案】D
7. 下列说法错误的是
A. S(g)+O2(g)=SO2(g)、S(s)+O2(g)=SO2(g)等物质的量的S完全燃烧,前者放出的热量更多
B. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)放热反应,则反应物总能量>生成物总能量
C. 已知C(石墨,s)=C(金刚石,s)为吸热反应,则石墨比金刚石稳定
D. 化学反应中的能量变化都表现为热量的变化
【答案】D
8. 氮、铁元素在细菌的作用下可发生如图所示的转化。下列说法正确的是
A. 反硝化过程均属于氮的固定
B. 硝化过程中,含氮物质均发生还原反应
C. 在氨氧化细菌作用下,水体中的氮元素可转移至大气中
D. Fe3+将转化为N2的离子方程式为Fe3++2=Fe2++N2↑+8H+
【答案】C
9. 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是
实验装置
部分实验现象 a极质量减小,b极质量增加 c极有气体产生,b极无变化 d极溶解,c极有气体产生 电流计指示,导线中电流从d极流向a极
A. b>c>d>a B. a>d>c>b C. d>a>b>c D. a>b>d>c
【答案】B
10. 在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
【答案】C
11. 氯酸钾和亚硫酸氢钾溶液能发生如下反应ClO+3HSO=3SO+Cl-+3H+。已知该反应的反应速率随c(H+)的增大而增大。如图所示为用ClO在单位时间内物质的量浓度变化表示的该反应的v—t图。下列说法不正确的是
A. 反应开始时速率增大可能是c(H+)增大所致
B. 纵坐标为v(Cl-)的v—t曲线与图中曲线一致
C. 图中阴影部分的面积表示t1~t2时间内ClO的物质的量减少量
D. 后期反应速率下降可能的主要原因是反应物浓度减小
【答案】C
12. 已知2Fe3++2I-→2Fe2++I2,为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol?L-1KI溶液,向其中加主0.1mol?L-1的FeCl31mL,充分反应,下列实验操作能检验该反应是否存在限度的是
A. 再滴加AgNO3溶液,观察是否有黄色沉淀产生
B. 再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C. 再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D. 再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成红色
【答案】D
13. 可逆反应2NO22NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭恒容条件下,气体密度不变
⑥密闭恒容条件下,混气平均相对分子质量不变
A. ①③④⑤ B. ②③ C. ①④⑥ D. ①②④⑥
【答案】C
14. 不同催化剂下合成氨反应的历程如图,吸附在催化剂表面的物种用“*”表示。下列说法错误的是
A. 工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
B. 常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
C. 反应过程中升温、加压均能加快合成氨反应的速率
D. 催化剂A的催化效率比B更好
【答案】D
15. 将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2气体1.344L(标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,金属离子全部沉淀,下列说法中正确的是
A. 该硝酸的物质的量浓度为12.0mol/L
B. 该合金中铜与镁的物质的量之比为1:2
C. 加入氢氧化钠后产生的沉淀质量为2.54g
D. 加入NaOH溶液的体积为600mL
【答案】C
二、非选择题(本题共4小题,合计55分。)
16. 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。“价—类”二维图基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
(1)A的化学式是__。
(2)C有毒,写出实验室用足量的NaOH溶液吸收C的化学方程式___。
(3)C→D→E以及C→F→E都是造成酸雨的可能途径,请写出酸雨的一种危害__。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。
可选用的实验药品如下:
①Na2SO3溶液;②浓硫酸;③Na2S溶液;④稀硫酸;⑤酸性KMnO4溶液;⑥品红溶液;⑦铜片
实验序号 预期转化 选择试剂(填序号) 证明实现转化的现象
ⅰ →
ⅱ
①、③、④ 淡黄色沉淀
ⅲ → ②、⑦、⑥
(4)实验ⅰ选择的试剂是①和___(填序号),该转化利用了Na2SO3的____性。
(5)实验ⅱ实现了+4价和-2价S向0价S的转化,写出该转化反应的离子方程式___。
(6)实验ⅲ中发生反应的化学方程式是___,证明实现该转化的现象是___。
【答案】 (1). H2S (2). SO2+2NaOH=Na2SO3+H2O (3). 腐蚀建筑物(或使土壤酸化) (4). ⑤ (5). 还原 (6). SO+2S2-+6H+=3S↓+3H2O (7). Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (8). 将产生气体通入品红溶液,品红溶液褪色
17. 亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2(A中加热装置已略去)。
查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性KMnO4氧化成NO。
(1)装置中仪器a的名称为___。
(2)A中滴入浓硝酸之前,应先通入一段时间N2,目的是___。A中发生反应的化学方程式是___。
(3)装置B中Cu的作用是___。
(4)装置C中盛放的试剂是__。
(5)装置E的作用是___。
(6)写出NO被酸性KMnO4氧化的离子方程式___。
【答案】 (1). 三颈烧瓶 (2). 排尽装置中的空气,防止对后续实验有干扰 (3). C+4HNO3CO2↑+4NO2↑+2H2O (4). 还原剂或把HNO3还原为NO (5). 碱石灰(或生石灰或氢氧化钠固体) (6). 吸收有毒气体NO,防止空气污染 (7). 5NO+3MnO+4H+=5NO+3Mn2++2H2O
18. Ⅰ.(1)下列变化中属于吸热反应的是__(填字母序号)。
①液态水汽化②将胆矾加热变为白色粉末③苛性钠固体溶于水;④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥干冰升华
A.①② B.②④ C.③ D.①⑥
Ⅱ.蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)CO2(g)+4H2(g)。若1molCH4气体完全反应时,吸收akJ热量。
化学键 C—H H—H H—O
键能kJ/mol b c d
(2)写出甲烷的结构式___。
(3)C=O的键能为___kJ/mol(用含a、b、c、d的式子表示)。
(4)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应.测得甲烷物质的量随时间变化如表所示。0~10min内用水蒸气的浓度变化表示该反应的平均速率为v(H2O)=___。
时间/min 0 10 20 40 50 60
n(CH4)/mol 0.50 0.35 0.25 0.10 0.10 0.10
(5)若想加快该反应的速率,可采取的措施有___(任写一项即可)。
(6)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数比为1:4
C.混合气体密度保持不变
D.生成1molCO2的同时,有4molH—H键断裂
【答案】 (1). B (2). (3). 2b+2d-2c- (4). 0.06mol·L-1·min-1 (5). 升温(或加压或采用合适的催化剂) (6). AD
19. 人们应用原电池原理制作了多种电池,以满足不同的需要。请回答下列问题。
(1)请你利用下列反应Cu+2Ag+=2Ag+Cu2+设计一个化学电池,并回答下列问题:
①该电池负极材料是___,电解质溶液是__。
②在外电路中,电子方向是从___极到____极。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池。在这两个原电池中,负极分别为___。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将__能转化为__能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。在紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为__。
(4)目前正在研发的高能量密度燃料电池车,是以肼(N2H4)燃料电池作为动力来源,电池结构如图所示。
①起始时正极区与负极区KOH溶液浓度相同,工作一段时间后,KOH浓度较大的是___(填“正”或“负”)极区。
②该电池负极的电极反应式为___。
【答案】 (1). Cu (2). AgNO3溶液 (3). 负 (4). 正 (5). B (6). 光 (7). 电 (8). Zn-2e-+2OH-=Zn(OH)2 (9). 正 (10). N2H4+4OH--4e-=N2+4H2O
高一化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Fe-56 Cu-64
一、选择题(本题共15小题,每小题3分,共计45分。在每小题给出的四个选项中,只有一项符合题目要求。)
1. 钧瓷是中国古代五大名瓷之一,以其独特的釉料及烧制方法而闻名于世。下列钧瓷的制作工艺中,主要发生了化学变化的是( )
A.掘泥 B.做坯 C.画坯 D.烧炉
A. A B. B C. C D. D
2. 下列物质性质与用途的对应关系不正确的是
选项 性质 用途
A NaClO具有强氧化性 抗击疫情中杀灭新冠病毒
B Si硬度大 “华为麒麟980”手机中芯片
C 浓硫酸具有吸水性 干燥剂
D 液氨汽化时要吸收大量的热 制冷剂
A. A B. B C. C D. D
3. 下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中久置是否变质,可以先加硝酸酸化,再加氯化钡溶液
③锌与稀硝酸反应主要得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸只能将铁氧化为Fe2+
⑤婺州窑胎体原料为高岭土[Al2Si2O5(OH)4],用氧化物形式表示为:Al2O3·2SiO2·2H2O
⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
⑦制玻璃的主要原料是纯碱、石灰石和石英砂
A. ①③④ B. ①②⑦ C. ①⑤⑦ D. ①②⑥
4. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应,用流程图表示如图。已知:SiHCl3遇水剧烈水解。
下列说法不正确的是
A. 反应①中氧化剂和还原剂的物质的量之比为1:2
B. 反应①②③均为置换反应
C. 流程中可以循环利用的物质只有H2
D. 为防止SiHCl3水解而损失及氢气爆炸,反应③需在无水、无氧的条件下进行
5. 下列物质间的转化(其中A、B、C、D含同种元素,某些条件和产物已略去)如图所示。下列有关描述中不正确的是
A. 若A为硫单质,则Y可能是H2O2
B. 若A为氮气,则D是硝酸
C. 若B为一氧化氮,则A一定是氮气
D. 若B为氧化钠,则D一定是氢氧化钠
6. 下列操作或装置不能达到实验目的的是
A B C D
分离SiO2和NH4Cl 观察氨的喷泉实验 收集NO2 制取SO2
A. A B. B C. C D. D
7. 下列说法错误的是
A. S(g)+O2(g)=SO2(g)、S(s)+O2(g)=SO2(g)等物质的量的S完全燃烧,前者放出的热量更多
B. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)放热反应,则反应物总能量>生成物总能量
C. 已知C(石墨,s)=C(金刚石,s)为吸热反应,则石墨比金刚石稳定
D. 化学反应中的能量变化都表现为热量的变化
8. 氮、铁元素在细菌的作用下可发生如图所示的转化。下列说法正确的是
A. 反硝化过程均属于氮的固定
B. 硝化过程中,含氮物质均发生还原反应
C. 在氨氧化细菌作用下,水体中的氮元素可转移至大气中
D. Fe3+将转化为N2的离子方程式为Fe3++2=Fe2++N2↑+8H+
9. 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是
实验装置
部分实验现象 a极质量减小,b极质量增加 c极有气体产生,b极无变化 d极溶解,c极有气体产生 电流计指示,导线中电流从d极流向a极
A. b>c>d>a B. a>d>c>b C. d>a>b>c D. a>b>d>c
10. 在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
11. 氯酸钾和亚硫酸氢钾溶液能发生如下反应ClO+3HSO=3SO+Cl-+3H+。已知该反应的反应速率随c(H+)的增大而增大。如图所示为用ClO在单位时间内物质的量浓度变化表示的该反应的v—t图。下列说法不正确的是
A. 反应开始时速率增大可能是c(H+)增大所致
B. 纵坐标为v(Cl-)的v—t曲线与图中曲线一致
C. 图中阴影部分的面积表示t1~t2时间内ClO的物质的量减少量
D. 后期反应速率下降可能的主要原因是反应物浓度减小
12. 已知2Fe3++2I-→2Fe2++I2,为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol?L-1KI溶液,向其中加主0.1mol?L-1的FeCl31mL,充分反应,下列实验操作能检验该反应是否存在限度的是
A. 再滴加AgNO3溶液,观察是否有黄色沉淀产生
B. 再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C. 再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D. 再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成红色
13. 可逆反应2NO22NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭恒容条件下,气体密度不变
⑥密闭恒容条件下,混气平均相对分子质量不变
A. ①③④⑤ B. ②③ C. ①④⑥ D. ①②④⑥
14. 不同催化剂下合成氨反应的历程如图,吸附在催化剂表面的物种用“*”表示。下列说法错误的是
A. 工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
B. 常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
C. 反应过程中升温、加压均能加快合成氨反应的速率
D. 催化剂A的催化效率比B更好
15. 将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2气体1.344L(标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,金属离子全部沉淀,下列说法中正确的是
A. 该硝酸的物质的量浓度为12.0mol/L
B. 该合金中铜与镁的物质的量之比为1:2
C. 加入氢氧化钠后产生的沉淀质量为2.54g
D. 加入NaOH溶液的体积为600mL
二、非选择题(本题共4小题,合计55分。)
16. 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。“价—类”二维图基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
(1)A的化学式是__。
(2)C有毒,写出实验室用足量的NaOH溶液吸收C的化学方程式___。
(3)C→D→E以及C→F→E都是造成酸雨的可能途径,请写出酸雨的一种危害__。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。
可选用的实验药品如下:
①Na2SO3溶液;②浓硫酸;③Na2S溶液;④稀硫酸;⑤酸性KMnO4溶液;⑥品红溶液;⑦铜片
实验序号 预期转化 选择试剂(填序号) 证明实现转化的现象
ⅰ →
ⅱ
①、③、④ 淡黄色沉淀
ⅲ → ②、⑦、⑥
(4)实验ⅰ选择的试剂是①和___(填序号),该转化利用了Na2SO3的____性。
(5)实验ⅱ实现了+4价和-2价S向0价S的转化,写出该转化反应的离子方程式___。
(6)实验ⅲ中发生反应的化学方程式是___,证明实现该转化的现象是___。
17. 亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2(A中加热装置已略去)。
查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性KMnO4氧化成NO。
(1)装置中仪器a的名称为___。
(2)A中滴入浓硝酸之前,应先通入一段时间N2,目的是___。A中发生反应的化学方程式是___。
(3)装置B中Cu的作用是___。
(4)装置C中盛放的试剂是__。
(5)装置E的作用是___。
(6)写出NO被酸性KMnO4氧化的离子方程式___。
18. Ⅰ.(1)下列变化中属于吸热反应的是__(填字母序号)。
①液态水汽化②将胆矾加热变为白色粉末③苛性钠固体溶于水;④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥干冰升华
A.①② B.②④ C.③ D.①⑥
Ⅱ.蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)CO2(g)+4H2(g)。若1molCH4气体完全反应时,吸收akJ热量。
化学键 C—H H—H H—O
键能kJ/mol b c d
(2)写出甲烷的结构式___。
(3)C=O的键能为___kJ/mol(用含a、b、c、d的式子表示)。
(4)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应.测得甲烷物质的量随时间变化如表所示。0~10min内用水蒸气的浓度变化表示该反应的平均速率为v(H2O)=___。
时间/min 0 10 20 40 50 60
n(CH4)/mol 0.50 0.35 0.25 0.10 0.10 0.10
(5)若想加快该反应的速率,可采取的措施有___(任写一项即可)。
(6)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数比为1:4
C.混合气体密度保持不变
D.生成1molCO2的同时,有4molH—H键断裂
19. 人们应用原电池原理制作了多种电池,以满足不同的需要。请回答下列问题。
(1)请你利用下列反应Cu+2Ag+=2Ag+Cu2+设计一个化学电池,并回答下列问题:
①该电池负极材料是___,电解质溶液是__。
②在外电路中,电子方向是从___极到____极。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池。在这两个原电池中,负极分别为___。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将__能转化为__能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。在紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为__。
(4)目前正在研发的高能量密度燃料电池车,是以肼(N2H4)燃料电池作为动力来源,电池结构如图所示。
①起始时正极区与负极区KOH溶液浓度相同,工作一段时间后,KOH浓度较大的是___(填“正”或“负”)极区。
②该电池负极的电极反应式为___。
武汉市部分重点中学2020-2021学年度下学期期中联考
高一化学试卷 答案版
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Fe-56 Cu-64
一、选择题(本题共15小题,每小题3分,共计45分。在每小题给出的四个选项中,只有一项符合题目要求。)
1. 钧瓷是中国古代五大名瓷之一,以其独特的釉料及烧制方法而闻名于世。下列钧瓷的制作工艺中,主要发生了化学变化的是( )
A.掘泥 B.做坯 C.画坯 D.烧炉
A. A B. B C. C D. D
【答案】D
2. 下列物质性质与用途的对应关系不正确的是
选项 性质 用途
A NaClO具有强氧化性 抗击疫情中杀灭新冠病毒
B Si硬度大 “华为麒麟980”手机中芯片
C 浓硫酸具有吸水性 干燥剂
D 液氨汽化时要吸收大量的热 制冷剂
A. A B. B C. C D. D
【答案】B
3. 下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中久置是否变质,可以先加硝酸酸化,再加氯化钡溶液
③锌与稀硝酸反应主要得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸只能将铁氧化为Fe2+
⑤婺州窑胎体原料为高岭土[Al2Si2O5(OH)4],用氧化物形式表示为:Al2O3·2SiO2·2H2O
⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
⑦制玻璃的主要原料是纯碱、石灰石和石英砂
A. ①③④ B. ①②⑦ C. ①⑤⑦ D. ①②⑥
【答案】C
4. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应,用流程图表示如图。已知:SiHCl3遇水剧烈水解。
下列说法不正确的是
A. 反应①中氧化剂和还原剂的物质的量之比为1:2
B. 反应①②③均为置换反应
C. 流程中可以循环利用的物质只有H2
D. 为防止SiHCl3水解而损失及氢气爆炸,反应③需在无水、无氧的条件下进行
【答案】C
5. 下列物质间的转化(其中A、B、C、D含同种元素,某些条件和产物已略去)如图所示。下列有关描述中不正确的是
A. 若A为硫单质,则Y可能是H2O2
B. 若A为氮气,则D是硝酸
C. 若B为一氧化氮,则A一定是氮气
D. 若B为氧化钠,则D一定是氢氧化钠
【答案】C
6. 下列操作或装置不能达到实验目的的是
A B C D
分离SiO2和NH4Cl 观察氨的喷泉实验 收集NO2 制取SO2
A. A B. B C. C D. D
【答案】D
7. 下列说法错误的是
A. S(g)+O2(g)=SO2(g)、S(s)+O2(g)=SO2(g)等物质的量的S完全燃烧,前者放出的热量更多
B. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)放热反应,则反应物总能量>生成物总能量
C. 已知C(石墨,s)=C(金刚石,s)为吸热反应,则石墨比金刚石稳定
D. 化学反应中的能量变化都表现为热量的变化
【答案】D
8. 氮、铁元素在细菌的作用下可发生如图所示的转化。下列说法正确的是
A. 反硝化过程均属于氮的固定
B. 硝化过程中,含氮物质均发生还原反应
C. 在氨氧化细菌作用下,水体中的氮元素可转移至大气中
D. Fe3+将转化为N2的离子方程式为Fe3++2=Fe2++N2↑+8H+
【答案】C
9. 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是
实验装置
部分实验现象 a极质量减小,b极质量增加 c极有气体产生,b极无变化 d极溶解,c极有气体产生 电流计指示,导线中电流从d极流向a极
A. b>c>d>a B. a>d>c>b C. d>a>b>c D. a>b>d>c
【答案】B
10. 在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
【答案】C
11. 氯酸钾和亚硫酸氢钾溶液能发生如下反应ClO+3HSO=3SO+Cl-+3H+。已知该反应的反应速率随c(H+)的增大而增大。如图所示为用ClO在单位时间内物质的量浓度变化表示的该反应的v—t图。下列说法不正确的是
A. 反应开始时速率增大可能是c(H+)增大所致
B. 纵坐标为v(Cl-)的v—t曲线与图中曲线一致
C. 图中阴影部分的面积表示t1~t2时间内ClO的物质的量减少量
D. 后期反应速率下降可能的主要原因是反应物浓度减小
【答案】C
12. 已知2Fe3++2I-→2Fe2++I2,为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol?L-1KI溶液,向其中加主0.1mol?L-1的FeCl31mL,充分反应,下列实验操作能检验该反应是否存在限度的是
A. 再滴加AgNO3溶液,观察是否有黄色沉淀产生
B. 再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C. 再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D. 再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成红色
【答案】D
13. 可逆反应2NO22NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭恒容条件下,气体密度不变
⑥密闭恒容条件下,混气平均相对分子质量不变
A. ①③④⑤ B. ②③ C. ①④⑥ D. ①②④⑥
【答案】C
14. 不同催化剂下合成氨反应的历程如图,吸附在催化剂表面的物种用“*”表示。下列说法错误的是
A. 工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
B. 常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
C. 反应过程中升温、加压均能加快合成氨反应的速率
D. 催化剂A的催化效率比B更好
【答案】D
15. 将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2气体1.344L(标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,金属离子全部沉淀,下列说法中正确的是
A. 该硝酸的物质的量浓度为12.0mol/L
B. 该合金中铜与镁的物质的量之比为1:2
C. 加入氢氧化钠后产生的沉淀质量为2.54g
D. 加入NaOH溶液的体积为600mL
【答案】C
二、非选择题(本题共4小题,合计55分。)
16. 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。“价—类”二维图基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
(1)A的化学式是__。
(2)C有毒,写出实验室用足量的NaOH溶液吸收C的化学方程式___。
(3)C→D→E以及C→F→E都是造成酸雨的可能途径,请写出酸雨的一种危害__。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。
可选用的实验药品如下:
①Na2SO3溶液;②浓硫酸;③Na2S溶液;④稀硫酸;⑤酸性KMnO4溶液;⑥品红溶液;⑦铜片
实验序号 预期转化 选择试剂(填序号) 证明实现转化的现象
ⅰ →
ⅱ
①、③、④ 淡黄色沉淀
ⅲ → ②、⑦、⑥
(4)实验ⅰ选择的试剂是①和___(填序号),该转化利用了Na2SO3的____性。
(5)实验ⅱ实现了+4价和-2价S向0价S的转化,写出该转化反应的离子方程式___。
(6)实验ⅲ中发生反应的化学方程式是___,证明实现该转化的现象是___。
【答案】 (1). H2S (2). SO2+2NaOH=Na2SO3+H2O (3). 腐蚀建筑物(或使土壤酸化) (4). ⑤ (5). 还原 (6). SO+2S2-+6H+=3S↓+3H2O (7). Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (8). 将产生气体通入品红溶液,品红溶液褪色
17. 亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2(A中加热装置已略去)。
查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性KMnO4氧化成NO。
(1)装置中仪器a的名称为___。
(2)A中滴入浓硝酸之前,应先通入一段时间N2,目的是___。A中发生反应的化学方程式是___。
(3)装置B中Cu的作用是___。
(4)装置C中盛放的试剂是__。
(5)装置E的作用是___。
(6)写出NO被酸性KMnO4氧化的离子方程式___。
【答案】 (1). 三颈烧瓶 (2). 排尽装置中的空气,防止对后续实验有干扰 (3). C+4HNO3CO2↑+4NO2↑+2H2O (4). 还原剂或把HNO3还原为NO (5). 碱石灰(或生石灰或氢氧化钠固体) (6). 吸收有毒气体NO,防止空气污染 (7). 5NO+3MnO+4H+=5NO+3Mn2++2H2O
18. Ⅰ.(1)下列变化中属于吸热反应的是__(填字母序号)。
①液态水汽化②将胆矾加热变为白色粉末③苛性钠固体溶于水;④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥干冰升华
A.①② B.②④ C.③ D.①⑥
Ⅱ.蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)CO2(g)+4H2(g)。若1molCH4气体完全反应时,吸收akJ热量。
化学键 C—H H—H H—O
键能kJ/mol b c d
(2)写出甲烷的结构式___。
(3)C=O的键能为___kJ/mol(用含a、b、c、d的式子表示)。
(4)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应.测得甲烷物质的量随时间变化如表所示。0~10min内用水蒸气的浓度变化表示该反应的平均速率为v(H2O)=___。
时间/min 0 10 20 40 50 60
n(CH4)/mol 0.50 0.35 0.25 0.10 0.10 0.10
(5)若想加快该反应的速率,可采取的措施有___(任写一项即可)。
(6)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数比为1:4
C.混合气体密度保持不变
D.生成1molCO2的同时,有4molH—H键断裂
【答案】 (1). B (2). (3). 2b+2d-2c- (4). 0.06mol·L-1·min-1 (5). 升温(或加压或采用合适的催化剂) (6). AD
19. 人们应用原电池原理制作了多种电池,以满足不同的需要。请回答下列问题。
(1)请你利用下列反应Cu+2Ag+=2Ag+Cu2+设计一个化学电池,并回答下列问题:
①该电池负极材料是___,电解质溶液是__。
②在外电路中,电子方向是从___极到____极。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池。在这两个原电池中,负极分别为___。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将__能转化为__能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。在紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为__。
(4)目前正在研发的高能量密度燃料电池车,是以肼(N2H4)燃料电池作为动力来源,电池结构如图所示。
①起始时正极区与负极区KOH溶液浓度相同,工作一段时间后,KOH浓度较大的是___(填“正”或“负”)极区。
②该电池负极的电极反应式为___。
【答案】 (1). Cu (2). AgNO3溶液 (3). 负 (4). 正 (5). B (6). 光 (7). 电 (8). Zn-2e-+2OH-=Zn(OH)2 (9). 正 (10). N2H4+4OH--4e-=N2+4H2O
同课章节目录
