化学平衡图像
图片预览





文档简介
(共23张PPT)
新课标苏教版选修四
化学平衡图像
化学平衡图象分析的一般方法:
一看面:
看清图象中横坐标和纵坐标的含义。
二看线:
弄清图象中线的斜率或线走势的意义
三看点:
明确曲线的起点、终点、交点及拐点等
四看是否需要辅助线。
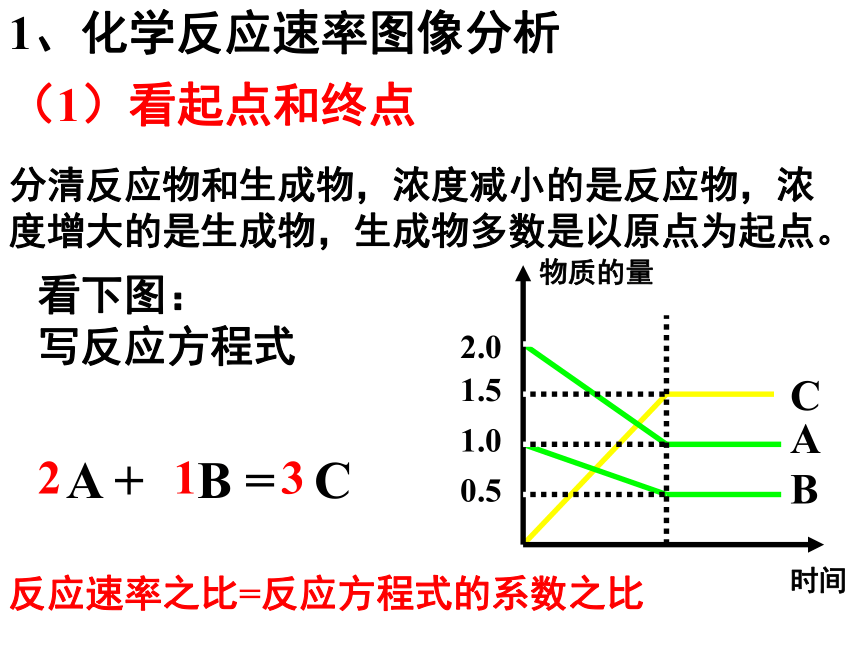
1、化学反应速率图像分析
(1)看起点和终点
分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数是以原点为起点。
看下图:
写反应方程式
0.5
1.5
1.0
2.0
物质的量
C
A
B
时间
A + B = C
2
1
3
反应速率之比=反应方程式的系数之比
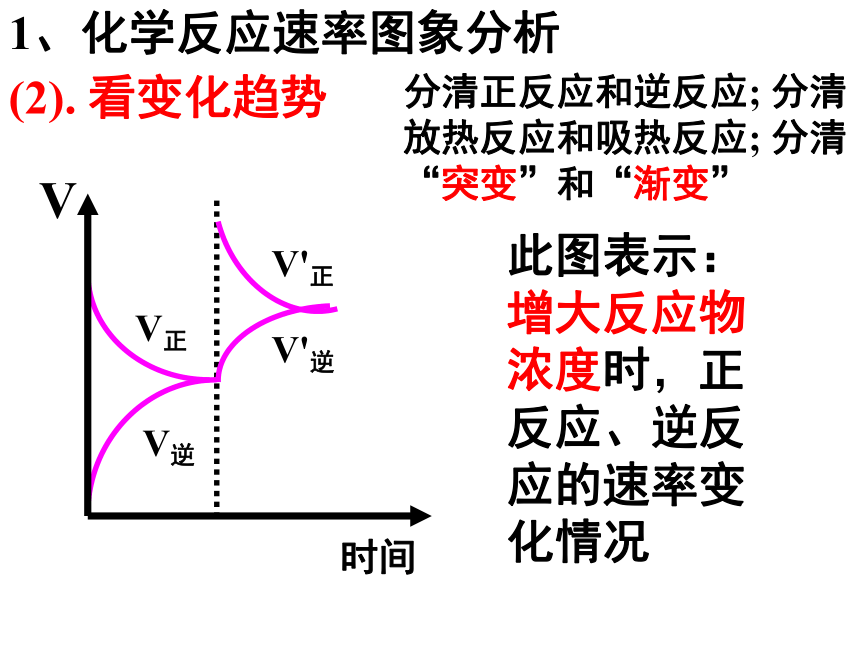
1、化学反应速率图象分析
(2). 看变化趋势
分清正反应和逆反应; 分清放热反应和吸热反应; 分清“突变”和“渐变”
V正
V逆
V'正
V'逆
V
时间
此图表示:增大反应物浓度时,正反应、逆反应的速率变化情况
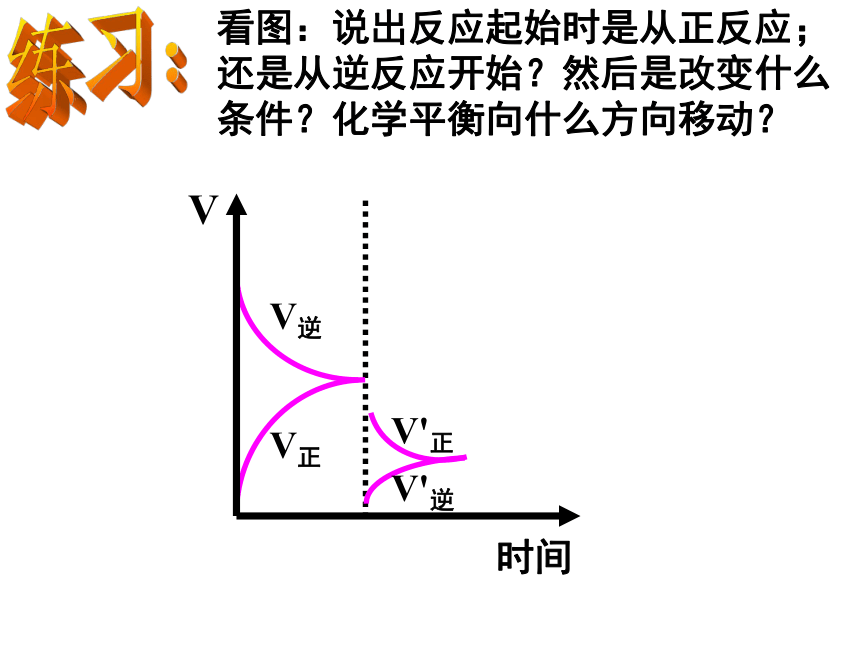
看图:说出反应起始时是从正反应;还是从逆反应开始?然后是改变什么条件?化学平衡向什么方向移动?
V正
V逆
V'正
V'逆
V
时间
看图:说出反应起始时是从正反应;还是从逆反应开始?然后是改变什么条件?化学平衡向什么方向移动?
突变
V正
V逆
V'正
V'逆
逆反应开始。
降温或减压。
平衡向正反应方向移动。
时间
V
看图:是改变什么条件?化学平衡向什么方向移动?
V正
V逆
V'正
V'逆
=
突变
正、逆反应同时开始。
加催化剂或 。
平衡不移动。
时间
V
转
化
率
温度
0
1.01 107Pa
1.01 106Pa
1.01 105Pa
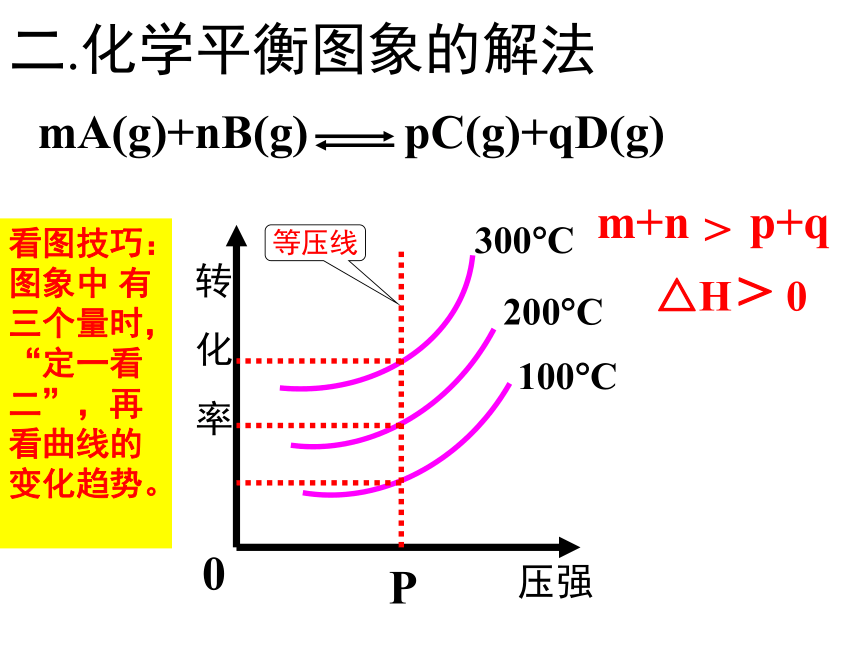
2.化学平衡图象的解法
转化率——压强——温度曲线
解法:
作等
温线
T
mA(g)+nB(g) pC(g)+qD(g)
m+n p+q
>
△H 0
等温线
<
200 C
300 C
100 C
转
化
率
压强
0
二.化学平衡图象的解法
mA(g)+nB(g) pC(g)+qD(g)
P
m+n p+q
>
△H 0
看图技巧:图象中 有三个量时,“定一看二”,再看曲线的变化趋势。
等压线
>
200 C
300 C
100 C
二.化学平衡图象的解法
mA(g)+nB(g) pC(g)+qD(g) △H
P
m+n p+q
>
△H 0
看图技巧:图象中 有三个量时,“定一看二”,再看曲线的变化趋势。
等压线
压强
0
A%
物质百分含量——压强——温度曲线
<
物质百分含量——时间曲线
500 C
300 C
mA(g)+nB(g) pC(g)+qD(g)
C%
时间
0
t1
t2
看图技巧:先拐先平衡,先平衡则速率快。
△H 0
<
练习.如图所示,反应:X(气)+3Y(气) 2Z(气);△H<0 。在不同温度、不同压强(P1>P2)下达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为( )
C
转化率——时间曲线
1.01 107Pa
1.01 106Pa
mA(g)+nB(g) pC(g)+qD(g)
A转化率
时间
0
t1
t2
看图技巧:先拐先平衡,先平衡则速率快。
m+n p+q
<
物质百分含量——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
时间
P1
P2
m%
P1
P2
>
m+n p+q
>
0
物质产率——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
时间
T1
T2
产率
0
△H 0
>
0
2A(g) + B(g) xC(g)
T2 P1
T1 P2
T1 P1
C%
t
P1
P2
<
△H 0
>
练习、在密闭容器中进行下列反应:
M(g)+N(g) R(g)+2L,在不同条件下R的百分含量R%的变化情况如下图,下列叙述正确的是( )
A、正反应吸热,L是气体
B、正反应吸热,L是固体
C、正反应放热,L是气体
D、正反应放热,L是固体
或液体
C
0
转化率——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
1.01 107Pa
1.01 106Pa
A转化率
时间
m+n p+q
=
0
浓度——平衡——时间曲线
mA(g)+nB(g) pC(g)+qD(s)
A
C
时间
浓度
t1 t2 t3
此图在t2时,如果是加热,那么 △H大于0,还是小于0?如果是减压,那么m+n与p的关系如何?
△H 0
>
m+n p
<
练习1、mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是( )
A、m+n
新课标苏教版选修四
化学平衡图像
化学平衡图象分析的一般方法:
一看面:
看清图象中横坐标和纵坐标的含义。
二看线:
弄清图象中线的斜率或线走势的意义
三看点:
明确曲线的起点、终点、交点及拐点等
四看是否需要辅助线。
1、化学反应速率图像分析
(1)看起点和终点
分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数是以原点为起点。
看下图:
写反应方程式
0.5
1.5
1.0
2.0
物质的量
C
A
B
时间
A + B = C
2
1
3
反应速率之比=反应方程式的系数之比
1、化学反应速率图象分析
(2). 看变化趋势
分清正反应和逆反应; 分清放热反应和吸热反应; 分清“突变”和“渐变”
V正
V逆
V'正
V'逆
V
时间
此图表示:增大反应物浓度时,正反应、逆反应的速率变化情况
看图:说出反应起始时是从正反应;还是从逆反应开始?然后是改变什么条件?化学平衡向什么方向移动?
V正
V逆
V'正
V'逆
V
时间
看图:说出反应起始时是从正反应;还是从逆反应开始?然后是改变什么条件?化学平衡向什么方向移动?
突变
V正
V逆
V'正
V'逆
逆反应开始。
降温或减压。
平衡向正反应方向移动。
时间
V
看图:是改变什么条件?化学平衡向什么方向移动?
V正
V逆
V'正
V'逆
=
突变
正、逆反应同时开始。
加催化剂或 。
平衡不移动。
时间
V
转
化
率
温度
0
1.01 107Pa
1.01 106Pa
1.01 105Pa
2.化学平衡图象的解法
转化率——压强——温度曲线
解法:
作等
温线
T
mA(g)+nB(g) pC(g)+qD(g)
m+n p+q
>
△H 0
等温线
<
200 C
300 C
100 C
转
化
率
压强
0
二.化学平衡图象的解法
mA(g)+nB(g) pC(g)+qD(g)
P
m+n p+q
>
△H 0
看图技巧:图象中 有三个量时,“定一看二”,再看曲线的变化趋势。
等压线
>
200 C
300 C
100 C
二.化学平衡图象的解法
mA(g)+nB(g) pC(g)+qD(g) △H
P
m+n p+q
>
△H 0
看图技巧:图象中 有三个量时,“定一看二”,再看曲线的变化趋势。
等压线
压强
0
A%
物质百分含量——压强——温度曲线
<
物质百分含量——时间曲线
500 C
300 C
mA(g)+nB(g) pC(g)+qD(g)
C%
时间
0
t1
t2
看图技巧:先拐先平衡,先平衡则速率快。
△H 0
<
练习.如图所示,反应:X(气)+3Y(气) 2Z(气);△H<0 。在不同温度、不同压强(P1>P2)下达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为( )
C
转化率——时间曲线
1.01 107Pa
1.01 106Pa
mA(g)+nB(g) pC(g)+qD(g)
A转化率
时间
0
t1
t2
看图技巧:先拐先平衡,先平衡则速率快。
m+n p+q
<
物质百分含量——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
时间
P1
P2
m%
P1
P2
>
m+n p+q
>
0
物质产率——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
时间
T1
T2
产率
0
△H 0
>
0
2A(g) + B(g) xC(g)
T2 P1
T1 P2
T1 P1
C%
t
P1
P2
<
△H 0
>
练习、在密闭容器中进行下列反应:
M(g)+N(g) R(g)+2L,在不同条件下R的百分含量R%的变化情况如下图,下列叙述正确的是( )
A、正反应吸热,L是气体
B、正反应吸热,L是固体
C、正反应放热,L是气体
D、正反应放热,L是固体
或液体
C
0
转化率——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
1.01 107Pa
1.01 106Pa
A转化率
时间
m+n p+q
=
0
浓度——平衡——时间曲线
mA(g)+nB(g) pC(g)+qD(s)
A
C
时间
浓度
t1 t2 t3
此图在t2时,如果是加热,那么 △H大于0,还是小于0?如果是减压,那么m+n与p的关系如何?
△H 0
>
m+n p
<
练习1、mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是( )
A、m+n
q
C、X点时的状态,V正>V逆
D、X点比Y点混和物的正
反应速率慢
BC
练习2图中的曲线是表示其他条件一定时, 反应中
NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的是( )
A. a点 B. b点
C. c点 D. d点
C
2NO+O2 2NO2+Q(ΔH<0)
练习3可逆反应:aX(s) + bY(g) cZ(g) +dW(g)达到平衡,混合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。
1、当压强不变时,升高温度,Y的体积分数变 ,平衡向 方向移动,则正反应是 热反应。
2、当温度不变时,增大压强,Y的体积分数变————,平衡向 —— 方向移动,则化学方程式中左右两边的系数大小关系是——————。
Y的体积分数
压强
T1
T2
小
正反应
吸
大
逆反应
b<(c+d)
练习4化学反应X2(g)+Y2(g) 2XY(g) ΔH<0 ,达到平衡状态时,图2—12中各曲线符合平衡移动原理的是( )
A、C
