化学:《化学能与热能第一课时
文档属性
| 名称 | 化学:《化学能与热能第一课时 |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-11 15:58:10 | ||
图片预览






文档简介
(共23张PPT)
第二章 化学反应与能量
燃料电池汽车
化学能与热能
炼钢
钻井平台
化学变化的特征:
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
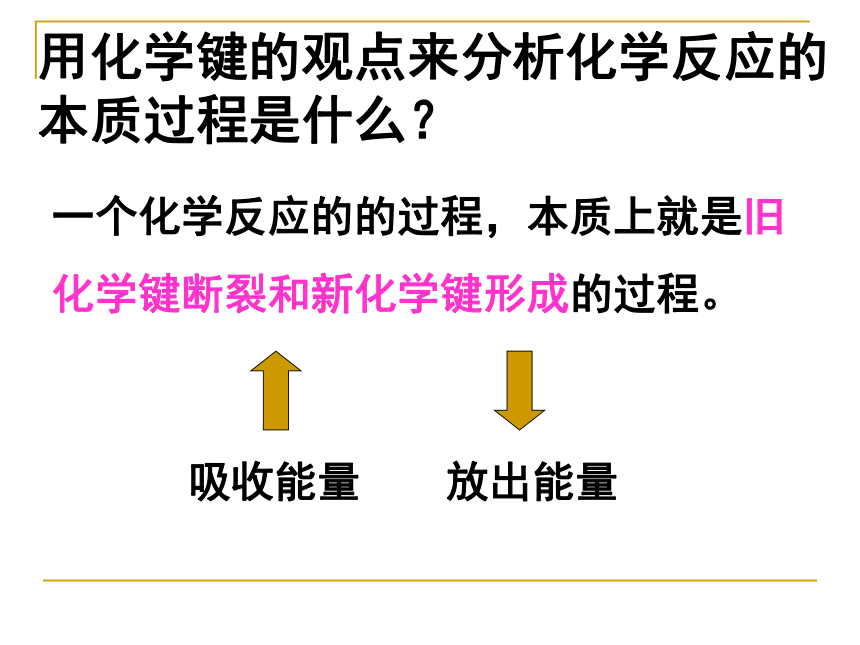
用化学键的观点来分析化学反应的本质过程是什么?
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
一、化学键与化学反应中能量变化的关系
1、当物质发生化学反应时,断开反应物中的化学键要吸收能量;而形成生成物中的化学键要放出能量。
例如:断开H-H键要吸收能量。
形成H-H键要放出能量。
一个化学反应吸收能量还是放出能量是由什么决定的呢
E
(kJ/mol)
反应历程
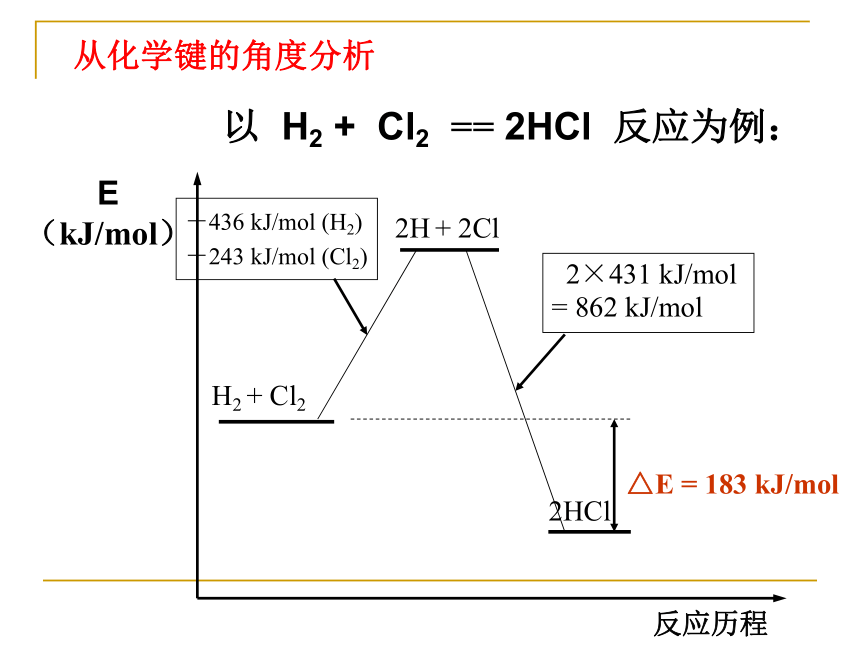
H2 + Cl2
2H + 2Cl
2HCl
△E = 183 kJ/mol
-436 kJ/mol (H2)
-243 kJ/mol (Cl2)
2×431 kJ/mol
= 862 kJ/mol
以 H2 + Cl2 == 2HCl 反应为例:
从化学键的角度分析
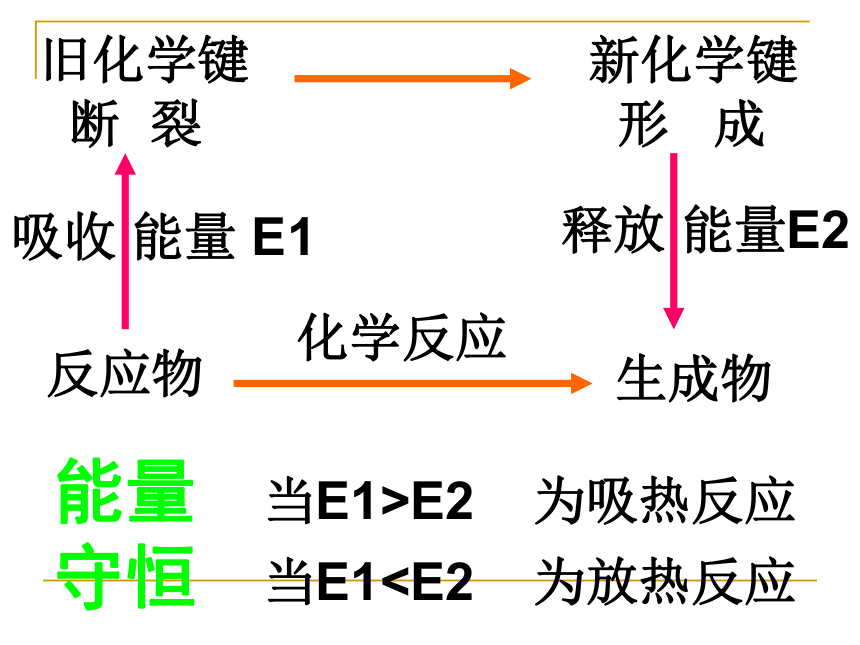
旧化学键
断 裂
新化学键
形 成
吸收 能量 E1
释放 能量E2
反应物
生成物
当E1>E2 为吸热反应
当E1化学反应
能量守恒
反应物总键能 < 生成物总键能
反应物总键能 > 生成物总键能
放热反应:
吸热反应:
小结:一个化学反应是否为放热还是吸热取
决于
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
释放能量:
势能 动能
转化为
从物质总能量的角度分析
提供能量:
电能转化为机械能再转化为势能
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
决定于反应物的总能量与生成物的总能量的相对大小。
化学反应
化学反应
吸收能量
一个化学反应吸收能量还是放出能量
放热
吸热
从整体考虑的角度出发
小结:
能量公式化
E(反应物)=E(生成物)+Q
(能量守恒定律)
E(反应物)-E(生成物)=Q
Q>0为放热反应
Q<0为吸热反应
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
1、据反应物及生成物的总能量的大小
反应物总能量>生成物总能量
放热反应:
吸热反应:
反应物总能量<生成物总能量
2、据反应物及生成物的总键能的大小
判断吸热还是放热反应的方法:
反应物总键能>生成物总键能
反应物总键能<生成物总键能
放热反应:
吸热反应:
1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
4、化学反应中遵循能量守恒原则。
小结
一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物的总能量的相对大小有关。
1.下列各图中,表示正反应是吸热
反 应的是 ( )
练习
A
2、当物质发生化学反应时,断开反应物中的化学
键要 ;而形成生成物中的化
学键要 。一个化学反应
是释放能量还是吸收能量取决于
。
吸收能量
放出能量
反应物总能量与生成物总能量的相对大小
3、若反应物的总能量>生成物的总能量,
化学反应 能量。
若反应物的总能量<生成物的总能量,
化学反应 能量。
放出
吸收
4、已知反应A+B=C+D为放热反应,对
该反应的下列说法中正确的是( )
A、A的能量一定高于C
B、B的能量一定高于D
C、A和B的总能量一定高于C和D的总能量
D、该反应为放热反应,故不必加热就
一定能发生
C
据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为
不妥当的是 ( )
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
√
第二章 化学反应与能量
燃料电池汽车
化学能与热能
炼钢
钻井平台
化学变化的特征:
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
用化学键的观点来分析化学反应的本质过程是什么?
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
一、化学键与化学反应中能量变化的关系
1、当物质发生化学反应时,断开反应物中的化学键要吸收能量;而形成生成物中的化学键要放出能量。
例如:断开H-H键要吸收能量。
形成H-H键要放出能量。
一个化学反应吸收能量还是放出能量是由什么决定的呢
E
(kJ/mol)
反应历程
H2 + Cl2
2H + 2Cl
2HCl
△E = 183 kJ/mol
-436 kJ/mol (H2)
-243 kJ/mol (Cl2)
2×431 kJ/mol
= 862 kJ/mol
以 H2 + Cl2 == 2HCl 反应为例:
从化学键的角度分析
旧化学键
断 裂
新化学键
形 成
吸收 能量 E1
释放 能量E2
反应物
生成物
当E1>E2 为吸热反应
当E1
能量守恒
反应物总键能 < 生成物总键能
反应物总键能 > 生成物总键能
放热反应:
吸热反应:
小结:一个化学反应是否为放热还是吸热取
决于
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
释放能量:
势能 动能
转化为
从物质总能量的角度分析
提供能量:
电能转化为机械能再转化为势能
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
决定于反应物的总能量与生成物的总能量的相对大小。
化学反应
化学反应
吸收能量
一个化学反应吸收能量还是放出能量
放热
吸热
从整体考虑的角度出发
小结:
能量公式化
E(反应物)=E(生成物)+Q
(能量守恒定律)
E(反应物)-E(生成物)=Q
Q>0为放热反应
Q<0为吸热反应
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
1、据反应物及生成物的总能量的大小
反应物总能量>生成物总能量
放热反应:
吸热反应:
反应物总能量<生成物总能量
2、据反应物及生成物的总键能的大小
判断吸热还是放热反应的方法:
反应物总键能>生成物总键能
反应物总键能<生成物总键能
放热反应:
吸热反应:
1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
4、化学反应中遵循能量守恒原则。
小结
一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物的总能量的相对大小有关。
1.下列各图中,表示正反应是吸热
反 应的是 ( )
练习
A
2、当物质发生化学反应时,断开反应物中的化学
键要 ;而形成生成物中的化
学键要 。一个化学反应
是释放能量还是吸收能量取决于
。
吸收能量
放出能量
反应物总能量与生成物总能量的相对大小
3、若反应物的总能量>生成物的总能量,
化学反应 能量。
若反应物的总能量<生成物的总能量,
化学反应 能量。
放出
吸收
4、已知反应A+B=C+D为放热反应,对
该反应的下列说法中正确的是( )
A、A的能量一定高于C
B、B的能量一定高于D
C、A和B的总能量一定高于C和D的总能量
D、该反应为放热反应,故不必加热就
一定能发生
C
据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为
不妥当的是 ( )
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
√
