化学:《化学能与热能》第二课时
文档属性
| 名称 | 化学:《化学能与热能》第二课时 |  | |
| 格式 | zip | ||
| 文件大小 | 714.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-11 16:00:16 | ||
图片预览







文档简介
(共25张PPT)
知识回顾
2、化学反应的实质:
旧化学键的断裂和新化学键的形成。
1、化学反应的基本特征是什么?
有新物质生成。同时伴随着光和热以及气体或沉淀。
从化学键的角度分析
一个化学反应的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是放热反应还是吸热反应
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
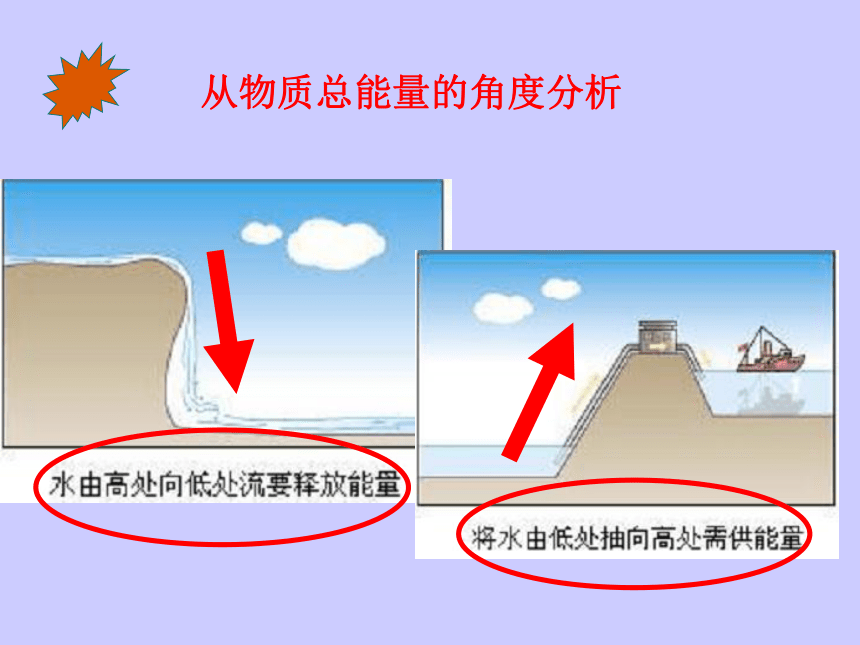
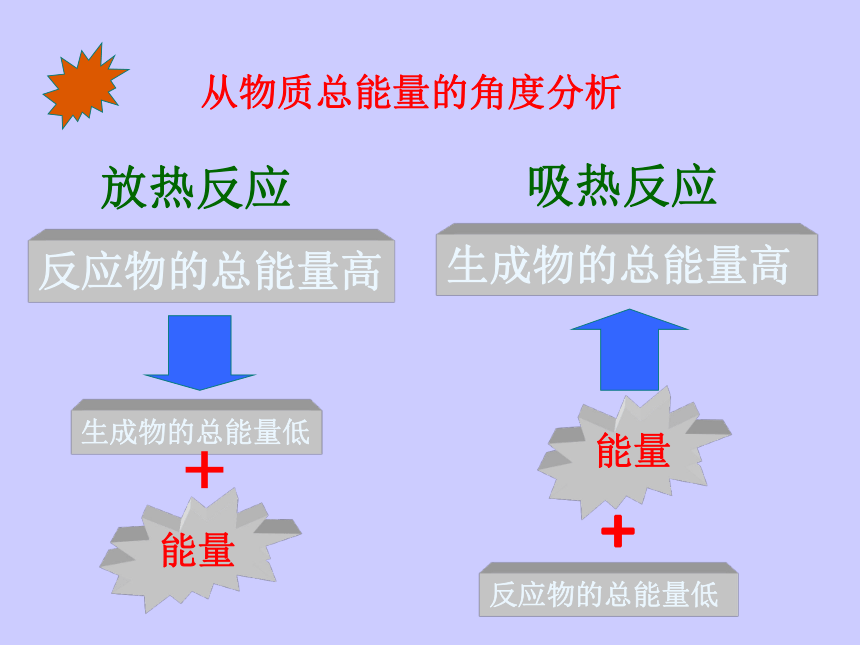
从物质总能量的角度分析
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
能量
﹢
﹢
能量
放热反应
吸热反应
从物质总能量的角度分析
从物质总能量的角度分析
一个化学反应是放热反应还是吸热反应
取决于反应物的总能量
与生成物的总能量的相对大小
实验2---1
现 象 结 论
1. 铝与盐酸反应 ;
2. 温度计的液柱___
3. 手触摸的感觉是
1. 大多数置换反应是 ;
2. 能转化为 能释放出来。
有气泡放出
变热
升高
放热反应
化学
热
二、化学能与热能的相互转化
实验2---2
现象 结论
1. 产生 气味气体,混合呈 状;
2. 手触摸杯壁下部感觉 ;
3. 玻璃片与烧杯 。 1. 反应产生 ,并有 生成;
2. 该反应是 反应;
3. 能转化 为 能储存起来。
刺激性
糊
温度降低
黏在一起
氨气
水
吸热反应
热
化学能
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
二、化学能与热能的相互转化
玻璃棒的作用:
反应物成糊状的原因:
搅拌,使混合物充分接触
结冰粘结
实验2---3
盐酸
温度 NaOH
溶液温度 反应后
温度 结 论
室温
室温 1. 该反应是 反应,酸碱中和反应是 反应;
2. 能转化为 能释放出来。
升高
放热
放热
化学
热
二、化学能与热能的相互转化
结论:中和反应是放热反应。
实质:H+ + OH- = H2O
常见的放热反应和吸热反应
放热反应
所有的燃烧反应、生石灰和水的反应
酸碱中和反应、浓硫酸稀释的反应
活泼金属与酸或水的反应、氢氧化钠固体溶解
大多数化合反应
吸热反应
以C、CO为还原剂的氧化还原反应:C+CO2
绝大多数的分解反应: CaCO3高温分解
H2+CuO
Ba(OH)2.8H2O+NH4Cl
探索与总结
中和热:酸与碱发生中和反应生成1molH2O时
所释放的热量称为中和热
思考与交流:
在设计实验装置和操作时应该注意哪些问题?
思考与交流:
在设计实验装置和操作时应该注意哪些问题?
(1)用隔热装置,尽量减少热量散失;
(2)酸碱的量要准确:n=C×V
a、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管
(3)温度计越精确越好
(4)注意控制反应时间
(5)多做几次,取平均值
科学视野
1、社会发展与能源利用
2、人类利用能源的三个阶段
柴草时期
中国古代制陶图
化石能源时期
多能源结构时期
从化学的角度 从物质总
能量角度
放热反应 断键吸收的总能量小于形成新键放出的总能量 反应物的总能量大于生成物的总能量
吸热反应 断键吸收的总能量大于形成新键放出的总能量 反应物的总能 量小于生成物的总能量
知识小结
练习:
1、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应
结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
CD
2、下列说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应B.放热反应在常温下一定能进行
C. 反应是放热还是吸热,必须看反应物和生 成物所具有的总能量的相对大小
D.化学反应释放的能量一定是热量
C
3、氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3
B
4、在反应H2 + Cl2 =2HCl中,已知H-H键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收179kJ热量 D.放出179kJ热量
BD
知识回顾
2、化学反应的实质:
旧化学键的断裂和新化学键的形成。
1、化学反应的基本特征是什么?
有新物质生成。同时伴随着光和热以及气体或沉淀。
从化学键的角度分析
一个化学反应的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是放热反应还是吸热反应
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
从物质总能量的角度分析
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
能量
﹢
﹢
能量
放热反应
吸热反应
从物质总能量的角度分析
从物质总能量的角度分析
一个化学反应是放热反应还是吸热反应
取决于反应物的总能量
与生成物的总能量的相对大小
实验2---1
现 象 结 论
1. 铝与盐酸反应 ;
2. 温度计的液柱___
3. 手触摸的感觉是
1. 大多数置换反应是 ;
2. 能转化为 能释放出来。
有气泡放出
变热
升高
放热反应
化学
热
二、化学能与热能的相互转化
实验2---2
现象 结论
1. 产生 气味气体,混合呈 状;
2. 手触摸杯壁下部感觉 ;
3. 玻璃片与烧杯 。 1. 反应产生 ,并有 生成;
2. 该反应是 反应;
3. 能转化 为 能储存起来。
刺激性
糊
温度降低
黏在一起
氨气
水
吸热反应
热
化学能
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
二、化学能与热能的相互转化
玻璃棒的作用:
反应物成糊状的原因:
搅拌,使混合物充分接触
结冰粘结
实验2---3
盐酸
温度 NaOH
溶液温度 反应后
温度 结 论
室温
室温 1. 该反应是 反应,酸碱中和反应是 反应;
2. 能转化为 能释放出来。
升高
放热
放热
化学
热
二、化学能与热能的相互转化
结论:中和反应是放热反应。
实质:H+ + OH- = H2O
常见的放热反应和吸热反应
放热反应
所有的燃烧反应、生石灰和水的反应
酸碱中和反应、浓硫酸稀释的反应
活泼金属与酸或水的反应、氢氧化钠固体溶解
大多数化合反应
吸热反应
以C、CO为还原剂的氧化还原反应:C+CO2
绝大多数的分解反应: CaCO3高温分解
H2+CuO
Ba(OH)2.8H2O+NH4Cl
探索与总结
中和热:酸与碱发生中和反应生成1molH2O时
所释放的热量称为中和热
思考与交流:
在设计实验装置和操作时应该注意哪些问题?
思考与交流:
在设计实验装置和操作时应该注意哪些问题?
(1)用隔热装置,尽量减少热量散失;
(2)酸碱的量要准确:n=C×V
a、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管
(3)温度计越精确越好
(4)注意控制反应时间
(5)多做几次,取平均值
科学视野
1、社会发展与能源利用
2、人类利用能源的三个阶段
柴草时期
中国古代制陶图
化石能源时期
多能源结构时期
从化学的角度 从物质总
能量角度
放热反应 断键吸收的总能量小于形成新键放出的总能量 反应物的总能量大于生成物的总能量
吸热反应 断键吸收的总能量大于形成新键放出的总能量 反应物的总能 量小于生成物的总能量
知识小结
练习:
1、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应
结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
CD
2、下列说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应B.放热反应在常温下一定能进行
C. 反应是放热还是吸热,必须看反应物和生 成物所具有的总能量的相对大小
D.化学反应释放的能量一定是热量
C
3、氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3
B
4、在反应H2 + Cl2 =2HCl中,已知H-H键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收179kJ热量 D.放出179kJ热量
BD
