核素课件
图片预览



文档简介
(共11张PPT)
、核素
1、质量数
(1)定义:
(2)关系式:
(3)原子符号:
(A)
忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
ZX
A
(代表一个质量数为A,
质子数为Z的原子)
2、核素和同位素
(1)核素:具有一定数目的质子和一定数目的中子的一种原子。
同种元素:原子的原子核中质子数______。
同种元素:原子的原子核中中子数可以 _____。
同种元素:
可以有 ______ 种不同原子。
相同
不相同
几
再如:
C
12
C
14
(2)元素:具有相同核电荷数(或质子数)的
同一类原子的总称。
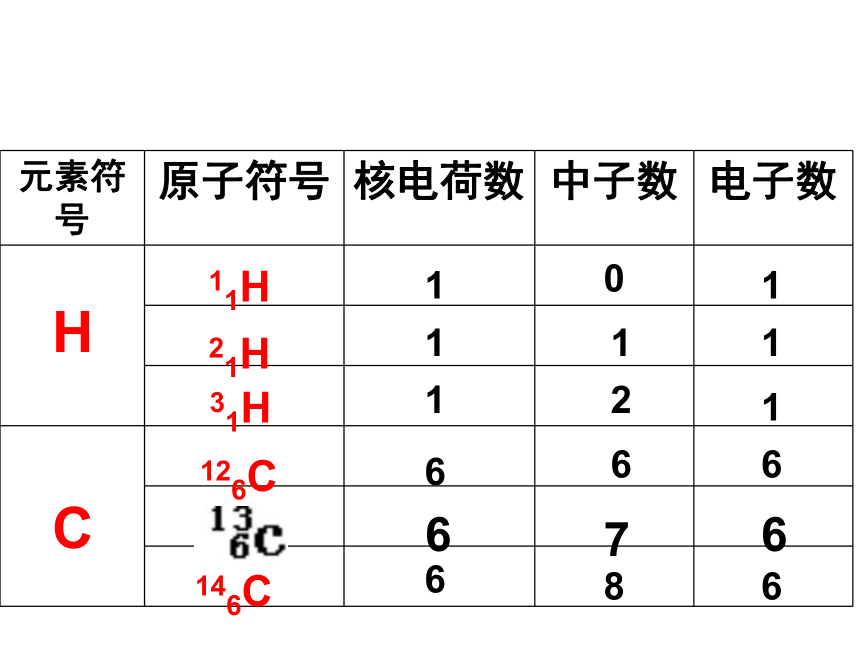
元素符号 原子符号 核电荷数 中子数 电子数
H
C
11H
21H
31H
126C
6
7
6
146C
0
1
1
1
1
1
1
1
2
6
6
6
6
8
6
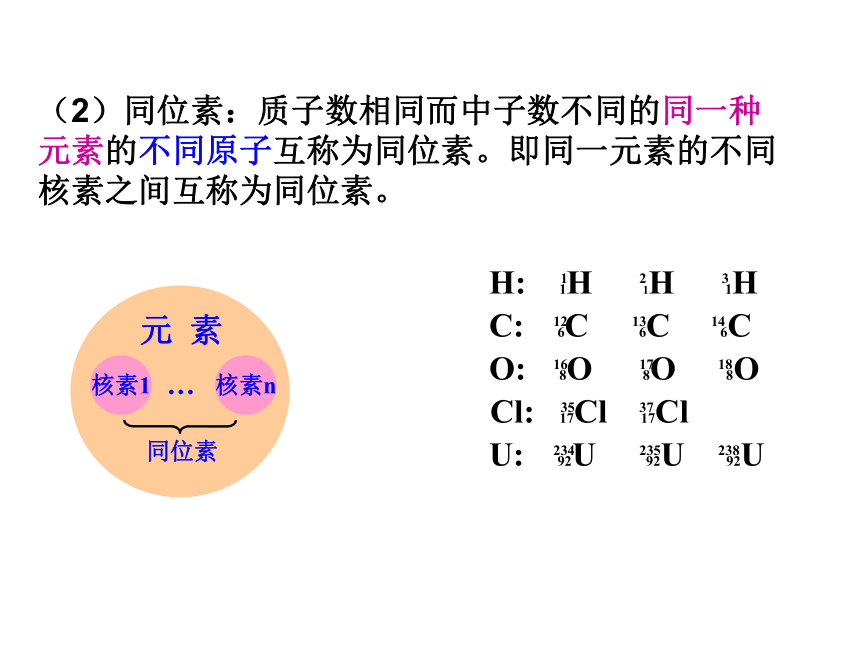
(2)同位素:质子数相同而中子数不同的同一种
元素的不同原子互称为同位素。即同一元素的不同
核素之间互称为同位素。
U: 92U 92U 92U
H: 1H 1H 1H
C: 6C 6C 6C
O: 8O 8O 8O
Cl: 17Cl 17Cl
1
2
3
12
13
14
16
17
18
35
37
234
235
238
核素1
核素n
同位素
元 素
…
其特点为:
⑴同位素在周期表里占据同一位置,且元素符号相同。
⑵同位素的化学性质几乎完全相同,物理性质有所不同
⑶在天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。
⑷ 同种元素的不同的同位素原子也可组成不同的单质或化合物的分子。
如: 氢: 氕、 氘、 氚
氢 重氢 超重氢
元素符号: H H H
原子符号: 11H 12H 13H
H D T
单质:
与氧化合成水:
这些水分子的最大式量_____,
最小式量_____,共有___种式量。
22
5
18
H2、 D2 、 T2、H-D、H-T、D-T
H2O、D2O、T2O、HDO、DTO、HTO
1、以下为同位素的是( )
A. D2和H2 B. CO和CO2
C. 金刚石和石墨 D. 和
2、下列叙述正确的是( )
A. 所有元素的原子核均由质子和中子构成
B. 是一种同位素
C. 铀有三种同位素,即有三种铀原子
D. 核素就是元素
37
17Cl
35
17Cl
课堂练习
3
1H
D
C
16O、18O、O2-、O2、O3表示
( )
A、氧的五种同素异形体
B、五种氧元素
C、氧元素的五种不同微粒
D、氧的五种同位素
4. 只含有一种元素的物质不可能是( )
A、混合物 B、化合物
C、纯净物 D、单质
C
B
6. 某粒子用 表示,下列关于该粒子的叙述
正确的是( )
A、所含质子数=A-n B、所含中子数=A-Z
C、所含电子数=Z+n D、质量数=Z+A
A
Z
Rn+
据报道,上海某医院正在研究用放射性的一种
碘 治疗肿瘤。该碘原子的核内中子数与核外
电子数之差是( )
A、72 B、19 C、53 D、125
B
I
125
53
B
a——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——原子个数
a b c d各代表什么
学了这部分内容后常见到这样的符号
a
b
X
c+
d
思考:对于这样的符号你该如何计算它的核外电子数?
、核素
1、质量数
(1)定义:
(2)关系式:
(3)原子符号:
(A)
忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
ZX
A
(代表一个质量数为A,
质子数为Z的原子)
2、核素和同位素
(1)核素:具有一定数目的质子和一定数目的中子的一种原子。
同种元素:原子的原子核中质子数______。
同种元素:原子的原子核中中子数可以 _____。
同种元素:
可以有 ______ 种不同原子。
相同
不相同
几
再如:
C
12
C
14
(2)元素:具有相同核电荷数(或质子数)的
同一类原子的总称。
元素符号 原子符号 核电荷数 中子数 电子数
H
C
11H
21H
31H
126C
6
7
6
146C
0
1
1
1
1
1
1
1
2
6
6
6
6
8
6
(2)同位素:质子数相同而中子数不同的同一种
元素的不同原子互称为同位素。即同一元素的不同
核素之间互称为同位素。
U: 92U 92U 92U
H: 1H 1H 1H
C: 6C 6C 6C
O: 8O 8O 8O
Cl: 17Cl 17Cl
1
2
3
12
13
14
16
17
18
35
37
234
235
238
核素1
核素n
同位素
元 素
…
其特点为:
⑴同位素在周期表里占据同一位置,且元素符号相同。
⑵同位素的化学性质几乎完全相同,物理性质有所不同
⑶在天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。
⑷ 同种元素的不同的同位素原子也可组成不同的单质或化合物的分子。
如: 氢: 氕、 氘、 氚
氢 重氢 超重氢
元素符号: H H H
原子符号: 11H 12H 13H
H D T
单质:
与氧化合成水:
这些水分子的最大式量_____,
最小式量_____,共有___种式量。
22
5
18
H2、 D2 、 T2、H-D、H-T、D-T
H2O、D2O、T2O、HDO、DTO、HTO
1、以下为同位素的是( )
A. D2和H2 B. CO和CO2
C. 金刚石和石墨 D. 和
2、下列叙述正确的是( )
A. 所有元素的原子核均由质子和中子构成
B. 是一种同位素
C. 铀有三种同位素,即有三种铀原子
D. 核素就是元素
37
17Cl
35
17Cl
课堂练习
3
1H
D
C
16O、18O、O2-、O2、O3表示
( )
A、氧的五种同素异形体
B、五种氧元素
C、氧元素的五种不同微粒
D、氧的五种同位素
4. 只含有一种元素的物质不可能是( )
A、混合物 B、化合物
C、纯净物 D、单质
C
B
6. 某粒子用 表示,下列关于该粒子的叙述
正确的是( )
A、所含质子数=A-n B、所含中子数=A-Z
C、所含电子数=Z+n D、质量数=Z+A
A
Z
Rn+
据报道,上海某医院正在研究用放射性的一种
碘 治疗肿瘤。该碘原子的核内中子数与核外
电子数之差是( )
A、72 B、19 C、53 D、125
B
I
125
53
B
a——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——原子个数
a b c d各代表什么
学了这部分内容后常见到这样的符号
a
b
X
c+
d
思考:对于这样的符号你该如何计算它的核外电子数?
