2021浙教版科学“中考二轮专题突破”讲义(八):化学计算【word,含答案】
文档属性
| 名称 | 2021浙教版科学“中考二轮专题突破”讲义(八):化学计算【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 467.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-05-07 09:54:00 | ||
图片预览




文档简介
一、有关化学式的计算
(一)根据化学式的计算
1.求相对分子质量
相对分子质量是指化学式中各原子相对原子质量的总和。
2.求化合物中各元素的质量比
以化合物AmBn为例。
A、B元素的质量比:。
3.求化合物中某元素的质量分数
以化合物AmBn为例。
A元素的质量分数=×100%。
混合物中某物质的质量分数=×100%。
(二)确定化学式的计算
1.根据化合物中各元素的质量比求化学式
将各元素的质量分别除以其相对原子质量,得到的商之比即为相应的原子个数之比,进而确定其化学式。
2.根据化合物中各元素的质量分数求化学式
已知某化合物中各元素的质量分数和相对分子质量,可确定该化合物中各原子个数之比,进而确定其化学式。
3.根据化合价确定化学式
化合物中各元素的化合价代数和为0,利用这一点可确定化合物中各元素原子个数比。
二、有关溶液的计算
有关溶液的计算中要准确分析溶质、溶剂、溶液的质量,最基本的质量关系是:溶质质量+溶剂质量=溶液质量。
1.溶质质量分数的公式
溶质质量分数=×100%
2.有关溶液浓缩与稀释的计算
溶液浓缩和稀释前后关键是:溶质质量不变。
3.有关溶液与化学方程式的综合计算
在根据化学方程式进行化学计算时,各反应物、生成物之间,要以溶质质量列比例,而不能直接用溶液质量或体积列比例。
三、有关化学方程式的计算
有关化学方程式计算的注意点
要注意反应中的条件,如“充分反应”“完全反应”
“恰好反应”“足量”“过量”等关键性词语,以作出正确判断。
例1.(2020杭州)氢气的储存是科学研究热点之一。X是一种储存氢气的材料,取11.2gX在O2中完全燃烧后只生成8.0g CuO、8.0g MgO。
(1)上述燃烧过程中消耗O2的质量为________克。
(2)通过计算求X中各元素的原子个数比。(写出计算过程)
例2.(2019杭州)工业合成氨的相关反应式为:N2+3H22NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是 。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2。有科学家正在研究一种不生成CO2的新方法来制取原料气H2。若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
例3.(2018杭州)用“盐酸—硫化钡法”生产 BaCl2 会放出有毒气体 H2S(其水溶液有酸性)可用 NaOH 吸收H2S 制取 Na2S 进行处理。下表为 H2S 回收工艺的各项生产成本:
表 H2S 回收工艺的各项生产成本
项目 单价(元/吨)
NaOH 2500
Na2S 5000
辅助费用(以处理 1 吨 H2S 计) 1114
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理 H2S 的方法是 (选填“盈利”或“亏损”)的。
(2)若某化工厂每天要处理 10 吨 H2S,需消耗 NaOH 多少吨?(写出计算过程,结果保留 1 位小数)
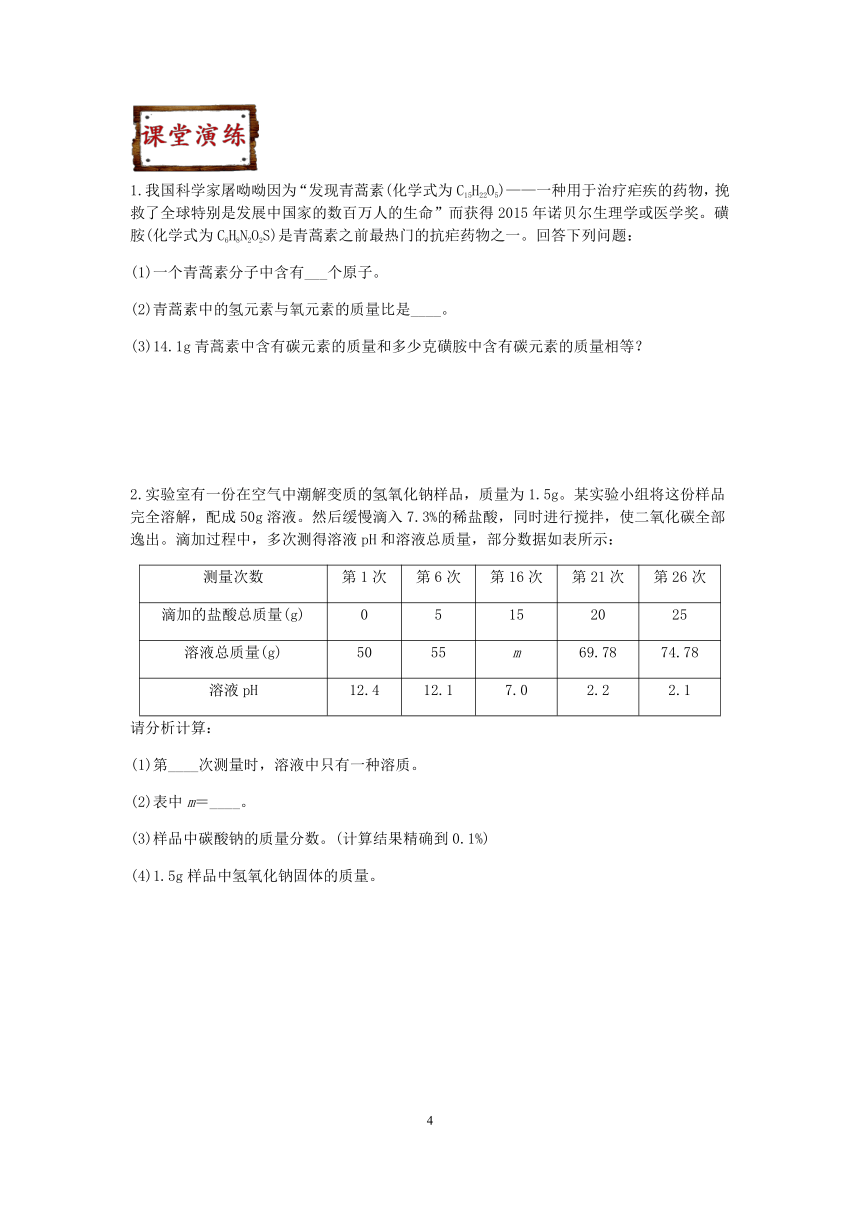
1.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。回答下列问题:
(1)一个青蒿素分子中含有___个原子。
(2)青蒿素中的氢元素与氧元素的质量比是____。
(3)14.1g青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
2.实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g。某实验小组将这份样品完全溶解,配成50g溶液。然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如表所示:
测量次数 第1次 第6次 第16次 第21次 第26次
滴加的盐酸总质量(g) 0 5 15 20 25
溶液总质量(g) 50 55 m 69.78 74.78
溶液pH 12.4 12.1 7.0 2.2 2.1
请分析计算:
(1)第____次测量时,溶液中只有一种溶质。
(2)表中m=____。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
3.浙江大学团队在《科学》杂志中介绍了一种利用“分子围栏”催化剂,在70℃时将甲烷转化成甲醇(CH3OH)的技术,解决了甲烷高效率变甲醇的难题,其微观示意图如图所示:
甲醇分子中C、H、O原子的个数比为 。
(2)利用该技术将甲烷转化为甲醇,转化率可达17.3%,是当前国际最高水平。若16吨甲烷参加反应,获得甲醇的最大质量约为多少吨?(写出计算过程,结果保留1位小数)
4.气体A是一种氮的氧化物,由某些含氮化合物产生,可用于治疗心绞痛。
(1)一种转化为A的方法是:硝化甘油(C3H5O9N3)在人体内氧化,其方程式为4C3H5N3O9 + 5O2 = 12A+ 12CO2 + 10H2O,则A的化学式为 。
(2)另一种转化为A的方法是:铜与稀硝酸反应,其化学方程式为
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2A↑ + 4H2O。现用6.4 kg铜与足量的稀硝酸反应,计算理论
上能生成A的质量。(写出计算过程)
5.四氯化硅(SiCl4)是一种重要的化工原料,遇水会发生如下反应:SiCl4+3H2O=H2SiO3↓+4HCI
某地曾发生将含有四氯化硅的废料倒入池塘造成污染的事件,事后环保人员在受污染的池塘中投入熟石灰[Ca(OH)2]作了有效处理。
(1)已知H2SiO3不跟Ca(OH)2反应,为了确定投入熟石灰的质量,要先测定废料倒入池塘后生成盐酸的质量。选用下列哪组数据能确定池塘中生成盐酸的质量 。
A.倒入废料的总质量、废料中SiCl4的质量分数
B.池塘水的PH
C.池塘水中HCl的质量分数
(2)经测定池塘水中共有0.365吨盐酸,需要加入多少吨熟石灰才能将其完全反应。
1.学校某兴趣小组做了氧化铜和盐酸反应的实验,小明为测定反应后混合溶液的成分及含量,向烧杯中分5次共加入200g 10%的氢氧化钠溶液,得到沉淀的质量记录如下:
加入NaOH溶液的质量(g) 40.0 80.0 120.0 160.0 200.0
生成沉淀的质量(g) 0.0 2.45 7.35 9.8 9.8
(1)分析实验过程,第一次加入40.0g NaOH溶液,为什么没有生成沉淀?____。
(2)分析实验过程,如果加入90g NaOH溶液,溶液中的溶质是____。
(3)原来混合液中氯化铜的质量为多少克?(写出具体计算过程)
(4)若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会造成计算出的氯化铜的含量____。
A.偏高 B.偏低 C.不变
2.2020年5月12日9时16分,我国在酒泉卫星发射中心用快舟一号甲运载火箭,成功将行云二号01/02星发射升空。该火箭用联氨(N2H4)做燃料,反应原理:2N2H4+N2O4 点燃 3N2+4H2O
(1)该火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃的原因是_________。
(2)请计算19.2kgN2H4完全燃烧需要助燃物N2O4的质量。
3.小金按如图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息_______(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
4.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
(1)上表中m的数值是__________。
(2)反应中碳酸钙有剩余是第_________次实验。
(3)稀盐酸中溶质的质量分数是多少?
5.为了测定某种贝壳中碳酸钙的质量分数,小金同学称取50g贝壳样品,分别在5只烧杯中进行了实验,实验数据见下表(假设贝壳中其它物质不与盐酸反应):根据实验设计及有关数据进行分析与计算:
烧杯A 烧杯B 烧杯C 烧杯D 烧杯E
加入贝壳样品的质量/g 10 10 10 10 10
加入稀盐酸的质量/g 10 20 30 40 50
充分反应后生成气体的质量/g 0.88 1.76 x 3.52 3.52
(1)表格中x的值为_____。
(2)求样品中碳酸钙的质量分数。_____。
参考答案
例1.
例2.⑴N2⑵8.25万吨
【解析】⑴空气中氮气含量高达百分之七十八,可以通过分离空气直接得到的氮气。 (2)解设若需要合成8.5万吨氨,需要消耗H2的质量为x
6 34
X 8.5万吨
6/x=34/8.5万吨 X=1.5万吨
因为如果原料气H2用天然气来制取,理论上每生产1吨H2会同时产生5.5吨 C02,所以改用新方法制取原料气H2可以减少排放C02的质量为1.5*5.5万吨 =8.25万吨。
例3.(1)盈利; (2)23.5 吨
1.(1)42;(2)11:40;(3)21.5g
2.(1)16;(2)64.78;(3)35.3%;(4)0.8g
3.(1)1:4:1。
(2)设甲醇的质量为x。
CH4+O2+H2=========CH3OH+H2O
16 32
16吨×17.3% x
x=5.5吨
答:获得甲醇的最大质量约为5.5吨。
4.(1)NO;(2)2kg.
【解析】根据质量守恒定律从元素、原子角度的解释,元素种类反应前后不变、原子个数反应前后不变,可得A 的化学式为 NO;因为题目条件为用 6.4kg 铜(Cu)与足量稀硝酸反应,根据化学反应方程式列式可以得出 2kg.
5.(1)A;
1.(1)NaOH和HCl先反应了(或HCl过量);(2)CuCl2和NaCl;(3)13.5g;(4)A
【解析】 (3)设原来混合液中CuCl2的质量为x。
CuCl2+2NaOH===2NaCl+Cu(OH)2↓
135 98
x 9.8g
=,x=13.5g,
答:原来混合液中氯化铜的质量为13.5g。
2.(1)生成物是 N2 和 H2O,不会对大气造成污染;(2)27.6kg.
3.(1)不能 ?(2)21.2% ??
4.(1)4.4(2)三、四
(3)解:设50g稀盐酸中含有氯化氢的质量为y,第三次中的氯化氢完全反应,以第三次进行计算,
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 ? ? ? ? ? ? ?? 44?
y ? ? ? ? ? ? ?? 4.4g
73/y=44/4.4g y=7.3g,稀盐酸的质量分数为:7.3/50×100%=14.6%
答:稀盐酸中溶质的质量分数是是14.6%
5.(1)2.64 (2)80%
【详解】(1)根据表格中的数据可以看出在样品质量一定时,盐酸的质量每增加10g,生成的气体的质量就增加0.88g,则烧杯③中产生的二氧化碳的质量为1.78g+0.88g=2.64g;
(2)由烧杯④和⑤中数据可知,烧杯④中恰好完全反应,设样品中碳酸钙的质量为x。
解得x=8g;
则样品中碳酸钙的质量分数=。
(一)根据化学式的计算
1.求相对分子质量
相对分子质量是指化学式中各原子相对原子质量的总和。
2.求化合物中各元素的质量比
以化合物AmBn为例。
A、B元素的质量比:。
3.求化合物中某元素的质量分数
以化合物AmBn为例。
A元素的质量分数=×100%。
混合物中某物质的质量分数=×100%。
(二)确定化学式的计算
1.根据化合物中各元素的质量比求化学式
将各元素的质量分别除以其相对原子质量,得到的商之比即为相应的原子个数之比,进而确定其化学式。
2.根据化合物中各元素的质量分数求化学式
已知某化合物中各元素的质量分数和相对分子质量,可确定该化合物中各原子个数之比,进而确定其化学式。
3.根据化合价确定化学式
化合物中各元素的化合价代数和为0,利用这一点可确定化合物中各元素原子个数比。
二、有关溶液的计算
有关溶液的计算中要准确分析溶质、溶剂、溶液的质量,最基本的质量关系是:溶质质量+溶剂质量=溶液质量。
1.溶质质量分数的公式
溶质质量分数=×100%
2.有关溶液浓缩与稀释的计算
溶液浓缩和稀释前后关键是:溶质质量不变。
3.有关溶液与化学方程式的综合计算
在根据化学方程式进行化学计算时,各反应物、生成物之间,要以溶质质量列比例,而不能直接用溶液质量或体积列比例。
三、有关化学方程式的计算
有关化学方程式计算的注意点
要注意反应中的条件,如“充分反应”“完全反应”
“恰好反应”“足量”“过量”等关键性词语,以作出正确判断。
例1.(2020杭州)氢气的储存是科学研究热点之一。X是一种储存氢气的材料,取11.2gX在O2中完全燃烧后只生成8.0g CuO、8.0g MgO。
(1)上述燃烧过程中消耗O2的质量为________克。
(2)通过计算求X中各元素的原子个数比。(写出计算过程)
例2.(2019杭州)工业合成氨的相关反应式为:N2+3H22NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是 。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2。有科学家正在研究一种不生成CO2的新方法来制取原料气H2。若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
例3.(2018杭州)用“盐酸—硫化钡法”生产 BaCl2 会放出有毒气体 H2S(其水溶液有酸性)可用 NaOH 吸收H2S 制取 Na2S 进行处理。下表为 H2S 回收工艺的各项生产成本:
表 H2S 回收工艺的各项生产成本
项目 单价(元/吨)
NaOH 2500
Na2S 5000
辅助费用(以处理 1 吨 H2S 计) 1114
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理 H2S 的方法是 (选填“盈利”或“亏损”)的。
(2)若某化工厂每天要处理 10 吨 H2S,需消耗 NaOH 多少吨?(写出计算过程,结果保留 1 位小数)
1.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。回答下列问题:
(1)一个青蒿素分子中含有___个原子。
(2)青蒿素中的氢元素与氧元素的质量比是____。
(3)14.1g青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
2.实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g。某实验小组将这份样品完全溶解,配成50g溶液。然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如表所示:
测量次数 第1次 第6次 第16次 第21次 第26次
滴加的盐酸总质量(g) 0 5 15 20 25
溶液总质量(g) 50 55 m 69.78 74.78
溶液pH 12.4 12.1 7.0 2.2 2.1
请分析计算:
(1)第____次测量时,溶液中只有一种溶质。
(2)表中m=____。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
3.浙江大学团队在《科学》杂志中介绍了一种利用“分子围栏”催化剂,在70℃时将甲烷转化成甲醇(CH3OH)的技术,解决了甲烷高效率变甲醇的难题,其微观示意图如图所示:
甲醇分子中C、H、O原子的个数比为 。
(2)利用该技术将甲烷转化为甲醇,转化率可达17.3%,是当前国际最高水平。若16吨甲烷参加反应,获得甲醇的最大质量约为多少吨?(写出计算过程,结果保留1位小数)
4.气体A是一种氮的氧化物,由某些含氮化合物产生,可用于治疗心绞痛。
(1)一种转化为A的方法是:硝化甘油(C3H5O9N3)在人体内氧化,其方程式为4C3H5N3O9 + 5O2 = 12A+ 12CO2 + 10H2O,则A的化学式为 。
(2)另一种转化为A的方法是:铜与稀硝酸反应,其化学方程式为
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2A↑ + 4H2O。现用6.4 kg铜与足量的稀硝酸反应,计算理论
上能生成A的质量。(写出计算过程)
5.四氯化硅(SiCl4)是一种重要的化工原料,遇水会发生如下反应:SiCl4+3H2O=H2SiO3↓+4HCI
某地曾发生将含有四氯化硅的废料倒入池塘造成污染的事件,事后环保人员在受污染的池塘中投入熟石灰[Ca(OH)2]作了有效处理。
(1)已知H2SiO3不跟Ca(OH)2反应,为了确定投入熟石灰的质量,要先测定废料倒入池塘后生成盐酸的质量。选用下列哪组数据能确定池塘中生成盐酸的质量 。
A.倒入废料的总质量、废料中SiCl4的质量分数
B.池塘水的PH
C.池塘水中HCl的质量分数
(2)经测定池塘水中共有0.365吨盐酸,需要加入多少吨熟石灰才能将其完全反应。
1.学校某兴趣小组做了氧化铜和盐酸反应的实验,小明为测定反应后混合溶液的成分及含量,向烧杯中分5次共加入200g 10%的氢氧化钠溶液,得到沉淀的质量记录如下:
加入NaOH溶液的质量(g) 40.0 80.0 120.0 160.0 200.0
生成沉淀的质量(g) 0.0 2.45 7.35 9.8 9.8
(1)分析实验过程,第一次加入40.0g NaOH溶液,为什么没有生成沉淀?____。
(2)分析实验过程,如果加入90g NaOH溶液,溶液中的溶质是____。
(3)原来混合液中氯化铜的质量为多少克?(写出具体计算过程)
(4)若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会造成计算出的氯化铜的含量____。
A.偏高 B.偏低 C.不变
2.2020年5月12日9时16分,我国在酒泉卫星发射中心用快舟一号甲运载火箭,成功将行云二号01/02星发射升空。该火箭用联氨(N2H4)做燃料,反应原理:2N2H4+N2O4 点燃 3N2+4H2O
(1)该火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃的原因是_________。
(2)请计算19.2kgN2H4完全燃烧需要助燃物N2O4的质量。
3.小金按如图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息_______(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
4.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
(1)上表中m的数值是__________。
(2)反应中碳酸钙有剩余是第_________次实验。
(3)稀盐酸中溶质的质量分数是多少?
5.为了测定某种贝壳中碳酸钙的质量分数,小金同学称取50g贝壳样品,分别在5只烧杯中进行了实验,实验数据见下表(假设贝壳中其它物质不与盐酸反应):根据实验设计及有关数据进行分析与计算:
烧杯A 烧杯B 烧杯C 烧杯D 烧杯E
加入贝壳样品的质量/g 10 10 10 10 10
加入稀盐酸的质量/g 10 20 30 40 50
充分反应后生成气体的质量/g 0.88 1.76 x 3.52 3.52
(1)表格中x的值为_____。
(2)求样品中碳酸钙的质量分数。_____。
参考答案
例1.
例2.⑴N2⑵8.25万吨
【解析】⑴空气中氮气含量高达百分之七十八,可以通过分离空气直接得到的氮气。 (2)解设若需要合成8.5万吨氨,需要消耗H2的质量为x
6 34
X 8.5万吨
6/x=34/8.5万吨 X=1.5万吨
因为如果原料气H2用天然气来制取,理论上每生产1吨H2会同时产生5.5吨 C02,所以改用新方法制取原料气H2可以减少排放C02的质量为1.5*5.5万吨 =8.25万吨。
例3.(1)盈利; (2)23.5 吨
1.(1)42;(2)11:40;(3)21.5g
2.(1)16;(2)64.78;(3)35.3%;(4)0.8g
3.(1)1:4:1。
(2)设甲醇的质量为x。
CH4+O2+H2=========CH3OH+H2O
16 32
16吨×17.3% x
x=5.5吨
答:获得甲醇的最大质量约为5.5吨。
4.(1)NO;(2)2kg.
【解析】根据质量守恒定律从元素、原子角度的解释,元素种类反应前后不变、原子个数反应前后不变,可得A 的化学式为 NO;因为题目条件为用 6.4kg 铜(Cu)与足量稀硝酸反应,根据化学反应方程式列式可以得出 2kg.
5.(1)A;
1.(1)NaOH和HCl先反应了(或HCl过量);(2)CuCl2和NaCl;(3)13.5g;(4)A
【解析】 (3)设原来混合液中CuCl2的质量为x。
CuCl2+2NaOH===2NaCl+Cu(OH)2↓
135 98
x 9.8g
=,x=13.5g,
答:原来混合液中氯化铜的质量为13.5g。
2.(1)生成物是 N2 和 H2O,不会对大气造成污染;(2)27.6kg.
3.(1)不能 ?(2)21.2% ??
4.(1)4.4(2)三、四
(3)解:设50g稀盐酸中含有氯化氢的质量为y,第三次中的氯化氢完全反应,以第三次进行计算,
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 ? ? ? ? ? ? ?? 44?
y ? ? ? ? ? ? ?? 4.4g
73/y=44/4.4g y=7.3g,稀盐酸的质量分数为:7.3/50×100%=14.6%
答:稀盐酸中溶质的质量分数是是14.6%
5.(1)2.64 (2)80%
【详解】(1)根据表格中的数据可以看出在样品质量一定时,盐酸的质量每增加10g,生成的气体的质量就增加0.88g,则烧杯③中产生的二氧化碳的质量为1.78g+0.88g=2.64g;
(2)由烧杯④和⑤中数据可知,烧杯④中恰好完全反应,设样品中碳酸钙的质量为x。
解得x=8g;
则样品中碳酸钙的质量分数=。
