甘肃省酒泉市油田一高2020-2021学年高一下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 甘肃省酒泉市油田一高2020-2021学年高一下学期期中考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 440.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-06 20:02:48 | ||
图片预览



文档简介
青海油田一中2020---2021年第二学期期中试题
高一化学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分为150分,答题时间为120分钟。
可能用到的相对原子质量: Ag 108 Fe 56 Zn 65
第Ⅰ卷(选择题,共80分)
一、选择题(每小题4分,共80分,每小题只有一个选项符合题意。)
1. “嫦娥一号”的主要任务之一是探明月球上He的储量。据科学家预测,月球的土壤中吸附
着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上氦元素主要以He的形式存在。下列说法正确的是( )
A. He原子核内有4个质子 B. He和He互为同位素
C. He原子核内有3个中子 D. He最外层电子数为2,所以He具有较强金属性
2. 下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
3.下列有关化学用语的表示方法中正确的是( )
A. N2的电子式: B. NH4I 的电子式:
C.NaCl的电子式: D.F 离子的结构示意图:
4. 有关元素周期表的说法中错误的是( )
A. 元素周期表中第16个纵行为ⅥA族
B. ⅦA族元素也称为卤族元素
C. 元素周期表中,Ⅷ族包括第8,9,10三个纵行
D. 0族元素的原子最外层电子数均为8,元素化合价为0
5. 下列各组物质中化学键的类型相同的是( )
A.HCl 、MgCl2、NH4Cl B.NH3、H2O、CO2 C.CaCl2、NaOH、H2O D.H2O、Na2O、CO2
6. 在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能 是 ( )
A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D.Z为0.4mol/L
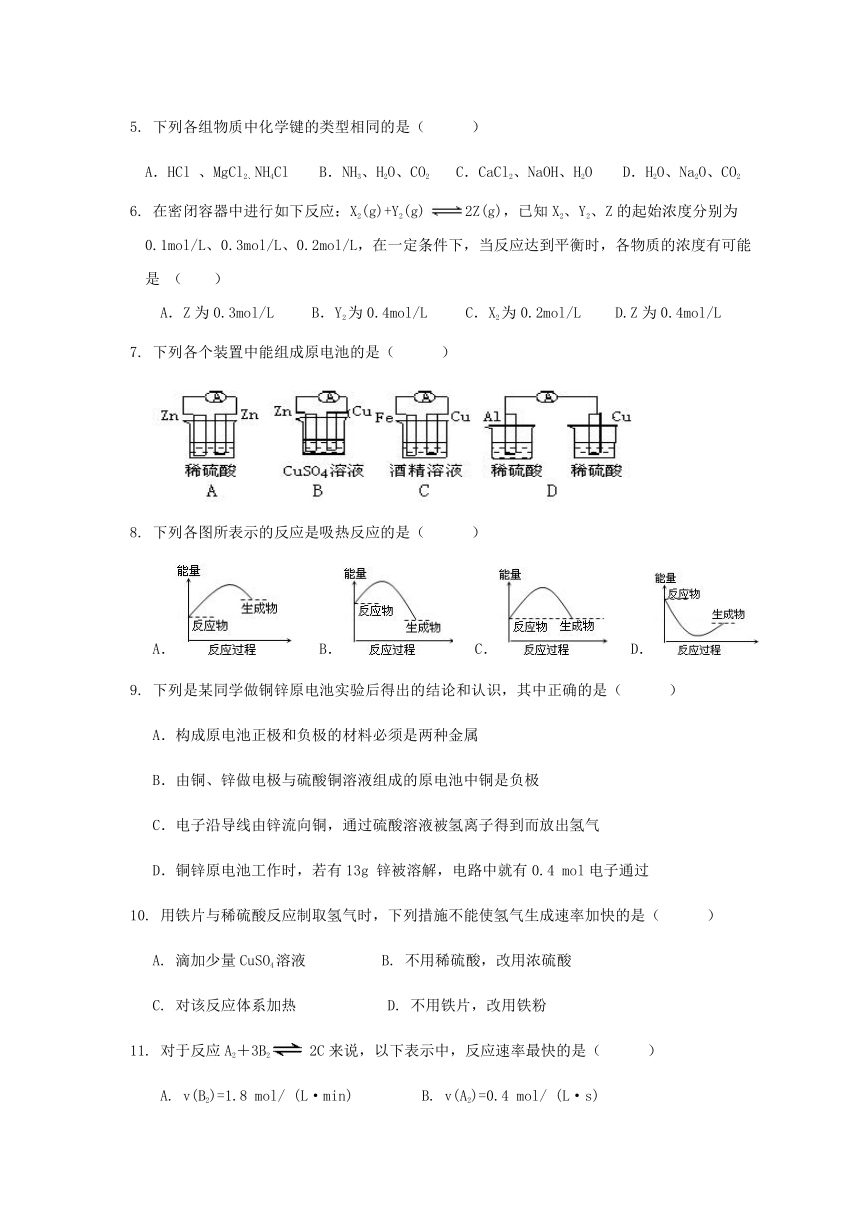
7. 下列各个装置中能组成原电池的是( )
8. 下列各图所表示的反应是吸热反应的是( )
A. B. C. D.
9. 下列是某同学做铜锌原电池实验后得出的结论和认识,其中正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌做电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13g 锌被溶解,电路中就有0.4 mol电子通过
10. 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 滴加少量CuSO4溶液 B. 不用稀硫酸,改用浓硫酸
C. 对该反应体系加热 D. 不用铁片,改用铁粉
11. 对于反应A2+3B2 2C来说,以下表示中,反应速率最快的是( )
A. v(B2)=1.8 mol/ (L·min) B. v(A2)=0.4 mol/ (L·s)
C. v(C)=0.6 mol/ (L·s D. v(B2)=0.8 mol/ (L·s)
12. 下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl A.①②③ B.②③④ C.①②④⑤ D.①②③④⑤
13. 有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
A.A>C>D>B B.C>A>B>D C.A>B>C>D D.B>D>C>A
14.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )
①a-b=n-m ②元素的原子序数:a>b>c>d
③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
A. ①②③ B. ①②③④ C.只有③ D. ②③
15. 已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 mol C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 mol C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是( )
A.金刚石比石墨稳定 B. 石墨转化为金刚石是物理变化
C. 石墨的能量比金刚石的能量高 D. 由石墨制备金刚石一定是吸热反应
16. 恒温恒容密闭容器中发生反应2A(g)+B(g)2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A.等于10 s B.等于12 s C.大于12 s D.小于12 s
17.按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示 ( )①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
仅①③ B. 仅①③⑤
C. 仅②④ D. 仅②④⑤
18.X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A. (m+n+2)W/m mol B. (m-n+2)W/m mol
C. (m+n-2)W/m mol D. (m-n-2)W/m mol
19. 电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为。下列说法不正确的是( )
A.锌是负极,氧化银是正极
B.正极反应式为:Ag2O+2e-+H2O===2Ag+2OH-
C.溶液中向负极移动,K+向正极移动
D.随着电极反应的不断进行,电解质溶液的pH会减小
20. 可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n mol O2 的同时生成2n molNO ②反应物的转化率不再变化 ③单位时间内生成n mol O2 的同时消耗2n molNO2 ④用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态 ⑦混合气体的平均摩尔质量不再改变的状态 ⑧混合气体的压强不再变化 ( )
A、②⑤⑦⑧ B、②③⑤⑦ C、③④⑥⑧ D、①②④⑤⑧
青海油田一中2020---2021年第二学期期中考试题
高一化学
一、选择题答题卡(每小题4分,共80分)
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
第Ⅱ卷(非选择题,共70分)
二.非选择题
21、(每空1分共14分)
(1)在H,H,H, Mg,Mg,O,O,O中共有___________种元素,____________种原子,中子数最多的是 。D218O的相对分子质量是_______________。下列各分子中,所有原子都满足最外层为8电子结构的是 。
A.H2O B.BF3 C.CCl4 D.PCl5
(2)在H2O2、KCl、Na2SO4、Na2O2、HCl、O2中只含离子键的是__________________ ,只含极性键
的是________________________ ,只含非极性键的是________________________,既含离子键又
含极性键的____________________________,既含离子键又含非极性键的是 ,既有
极性键又有非极性键的是 。
(3)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、
946k J、391k J。则由N2和H2反应生成1 mol NH3 需要 (填“放出”或“吸
收”)热量为 。(2分)
22、根据元素周期表回答下列问题(每空1分共12分)
(1)在上面元素周期表中全部是金属元素的区域为_________。
A.a B.b C.c D.d
(2)G元素与E元素形成的化合物的化学式是_________、_____________,它们都是___________。(填“共价化合物”或“离子化合物”)。表格中九种元素的最高价氧化物对应的水化物中,碱性最强的是____________(用化合物的化学式表示,下同),酸性最强的是________________,属于两性氢氧化物的是________________,写出此氢氧化物溶于强碱溶液的离子方程式________
________________________________。(2分)
(3)①用元素符号将铁元素填写在上面元素周期表中对应的位置__ _。
②G、H两元素相比较,金属性较强的是_______________(填名称),可以验证该结论的实验是_______________。(填编号)
(a)看哪种原子失去的电子越多,金属性越强。
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
23、(每空2分共8分)如图所示,把试管放入盛有250C饱和石灰水的烧杯中,先向试管中放入几小块镁片,再滴入5ml稀盐酸。回答下列问题:
(1)实验中观察到的现象是_____________________________________________________。
(2)产生上述现象的原因是__________________________________________________
(3)写出有关反应的离子方程式:_________________________________________。(1分)
(4)由实验推知,反应中MgCl2和H2的总能量_________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)上述实验过程中能量转化的主要方式是___________________。(1分)
24.(共14分)某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
烧杯中反应的离子方程式为____________________________________________;
中Zn板是_____________极,发生的电极反应式是__________________________,Cu板上的现象是______________________________,发生的电极反应式是___________________________;
从能量转化的角度来看,A、B中反应物的总能量____________填“大于”、“小于”或“等于”生成物总能量,A中是将化学能转变为_____________________,B中主要是将化学能转变为______________________________。
该小组同学反思原电池的原理,其中观点正确的是__ ____填字母序号。
A.原电池反应的过程中一定有电子转移 B.原电池装置需要2个电极
C.电极一定不能参加反应 D.氧化反应和还原反应可以拆开在两极发生.
25.(共13分)
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原
子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴
离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同
条件下反应,可生成离子化合物D2A或D2A2。请回答
(1)写出元素符号B:_________________ ;C:___________________;
(2)BA2的结构式 ,BA2分子中化学键属于 键;
(3)D2A2的电子式 ,D2A2中化学键属于 键;
(4)C在元素周期表中的位置是 ,其原子结构示意图 ;(5)电子式表示化合物 D2A 的形成过程: 。26.(每空1分共9分)
在一个容积为2L的密闭容器内进行如下反应:A2(g)+3B2(g)=aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。请计算:
(1)a值___________。
(2)X的表示式(用A、B表示)__________________________。
(3)用A2表示化学反应速率为_________________________。
(4)2min末B2的转化率为___________________。
反应达到平衡的过程中容器内气体的平均相对分子质量如何变化? 。(填增大,减小或不变,下同).气体的密度如何变化? 。体系的压强如何变化?_____________。
当反应达到平衡后对体系增大压强平衡__________(填会不会)移动,若移动向______________(填正或逆)方向移动。
青海油田一中2020---2021年第二学期期中试题
高一化学(答案)
一、选择题(每小题4分共80)
1 2 3 4 5 6 7 8 9 10
B C D D B A B A D B
11 12 13 14 15 16 17 18 19 20
B C A A D C B D D A
二、填空(共27分)
21.(每空1分共14分)(1) 3, 8, Mg 22 C (2)KCl , HCl, O2, Na2SO4, Na2O2, H2O2 (3)放出; 46kJ(不带单位不得分 ) (2分)
22.(每空1分共12分)(1). b (2). Na2O2 Na2O ,离子化合物,NaOH,HClO4,Al(OH)3
Al(OH)3+OH-=AlO2-+2 H2O (2分)
(3).钠 , bc(2分)
23.(每空2分共8分)(1)镁片逐渐溶解,产生大量气泡,烧杯中有白色固体析出
(2)镁与盐酸反应放热,的溶解度随温度升高而减小
(1分) (4)小于 (5)化学能转化为热能(1分)
24.(共14分)
(1)(2分) (2)负(1分)(2分)有无色气体产生(2分)(2分)大于(1分)热能(1分)电能(1分)ABD(2分)
25.(共13分)
(1)C(1分)Si(1分)(2)O=C=O(1分)共价键(1分)
(3)(2分)离子键,和共价键(2分)
(4)第三周期第ⅣA族(2分)(1分)(5)(2分)
26.(每空1分共9分)(1)2 (2)AB3 (3)0.075mol/(l*min)(单位错不得分)(4)90%(5)增大,不变,减小,会,正
高一化学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分为150分,答题时间为120分钟。
可能用到的相对原子质量: Ag 108 Fe 56 Zn 65
第Ⅰ卷(选择题,共80分)
一、选择题(每小题4分,共80分,每小题只有一个选项符合题意。)
1. “嫦娥一号”的主要任务之一是探明月球上He的储量。据科学家预测,月球的土壤中吸附
着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上氦元素主要以He的形式存在。下列说法正确的是( )
A. He原子核内有4个质子 B. He和He互为同位素
C. He原子核内有3个中子 D. He最外层电子数为2,所以He具有较强金属性
2. 下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
3.下列有关化学用语的表示方法中正确的是( )
A. N2的电子式: B. NH4I 的电子式:
C.NaCl的电子式: D.F 离子的结构示意图:
4. 有关元素周期表的说法中错误的是( )
A. 元素周期表中第16个纵行为ⅥA族
B. ⅦA族元素也称为卤族元素
C. 元素周期表中,Ⅷ族包括第8,9,10三个纵行
D. 0族元素的原子最外层电子数均为8,元素化合价为0
5. 下列各组物质中化学键的类型相同的是( )
A.HCl 、MgCl2、NH4Cl B.NH3、H2O、CO2 C.CaCl2、NaOH、H2O D.H2O、Na2O、CO2
6. 在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能 是 ( )
A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D.Z为0.4mol/L
7. 下列各个装置中能组成原电池的是( )
8. 下列各图所表示的反应是吸热反应的是( )
A. B. C. D.
9. 下列是某同学做铜锌原电池实验后得出的结论和认识,其中正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌做电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13g 锌被溶解,电路中就有0.4 mol电子通过
10. 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 滴加少量CuSO4溶液 B. 不用稀硫酸,改用浓硫酸
C. 对该反应体系加热 D. 不用铁片,改用铁粉
11. 对于反应A2+3B2 2C来说,以下表示中,反应速率最快的是( )
A. v(B2)=1.8 mol/ (L·min) B. v(A2)=0.4 mol/ (L·s)
C. v(C)=0.6 mol/ (L·s D. v(B2)=0.8 mol/ (L·s)
12. 下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl
13. 有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
A.A>C>D>B B.C>A>B>D C.A>B>C>D D.B>D>C>A
14.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )
①a-b=n-m ②元素的原子序数:a>b>c>d
③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
A. ①②③ B. ①②③④ C.只有③ D. ②③
15. 已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 mol C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 mol C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是( )
A.金刚石比石墨稳定 B. 石墨转化为金刚石是物理变化
C. 石墨的能量比金刚石的能量高 D. 由石墨制备金刚石一定是吸热反应
16. 恒温恒容密闭容器中发生反应2A(g)+B(g)2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A.等于10 s B.等于12 s C.大于12 s D.小于12 s
17.按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示 ( )①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
仅①③ B. 仅①③⑤
C. 仅②④ D. 仅②④⑤
18.X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A. (m+n+2)W/m mol B. (m-n+2)W/m mol
C. (m+n-2)W/m mol D. (m-n-2)W/m mol
19. 电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为。下列说法不正确的是( )
A.锌是负极,氧化银是正极
B.正极反应式为:Ag2O+2e-+H2O===2Ag+2OH-
C.溶液中向负极移动,K+向正极移动
D.随着电极反应的不断进行,电解质溶液的pH会减小
20. 可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n mol O2 的同时生成2n molNO ②反应物的转化率不再变化 ③单位时间内生成n mol O2 的同时消耗2n molNO2 ④用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态 ⑦混合气体的平均摩尔质量不再改变的状态 ⑧混合气体的压强不再变化 ( )
A、②⑤⑦⑧ B、②③⑤⑦ C、③④⑥⑧ D、①②④⑤⑧
青海油田一中2020---2021年第二学期期中考试题
高一化学
一、选择题答题卡(每小题4分,共80分)
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
第Ⅱ卷(非选择题,共70分)
二.非选择题
21、(每空1分共14分)
(1)在H,H,H, Mg,Mg,O,O,O中共有___________种元素,____________种原子,中子数最多的是 。D218O的相对分子质量是_______________。下列各分子中,所有原子都满足最外层为8电子结构的是 。
A.H2O B.BF3 C.CCl4 D.PCl5
(2)在H2O2、KCl、Na2SO4、Na2O2、HCl、O2中只含离子键的是__________________ ,只含极性键
的是________________________ ,只含非极性键的是________________________,既含离子键又
含极性键的____________________________,既含离子键又含非极性键的是 ,既有
极性键又有非极性键的是 。
(3)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、
946k J、391k J。则由N2和H2反应生成1 mol NH3 需要 (填“放出”或“吸
收”)热量为 。(2分)
22、根据元素周期表回答下列问题(每空1分共12分)
(1)在上面元素周期表中全部是金属元素的区域为_________。
A.a B.b C.c D.d
(2)G元素与E元素形成的化合物的化学式是_________、_____________,它们都是___________。(填“共价化合物”或“离子化合物”)。表格中九种元素的最高价氧化物对应的水化物中,碱性最强的是____________(用化合物的化学式表示,下同),酸性最强的是________________,属于两性氢氧化物的是________________,写出此氢氧化物溶于强碱溶液的离子方程式________
________________________________。(2分)
(3)①用元素符号将铁元素填写在上面元素周期表中对应的位置__ _。
②G、H两元素相比较,金属性较强的是_______________(填名称),可以验证该结论的实验是_______________。(填编号)
(a)看哪种原子失去的电子越多,金属性越强。
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
23、(每空2分共8分)如图所示,把试管放入盛有250C饱和石灰水的烧杯中,先向试管中放入几小块镁片,再滴入5ml稀盐酸。回答下列问题:
(1)实验中观察到的现象是_____________________________________________________。
(2)产生上述现象的原因是__________________________________________________
(3)写出有关反应的离子方程式:_________________________________________。(1分)
(4)由实验推知,反应中MgCl2和H2的总能量_________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)上述实验过程中能量转化的主要方式是___________________。(1分)
24.(共14分)某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
烧杯中反应的离子方程式为____________________________________________;
中Zn板是_____________极,发生的电极反应式是__________________________,Cu板上的现象是______________________________,发生的电极反应式是___________________________;
从能量转化的角度来看,A、B中反应物的总能量____________填“大于”、“小于”或“等于”生成物总能量,A中是将化学能转变为_____________________,B中主要是将化学能转变为______________________________。
该小组同学反思原电池的原理,其中观点正确的是__ ____填字母序号。
A.原电池反应的过程中一定有电子转移 B.原电池装置需要2个电极
C.电极一定不能参加反应 D.氧化反应和还原反应可以拆开在两极发生.
25.(共13分)
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原
子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴
离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同
条件下反应,可生成离子化合物D2A或D2A2。请回答
(1)写出元素符号B:_________________ ;C:___________________;
(2)BA2的结构式 ,BA2分子中化学键属于 键;
(3)D2A2的电子式 ,D2A2中化学键属于 键;
(4)C在元素周期表中的位置是 ,其原子结构示意图 ;(5)电子式表示化合物 D2A 的形成过程: 。26.(每空1分共9分)
在一个容积为2L的密闭容器内进行如下反应:A2(g)+3B2(g)=aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。请计算:
(1)a值___________。
(2)X的表示式(用A、B表示)__________________________。
(3)用A2表示化学反应速率为_________________________。
(4)2min末B2的转化率为___________________。
反应达到平衡的过程中容器内气体的平均相对分子质量如何变化? 。(填增大,减小或不变,下同).气体的密度如何变化? 。体系的压强如何变化?_____________。
当反应达到平衡后对体系增大压强平衡__________(填会不会)移动,若移动向______________(填正或逆)方向移动。
青海油田一中2020---2021年第二学期期中试题
高一化学(答案)
一、选择题(每小题4分共80)
1 2 3 4 5 6 7 8 9 10
B C D D B A B A D B
11 12 13 14 15 16 17 18 19 20
B C A A D C B D D A
二、填空(共27分)
21.(每空1分共14分)(1) 3, 8, Mg 22 C (2)KCl , HCl, O2, Na2SO4, Na2O2, H2O2 (3)放出; 46kJ(不带单位不得分 ) (2分)
22.(每空1分共12分)(1). b (2). Na2O2 Na2O ,离子化合物,NaOH,HClO4,Al(OH)3
Al(OH)3+OH-=AlO2-+2 H2O (2分)
(3).钠 , bc(2分)
23.(每空2分共8分)(1)镁片逐渐溶解,产生大量气泡,烧杯中有白色固体析出
(2)镁与盐酸反应放热,的溶解度随温度升高而减小
(1分) (4)小于 (5)化学能转化为热能(1分)
24.(共14分)
(1)(2分) (2)负(1分)(2分)有无色气体产生(2分)(2分)大于(1分)热能(1分)电能(1分)ABD(2分)
25.(共13分)
(1)C(1分)Si(1分)(2)O=C=O(1分)共价键(1分)
(3)(2分)离子键,和共价键(2分)
(4)第三周期第ⅣA族(2分)(1分)(5)(2分)
26.(每空1分共9分)(1)2 (2)AB3 (3)0.075mol/(l*min)(单位错不得分)(4)90%(5)增大,不变,减小,会,正
同课章节目录
