鄂南高中化学必修1第四章 非金属及其化合物 检测题
文档属性
| 名称 | 鄂南高中化学必修1第四章 非金属及其化合物 检测题 |  | |
| 格式 | zip | ||
| 文件大小 | 49.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-03 21:11:16 | ||
图片预览

文档简介
化学必修一第四单元检测题
时间:90分钟 总分:100分
一、选择题(本大题共18小题,每小题只有一个正确答案,每小题3分,共18×3=54分)
1.下列名词与环境污染无关的是( )
A、酸雨 B、冻雨 C、光化学烟雾 D、水体富营养化
2.下列说法正确的是( )
A.SiO2溶于水且显酸性
B.SiO2是制造太阳能电池的常用材料
C.SiO2是酸性氧物,它不与任何酸反应
D.向硅酸钠溶液中通入CO2气体,有白色凝胶状固体析出
3.下列物质间的转化能一步实现的是( )
A、SiO2 H2SiO3 B、S SO3
C、N2 NO2 D、Cl2 FeCl3
4.下列实验操作或对实验事实的叙述,正确的是( )
A.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质
B.常温下,浓H2SO4可贮存于铁制或铝制容器中
C.用瓷坩锅高温熔融NaOH
D.向溶液中加入硝酸酸化的BaCl2溶液,以确定其中是否含有SO42-
5.用Cl2与石灰乳充分反应可以制取漂白粉,使用漂白粉作漂白剂比使用氯水更好的理由
是( )
A.转变为易与水反应的物质 B.转变为较为稳定、便于贮存的物质
C.Ca(ClO)2比HClO漂白快 D.提高氯的质量分数
6.若NA表示阿佛加德罗常数,下列说法正确的是( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7︰4
7.下列反应的离子方程式正确的是 ( )
A.向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-=2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3++Fe=3Fe2+
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH―+CO2=CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3++Cu=Fe2++Cu2+
8.下列试剂能贮存在磨口玻璃塞的试剂瓶里的是…( )
A.HF溶液 B.KOH溶液 C.盐酸 D.水玻璃
9错误!未指定书签。.在下列溶液中通入CO2至过量,原溶液一直保持澄清的是………………..…( )
A.硅酸钠溶液 B.氯化钡溶液 C.石灰水 D.漂白粉溶液
10.能证明硅酸的酸性弱于碳酸酸性的实验事实是….…( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
11.下列有关氨和硝酸实验的现象或结果,正确的是( )
A.浓氨水滴进碱石灰里可制得氨气
B.蘸浓氨水和蘸浓硫酸的玻璃棒靠近会冒白烟
C.锌片与稀硝酸反应可制得氢气
D.铜片与浓硝酸反应可制得一氧化氮
12.某混合气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混合气体依次通过:(1)澄清石灰水(无浑浊现象),(2)Ba(OH)2溶液(出现白色沉淀),(3)浓硫酸(无明显变化),(5)灼热的氧化铜(变红),(6)无水硫酸铜(变蓝)。则可以判断混合气体中 ( )
A.一定没有CO2,肯定有H2 B.一定有H2、CO2,和HCl
C.一定有CO、CO2和水蒸气 D.可能有CO2、NH3和水蒸气
13.变压器的硅钢片含硅40%,其余为铁,则此硅钢片中硅和铁的原子个数比为4:3。向0.7g硅钢片中先加入20g5.0%的烧碱溶液,充分反应后,再向其中加入25 mL,1.0mol/L的浓盐酸,充分搅拌至反应结束,反应中共放出氢气多少克 ( )
A.0.0l B.0.055 C.0.02 D.0.045
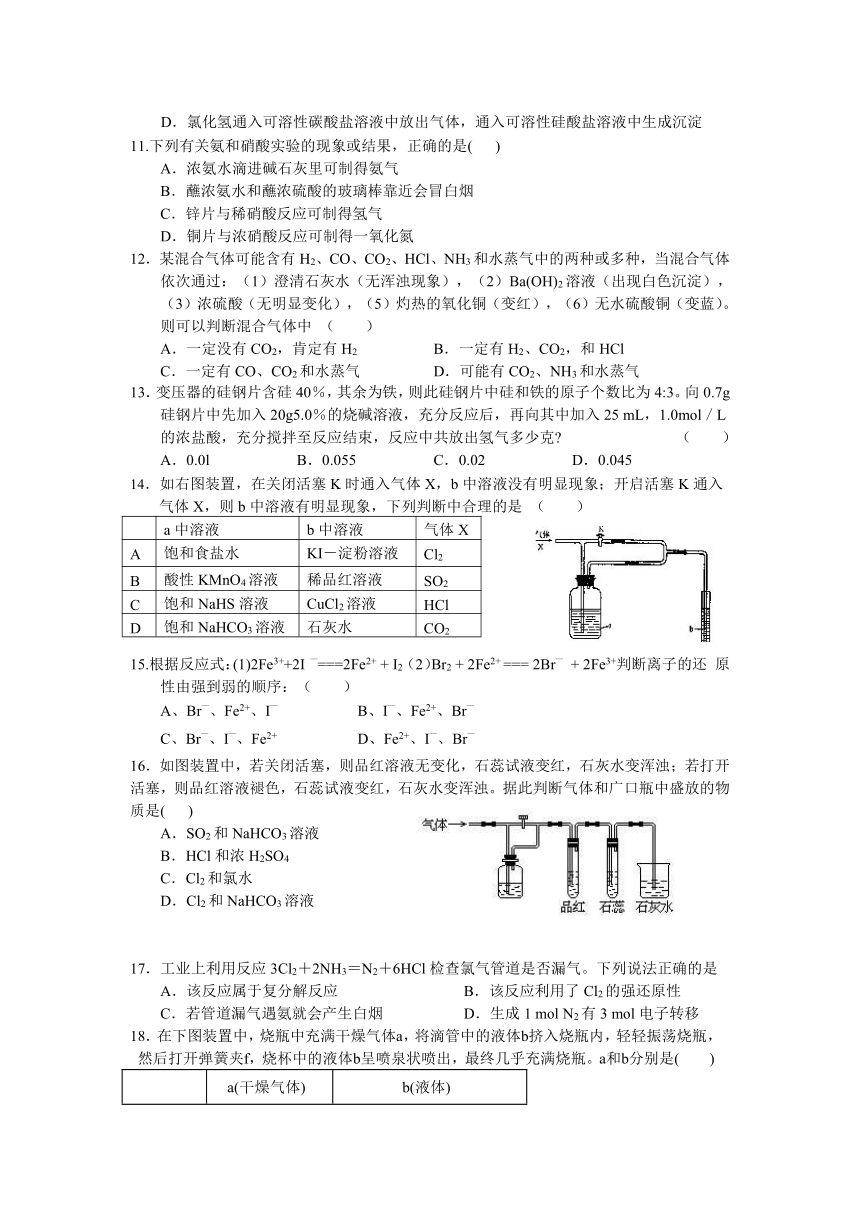
14.如右图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是 ( )
a中溶液 b中溶液 气体X
A 饱和食盐水 KI-淀粉溶液 Cl2
B 酸性KMnO4溶液 稀品红溶液 SO2
C 饱和NaHS溶液 CuCl2溶液 HCl
D 饱和NaHCO3溶液 石灰水 CO2
15.根据反应式:(1)2Fe3++2I —===2Fe2+ + I2 (2)Br2 + 2Fe2+ === 2Br— + 2Fe3+判断离子的还 原性由强到弱的顺序:( )
A、Br—、Fe2+、I— B、I—、Fe2+、Br—
C、Br—、I—、Fe2+ D、Fe2+、I—、Br—
16.如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )
A.SO2和NaHCO3溶液
B.HCl和浓H2SO4
C.Cl2和氯水
D.Cl2和NaHCO3溶液
17.工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法正确的是
A.该反应属于复分解反应 B.该反应利用了Cl2的强还原性
C.若管道漏气遇氨就会产生白烟 D.生成1 mol N2有3 mol电子转移
18.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是( )
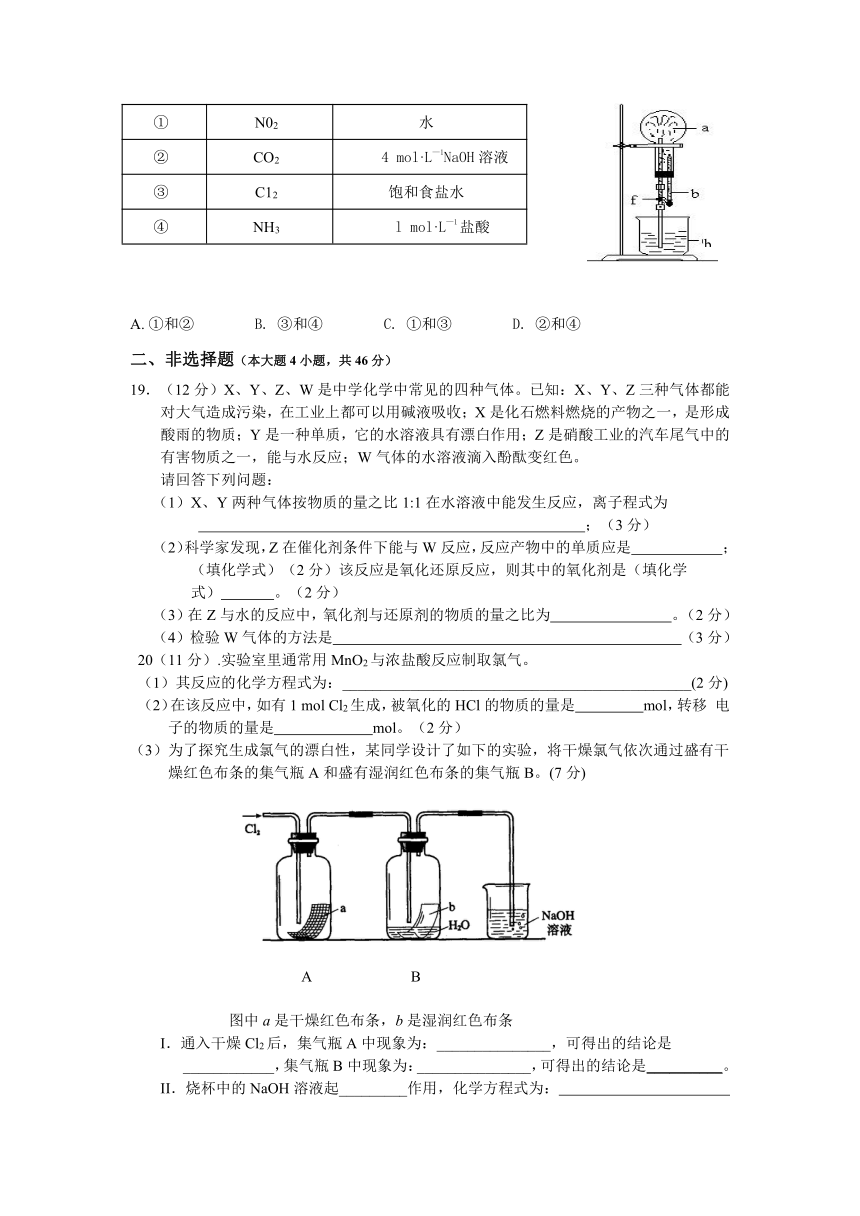
a(干燥气体) b(液体)
① N02 水
② CO2 4 mol·L—1NaOH溶液
③ C12 饱和食盐水
④ NH3 l mol·L—1盐酸
A. ①和② B. ③和④ C. ①和③ D. ②和④
二、非选择题(本大题4小题,共46分)
19.(12分)X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,离子程式为
;(3分)
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是 ;(填化学式)(2分)该反应是氧化还原反应,则其中的氧化剂是(填化学式) 。(2分)
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为 。(2分)
(4)检验W气体的方法是 (3分)
20(11分).实验室里通常用MnO2与浓盐酸反应制取氯气。
(1)其反应的化学方程式为:______________________________________________(2分)
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移 电 子的物质的量是 mol。(2分)
(3)为了探究生成氯气的漂白性,某同学设计了如下的实验,将干燥氯气依次通过盛有干燥红色布条的集气瓶A和盛有湿润红色布条的集气瓶B。(7分)
A B
图中a是干燥红色布条,b是湿润红色布条
I.通入干燥Cl2后,集气瓶A中现象为:_______________,可得出的结论是____________,集气瓶B中现象为:_______________,可得出的结论是__________。
II.烧杯中的NaOH溶液起_________作用,化学方程式为:
。
20.为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
22.将48 g铜与200 mL一定浓度的硝酸反应,铜完全溶解,产生的气体在标准状况下的体积为22.4L。请回答:
I、(1)判断该气体的成分是 其体积分别是:
(2)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液恰好使溶液中的
Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
II、若将产生的气体与一定量的氧气混合通入水中最终气体恰好被完全吸收则此过程中消耗的氧气在标准状况下的体积为
参 考 答 案
班级 姓名
一、选择题(本大题共18小题,每小题只有一个正确答案,每小题3分,共18×3=54分)
题号: 1 2 3 4 5 6 7 8 9
答案: B D D B B C B C B
题号: 10 11 12 13 14 15 16 17 18
答案: B A B C B B A C D
二、非选择题(本大题4小题,共46分)
19.8分)(1)Cl2+SO2+2H2O=2HCl+H2SO4(2分)
(2)N2(1分) NO2(1分)
(3)1:2(2分)
20.(12分)
(1)略
(2) 2 mol,(2分) 2 mol。(2分)
(3)(每空1分)
I. 无明显现象 , 干燥的氯气不能使布条褪色;
布条褪色, 湿润的氯气具有漂白性。
II. 吸收尾气 ,
略。
21.(12分)(1)A.F、E、C.D.B
乙中出现白色沉淀,丙中品红未褪色
吸收SO2 (4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O?
22.(10分)
I、(1) NO和NO2的混合物,(2分)
NO:5.6L NO2:16.8L (2分)
(2) mol·L-1(3分)
II、 8.4L(3分)
2,4,6
b
甲
乙
丙
丁
酸性KMnO4
品红
澄清石
灰水
浓H2SO4
木炭
A
B
C
D
E
F
时间:90分钟 总分:100分
一、选择题(本大题共18小题,每小题只有一个正确答案,每小题3分,共18×3=54分)
1.下列名词与环境污染无关的是( )
A、酸雨 B、冻雨 C、光化学烟雾 D、水体富营养化
2.下列说法正确的是( )
A.SiO2溶于水且显酸性
B.SiO2是制造太阳能电池的常用材料
C.SiO2是酸性氧物,它不与任何酸反应
D.向硅酸钠溶液中通入CO2气体,有白色凝胶状固体析出
3.下列物质间的转化能一步实现的是( )
A、SiO2 H2SiO3 B、S SO3
C、N2 NO2 D、Cl2 FeCl3
4.下列实验操作或对实验事实的叙述,正确的是( )
A.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质
B.常温下,浓H2SO4可贮存于铁制或铝制容器中
C.用瓷坩锅高温熔融NaOH
D.向溶液中加入硝酸酸化的BaCl2溶液,以确定其中是否含有SO42-
5.用Cl2与石灰乳充分反应可以制取漂白粉,使用漂白粉作漂白剂比使用氯水更好的理由
是( )
A.转变为易与水反应的物质 B.转变为较为稳定、便于贮存的物质
C.Ca(ClO)2比HClO漂白快 D.提高氯的质量分数
6.若NA表示阿佛加德罗常数,下列说法正确的是( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7︰4
7.下列反应的离子方程式正确的是 ( )
A.向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-=2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3++Fe=3Fe2+
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH―+CO2=CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3++Cu=Fe2++Cu2+
8.下列试剂能贮存在磨口玻璃塞的试剂瓶里的是…( )
A.HF溶液 B.KOH溶液 C.盐酸 D.水玻璃
9错误!未指定书签。.在下列溶液中通入CO2至过量,原溶液一直保持澄清的是………………..…( )
A.硅酸钠溶液 B.氯化钡溶液 C.石灰水 D.漂白粉溶液
10.能证明硅酸的酸性弱于碳酸酸性的实验事实是….…( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
11.下列有关氨和硝酸实验的现象或结果,正确的是( )
A.浓氨水滴进碱石灰里可制得氨气
B.蘸浓氨水和蘸浓硫酸的玻璃棒靠近会冒白烟
C.锌片与稀硝酸反应可制得氢气
D.铜片与浓硝酸反应可制得一氧化氮
12.某混合气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混合气体依次通过:(1)澄清石灰水(无浑浊现象),(2)Ba(OH)2溶液(出现白色沉淀),(3)浓硫酸(无明显变化),(5)灼热的氧化铜(变红),(6)无水硫酸铜(变蓝)。则可以判断混合气体中 ( )
A.一定没有CO2,肯定有H2 B.一定有H2、CO2,和HCl
C.一定有CO、CO2和水蒸气 D.可能有CO2、NH3和水蒸气
13.变压器的硅钢片含硅40%,其余为铁,则此硅钢片中硅和铁的原子个数比为4:3。向0.7g硅钢片中先加入20g5.0%的烧碱溶液,充分反应后,再向其中加入25 mL,1.0mol/L的浓盐酸,充分搅拌至反应结束,反应中共放出氢气多少克 ( )
A.0.0l B.0.055 C.0.02 D.0.045
14.如右图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是 ( )
a中溶液 b中溶液 气体X
A 饱和食盐水 KI-淀粉溶液 Cl2
B 酸性KMnO4溶液 稀品红溶液 SO2
C 饱和NaHS溶液 CuCl2溶液 HCl
D 饱和NaHCO3溶液 石灰水 CO2
15.根据反应式:(1)2Fe3++2I —===2Fe2+ + I2 (2)Br2 + 2Fe2+ === 2Br— + 2Fe3+判断离子的还 原性由强到弱的顺序:( )
A、Br—、Fe2+、I— B、I—、Fe2+、Br—
C、Br—、I—、Fe2+ D、Fe2+、I—、Br—
16.如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )
A.SO2和NaHCO3溶液
B.HCl和浓H2SO4
C.Cl2和氯水
D.Cl2和NaHCO3溶液
17.工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法正确的是
A.该反应属于复分解反应 B.该反应利用了Cl2的强还原性
C.若管道漏气遇氨就会产生白烟 D.生成1 mol N2有3 mol电子转移
18.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是( )
a(干燥气体) b(液体)
① N02 水
② CO2 4 mol·L—1NaOH溶液
③ C12 饱和食盐水
④ NH3 l mol·L—1盐酸
A. ①和② B. ③和④ C. ①和③ D. ②和④
二、非选择题(本大题4小题,共46分)
19.(12分)X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,离子程式为
;(3分)
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是 ;(填化学式)(2分)该反应是氧化还原反应,则其中的氧化剂是(填化学式) 。(2分)
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为 。(2分)
(4)检验W气体的方法是 (3分)
20(11分).实验室里通常用MnO2与浓盐酸反应制取氯气。
(1)其反应的化学方程式为:______________________________________________(2分)
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移 电 子的物质的量是 mol。(2分)
(3)为了探究生成氯气的漂白性,某同学设计了如下的实验,将干燥氯气依次通过盛有干燥红色布条的集气瓶A和盛有湿润红色布条的集气瓶B。(7分)
A B
图中a是干燥红色布条,b是湿润红色布条
I.通入干燥Cl2后,集气瓶A中现象为:_______________,可得出的结论是____________,集气瓶B中现象为:_______________,可得出的结论是__________。
II.烧杯中的NaOH溶液起_________作用,化学方程式为:
。
20.为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
22.将48 g铜与200 mL一定浓度的硝酸反应,铜完全溶解,产生的气体在标准状况下的体积为22.4L。请回答:
I、(1)判断该气体的成分是 其体积分别是:
(2)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液恰好使溶液中的
Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
II、若将产生的气体与一定量的氧气混合通入水中最终气体恰好被完全吸收则此过程中消耗的氧气在标准状况下的体积为
参 考 答 案
班级 姓名
一、选择题(本大题共18小题,每小题只有一个正确答案,每小题3分,共18×3=54分)
题号: 1 2 3 4 5 6 7 8 9
答案: B D D B B C B C B
题号: 10 11 12 13 14 15 16 17 18
答案: B A B C B B A C D
二、非选择题(本大题4小题,共46分)
19.8分)(1)Cl2+SO2+2H2O=2HCl+H2SO4(2分)
(2)N2(1分) NO2(1分)
(3)1:2(2分)
20.(12分)
(1)略
(2) 2 mol,(2分) 2 mol。(2分)
(3)(每空1分)
I. 无明显现象 , 干燥的氯气不能使布条褪色;
布条褪色, 湿润的氯气具有漂白性。
II. 吸收尾气 ,
略。
21.(12分)(1)A.F、E、C.D.B
乙中出现白色沉淀,丙中品红未褪色
吸收SO2 (4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O?
22.(10分)
I、(1) NO和NO2的混合物,(2分)
NO:5.6L NO2:16.8L (2分)
(2) mol·L-1(3分)
II、 8.4L(3分)
2,4,6
b
甲
乙
丙
丁
酸性KMnO4
品红
澄清石
灰水
浓H2SO4
木炭
A
B
C
D
E
F
