2020-2021学年高二化学人教版(2019)选择性必修2第3章 晶体结构与性质
文档属性
| 名称 | 2020-2021学年高二化学人教版(2019)选择性必修2第3章 晶体结构与性质 |  | |
| 格式 | doc | ||
| 文件大小 | 625.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-07 15:24:55 | ||
图片预览



文档简介
2020—2021人教(新教材)化学选择性必修二第3章 晶体结构与性质(有答案)
选择性必修二第3章 晶体结构与性质
一、选择题
1、Al2O3在一定条件下可制得硬度大、熔点高的氮化铝晶体,其晶体结构如图所示。下列说法正确的是( )
A.氮化铝属于离子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al的配位数为2
2、普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
3、下列性质适合于分子晶体的是( )
①熔点为1 124 ℃,易溶于水,水溶液导电
②熔点为10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃
④熔点为2 320 ℃,不导电,难溶于水
⑤熔点为63.65 ℃,质软,导电,密度为0.86 g·cm-3
A.①②③ B.②③⑤
C.②③ D.②⑤
4、下列关于SiO2晶体网状结构的叙述中正确的是( )
A.最小的环上,有3个硅原子和3个氧原子
B.最小的环上,硅原子数和氧原子数之比为1∶2
C.最小的环上,有6个硅原子和6个氧原子
D.存在四面体结构单元,O处于中心,Si处于4个顶点
5、下列晶体性质的比较中,正确的是( )
A.熔点:单质硫>磷>晶体硅
B.沸点:NH3>H2O>HF
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
6、铝硅合金(含硅13.5%)在凝固时收缩率很小,因而这种合金适合铸造。有下列三种晶体:①铝 ②硅 ③铝硅合金,它们的熔点由低到高的顺序是( )
A.①②③ B.②①③
C.③②① D.③①②
7、通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键
8、(双选)碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是( )
A.金刚石、石墨、足球烯和氧气反应最终产物不同
B.足球烯可以发生加成反应
C.石墨、足球烯均可作为生产耐高温润滑剂的原料
D.足球烯在苯中的溶解度比在乙醇中的溶解度大
9、下列有关晶胞的说法正确的是( )
A.晶胞是晶体中最小的结构单元
B.晶胞中所有的粒子都为几个晶胞共用
C.晶胞均为长方体
D.不同晶体的晶胞不一定相同
10、下列说法中,正确的是( )
A.冰熔化时,分子中H—O键发生断裂
B.分子晶体中,分子熔沸点与共价键的键长无关
C.分子晶体中,共价键键能越大,该分子的熔、沸点就越高
D.分子晶体中,分子间作用力越大,分子越稳定
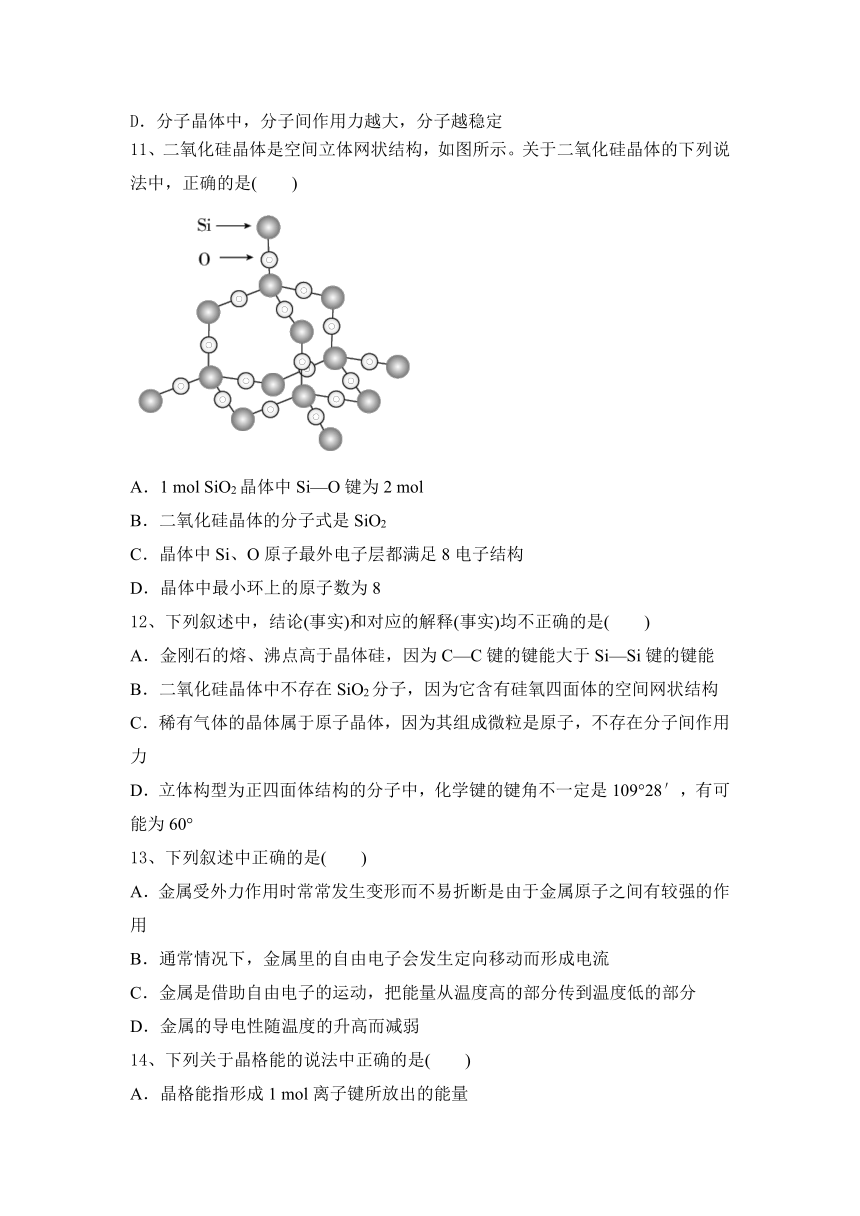
11、二氧化硅晶体是空间立体网状结构,如图所示。关于二氧化硅晶体的下列说法中,正确的是( )
A.1 mol SiO2晶体中Si—O键为2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
12、下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔、沸点高于晶体硅,因为C—C键的键能大于Si—Si键的键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
D.立体构型为正四面体结构的分子中,化学键的键角不一定是109°28′,有可能为60°
13、下列叙述中正确的是( )
A.金属受外力作用时常常发生变形而不易折断是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
14、下列关于晶格能的说法中正确的是( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
二、非选择题
15、单质硼有无定型和晶体两种,参考下表数据,回答下列问题:
物质 金刚石 晶体硅 晶体硼
溶点/K 大于3 828 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度/Mob 10 7.0 9.5
(1)晶体硼的晶体类型属于________晶体,理由是
_________________________________________________________。
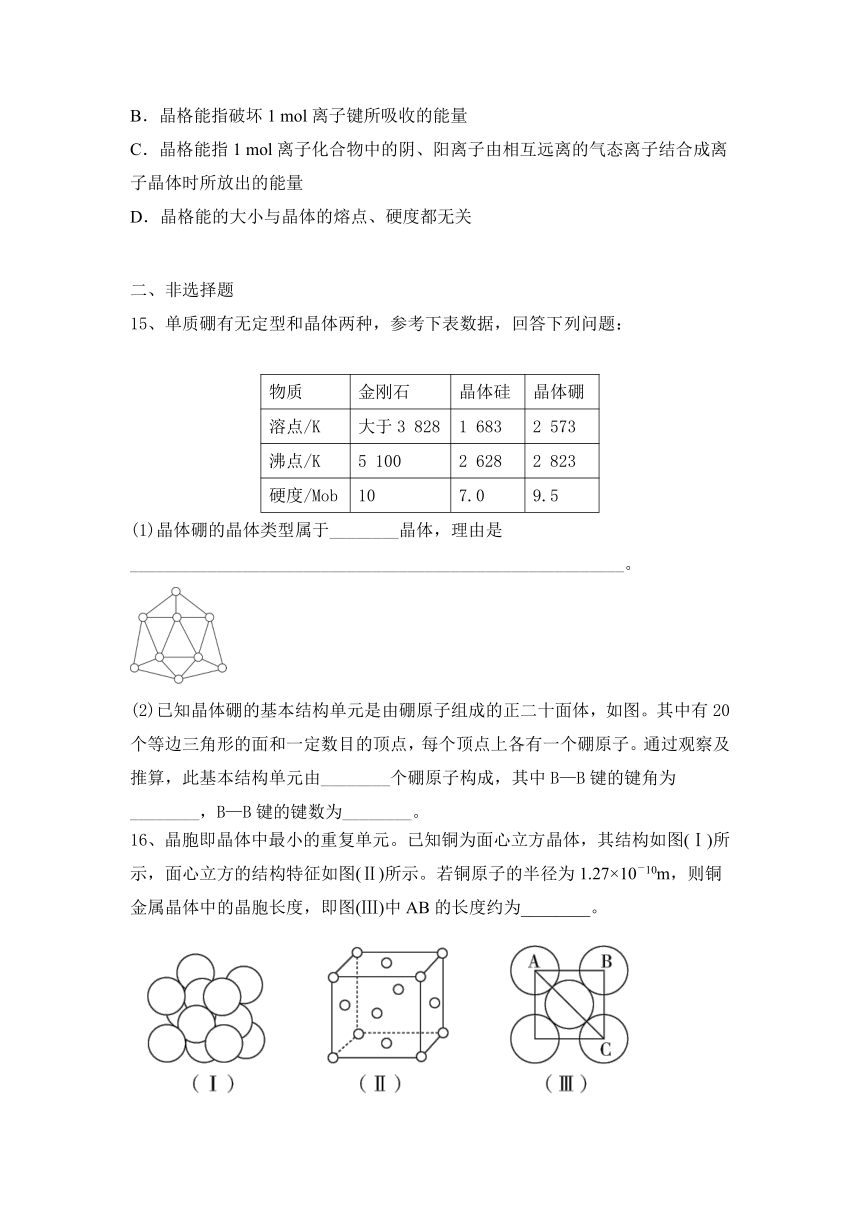
(2)已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由________个硼原子构成,其中B—B键的键角为________,B—B键的键数为________。
16、晶胞即晶体中最小的重复单元。已知铜为面心立方晶体,其结构如图(Ⅰ)所示,面心立方的结构特征如图(Ⅱ)所示。若铜原子的半径为1.27×10-10m,则铜金属晶体中的晶胞长度,即图(Ⅲ)中AB的长度约为________。
2020—2021人教(新教材)化学选择性必修二第3章 晶体结构与性质(有答案)
选择性必修二第3章 晶体结构与性质
一、选择题
1、Al2O3在一定条件下可制得硬度大、熔点高的氮化铝晶体,其晶体结构如图所示。下列说法正确的是( )
A.氮化铝属于离子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al的配位数为2
【答案】B
2、普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
【答案】B
3、下列性质适合于分子晶体的是( )
①熔点为1 124 ℃,易溶于水,水溶液导电
②熔点为10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃
④熔点为2 320 ℃,不导电,难溶于水
⑤熔点为63.65 ℃,质软,导电,密度为0.86 g·cm-3
A.①②③ B.②③⑤
C.②③ D.②⑤
【答案】C
4、下列关于SiO2晶体网状结构的叙述中正确的是( )
A.最小的环上,有3个硅原子和3个氧原子
B.最小的环上,硅原子数和氧原子数之比为1∶2
C.最小的环上,有6个硅原子和6个氧原子
D.存在四面体结构单元,O处于中心,Si处于4个顶点
【答案】C
5、下列晶体性质的比较中,正确的是( )
A.熔点:单质硫>磷>晶体硅
B.沸点:NH3>H2O>HF
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
【答案】D
6、铝硅合金(含硅13.5%)在凝固时收缩率很小,因而这种合金适合铸造。有下列三种晶体:①铝 ②硅 ③铝硅合金,它们的熔点由低到高的顺序是( )
A.①②③ B.②①③
C.③②① D.③①②
【答案】D
7、通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键
【答案】B
8、(双选)碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是( )
A.金刚石、石墨、足球烯和氧气反应最终产物不同
B.足球烯可以发生加成反应
C.石墨、足球烯均可作为生产耐高温润滑剂的原料
D.足球烯在苯中的溶解度比在乙醇中的溶解度大
【答案】BD
9、下列有关晶胞的说法正确的是( )
A.晶胞是晶体中最小的结构单元
B.晶胞中所有的粒子都为几个晶胞共用
C.晶胞均为长方体
D.不同晶体的晶胞不一定相同
【答案】D
10、下列说法中,正确的是( )
A.冰熔化时,分子中H—O键发生断裂
B.分子晶体中,分子熔沸点与共价键的键长无关
C.分子晶体中,共价键键能越大,该分子的熔、沸点就越高
D.分子晶体中,分子间作用力越大,分子越稳定
【答案】B
11、二氧化硅晶体是空间立体网状结构,如图所示。关于二氧化硅晶体的下列说法中,正确的是( )
A.1 mol SiO2晶体中Si—O键为2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
【答案】C
12、下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔、沸点高于晶体硅,因为C—C键的键能大于Si—Si键的键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
D.立体构型为正四面体结构的分子中,化学键的键角不一定是109°28′,有可能为60°
【答案】C
13、下列叙述中正确的是( )
A.金属受外力作用时常常发生变形而不易折断是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
【答案】D
14、下列关于晶格能的说法中正确的是( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
【答案】C
二、非选择题
15、单质硼有无定型和晶体两种,参考下表数据,回答下列问题:
物质 金刚石 晶体硅 晶体硼
溶点/K 大于3 828 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度/Mob 10 7.0 9.5
(1)晶体硼的晶体类型属于________晶体,理由是
_________________________________________________________。
(2)已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由________个硼原子构成,其中B—B键的键角为________,B—B键的键数为________。
【答案】(1)原子 晶体的熔、沸点和硬度都介于晶体硅和金刚石之间,晶体硅和金刚石均为原子晶体,晶体硼也为原子晶体
(2)12 60° 30
16、晶胞即晶体中最小的重复单元。已知铜为面心立方晶体,其结构如图(Ⅰ)所示,面心立方的结构特征如图(Ⅱ)所示。若铜原子的半径为1.27×10-10m,则铜金属晶体中的晶胞长度,即图(Ⅲ)中AB的长度约为________。
【答案】3.59×10-10 m
选择性必修二第3章 晶体结构与性质
一、选择题
1、Al2O3在一定条件下可制得硬度大、熔点高的氮化铝晶体,其晶体结构如图所示。下列说法正确的是( )
A.氮化铝属于离子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al的配位数为2
2、普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
3、下列性质适合于分子晶体的是( )
①熔点为1 124 ℃,易溶于水,水溶液导电
②熔点为10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃
④熔点为2 320 ℃,不导电,难溶于水
⑤熔点为63.65 ℃,质软,导电,密度为0.86 g·cm-3
A.①②③ B.②③⑤
C.②③ D.②⑤
4、下列关于SiO2晶体网状结构的叙述中正确的是( )
A.最小的环上,有3个硅原子和3个氧原子
B.最小的环上,硅原子数和氧原子数之比为1∶2
C.最小的环上,有6个硅原子和6个氧原子
D.存在四面体结构单元,O处于中心,Si处于4个顶点
5、下列晶体性质的比较中,正确的是( )
A.熔点:单质硫>磷>晶体硅
B.沸点:NH3>H2O>HF
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
6、铝硅合金(含硅13.5%)在凝固时收缩率很小,因而这种合金适合铸造。有下列三种晶体:①铝 ②硅 ③铝硅合金,它们的熔点由低到高的顺序是( )
A.①②③ B.②①③
C.③②① D.③①②
7、通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键
8、(双选)碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是( )
A.金刚石、石墨、足球烯和氧气反应最终产物不同
B.足球烯可以发生加成反应
C.石墨、足球烯均可作为生产耐高温润滑剂的原料
D.足球烯在苯中的溶解度比在乙醇中的溶解度大
9、下列有关晶胞的说法正确的是( )
A.晶胞是晶体中最小的结构单元
B.晶胞中所有的粒子都为几个晶胞共用
C.晶胞均为长方体
D.不同晶体的晶胞不一定相同
10、下列说法中,正确的是( )
A.冰熔化时,分子中H—O键发生断裂
B.分子晶体中,分子熔沸点与共价键的键长无关
C.分子晶体中,共价键键能越大,该分子的熔、沸点就越高
D.分子晶体中,分子间作用力越大,分子越稳定
11、二氧化硅晶体是空间立体网状结构,如图所示。关于二氧化硅晶体的下列说法中,正确的是( )
A.1 mol SiO2晶体中Si—O键为2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
12、下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔、沸点高于晶体硅,因为C—C键的键能大于Si—Si键的键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
D.立体构型为正四面体结构的分子中,化学键的键角不一定是109°28′,有可能为60°
13、下列叙述中正确的是( )
A.金属受外力作用时常常发生变形而不易折断是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
14、下列关于晶格能的说法中正确的是( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
二、非选择题
15、单质硼有无定型和晶体两种,参考下表数据,回答下列问题:
物质 金刚石 晶体硅 晶体硼
溶点/K 大于3 828 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度/Mob 10 7.0 9.5
(1)晶体硼的晶体类型属于________晶体,理由是
_________________________________________________________。
(2)已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由________个硼原子构成,其中B—B键的键角为________,B—B键的键数为________。
16、晶胞即晶体中最小的重复单元。已知铜为面心立方晶体,其结构如图(Ⅰ)所示,面心立方的结构特征如图(Ⅱ)所示。若铜原子的半径为1.27×10-10m,则铜金属晶体中的晶胞长度,即图(Ⅲ)中AB的长度约为________。
2020—2021人教(新教材)化学选择性必修二第3章 晶体结构与性质(有答案)
选择性必修二第3章 晶体结构与性质
一、选择题
1、Al2O3在一定条件下可制得硬度大、熔点高的氮化铝晶体,其晶体结构如图所示。下列说法正确的是( )
A.氮化铝属于离子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al的配位数为2
【答案】B
2、普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
【答案】B
3、下列性质适合于分子晶体的是( )
①熔点为1 124 ℃,易溶于水,水溶液导电
②熔点为10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃
④熔点为2 320 ℃,不导电,难溶于水
⑤熔点为63.65 ℃,质软,导电,密度为0.86 g·cm-3
A.①②③ B.②③⑤
C.②③ D.②⑤
【答案】C
4、下列关于SiO2晶体网状结构的叙述中正确的是( )
A.最小的环上,有3个硅原子和3个氧原子
B.最小的环上,硅原子数和氧原子数之比为1∶2
C.最小的环上,有6个硅原子和6个氧原子
D.存在四面体结构单元,O处于中心,Si处于4个顶点
【答案】C
5、下列晶体性质的比较中,正确的是( )
A.熔点:单质硫>磷>晶体硅
B.沸点:NH3>H2O>HF
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
【答案】D
6、铝硅合金(含硅13.5%)在凝固时收缩率很小,因而这种合金适合铸造。有下列三种晶体:①铝 ②硅 ③铝硅合金,它们的熔点由低到高的顺序是( )
A.①②③ B.②①③
C.③②① D.③①②
【答案】D
7、通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键
【答案】B
8、(双选)碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是( )
A.金刚石、石墨、足球烯和氧气反应最终产物不同
B.足球烯可以发生加成反应
C.石墨、足球烯均可作为生产耐高温润滑剂的原料
D.足球烯在苯中的溶解度比在乙醇中的溶解度大
【答案】BD
9、下列有关晶胞的说法正确的是( )
A.晶胞是晶体中最小的结构单元
B.晶胞中所有的粒子都为几个晶胞共用
C.晶胞均为长方体
D.不同晶体的晶胞不一定相同
【答案】D
10、下列说法中,正确的是( )
A.冰熔化时,分子中H—O键发生断裂
B.分子晶体中,分子熔沸点与共价键的键长无关
C.分子晶体中,共价键键能越大,该分子的熔、沸点就越高
D.分子晶体中,分子间作用力越大,分子越稳定
【答案】B
11、二氧化硅晶体是空间立体网状结构,如图所示。关于二氧化硅晶体的下列说法中,正确的是( )
A.1 mol SiO2晶体中Si—O键为2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
【答案】C
12、下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔、沸点高于晶体硅,因为C—C键的键能大于Si—Si键的键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
D.立体构型为正四面体结构的分子中,化学键的键角不一定是109°28′,有可能为60°
【答案】C
13、下列叙述中正确的是( )
A.金属受外力作用时常常发生变形而不易折断是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
【答案】D
14、下列关于晶格能的说法中正确的是( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
【答案】C
二、非选择题
15、单质硼有无定型和晶体两种,参考下表数据,回答下列问题:
物质 金刚石 晶体硅 晶体硼
溶点/K 大于3 828 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度/Mob 10 7.0 9.5
(1)晶体硼的晶体类型属于________晶体,理由是
_________________________________________________________。
(2)已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由________个硼原子构成,其中B—B键的键角为________,B—B键的键数为________。
【答案】(1)原子 晶体的熔、沸点和硬度都介于晶体硅和金刚石之间,晶体硅和金刚石均为原子晶体,晶体硼也为原子晶体
(2)12 60° 30
16、晶胞即晶体中最小的重复单元。已知铜为面心立方晶体,其结构如图(Ⅰ)所示,面心立方的结构特征如图(Ⅱ)所示。若铜原子的半径为1.27×10-10m,则铜金属晶体中的晶胞长度,即图(Ⅲ)中AB的长度约为________。
【答案】3.59×10-10 m
