2020年普通高中学业水平等级考试化学(山东卷)
文档属性
| 名称 | 2020年普通高中学业水平等级考试化学(山东卷) |  | |
| 格式 | docx | ||
| 文件大小 | 770.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-06 22:51:35 | ||
图片预览


文档简介
绝密 ★ 启用前
山东省2020年普通高中学业水平等级考试
化学
(本试卷共4页,20题,满分100分,考试用时90分钟)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Fe 56
一、选择题:本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项符合题目要求。
1.实验室中下列做法错误的是( )
A.用冷水贮存白磷 B.用浓硫酸干燥二氧化硫
C.用酒精灯直接加热蒸发皿 D.用二氧化碳灭火器扑灭金属钾的燃烧
2.下列叙述不涉及氧化还原反应的是( )
A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成
3.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )
A.第一电离能:W>X>Y>Z B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z D.氢化物水溶液的酸性:Y>W
4.下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
A.用甲装置制备并收集CO2 B.用乙装置制备溴苯并验证有HBr产生
C.用丙装置制备无水MgCl2 D.用丁装置在铁上镀铜
6.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于calebin A的说法错误的是( )
A.可与FeCl3溶液发生显色反应
B.其酸性水解的产物均可与Na2CO3溶液反应
C.苯环上氢原子发生氯代时,一氯代物有6种
D.1 mol该分子最多与8 mol H2发生加成反应
7.B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )
A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供
C.分子中B和N的杂化方式相同 D.分子中所有原子共平面
8.实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
9.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4ClMgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
10.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用右图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )
A.负极反应为CH3COO-+2H2O-8e-2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列操作不能达到实验目的的是( )
目的
操作
A
除去苯中少量的苯酚
加入适量NaOH溶液,振荡、静置、分液
B
证明酸性:碳酸>苯酚
将盐酸与NaHCO3混合产生的气体直接通入苯酚钠溶液
C
除去碱式滴定管胶管内的气泡
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出
D
配制用于检验醛基的氢氧化铜悬浊液
向试管中加入2 mL 10% NaOH溶液,再滴加数滴2% CuSO4溶液,振荡
12.α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如右图。下列关于α-氰基丙烯酸异丁酯的说法错误的是( )
A.其分子式为C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
13.采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如右图所示。忽略温度变化的影响,下列说法错误的是( )
A.阳极反应为2H2O-4e-4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
14.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如右图所示。已知在0 ℃和40 ℃时,1,2-加成产物与1,4-加成产物的比例分别为70∶30和15∶85。下列说法正确的是( )
A.1,4-加成产物比1,2-加成产物稳定
B.与0 ℃相比,40 ℃时1,3-丁二烯的转化率增大
C.从0 ℃升至40 ℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0 ℃升至40 ℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
15.25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和lgc(OH-)随pH变化的关系如右图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lgKa
C.该体系中,c(CH3COOH)=0.1c(H+)Ka+c(H+) mol·L-1
D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大
三、非选择题:本题共5小题,共60分。
16.(12分)
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
已知:MnO2是一种两性氧化物;25 ℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2与BaS溶液反应转化为MnO的化学方程式为 。?
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。?
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中(填操作单元的名称)。?
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10-5 mol·L-1时,可认为该离子沉淀完全)。?
(5)碳化过程中发生反应的离子方程式为 。?
17.(12分)
CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。?
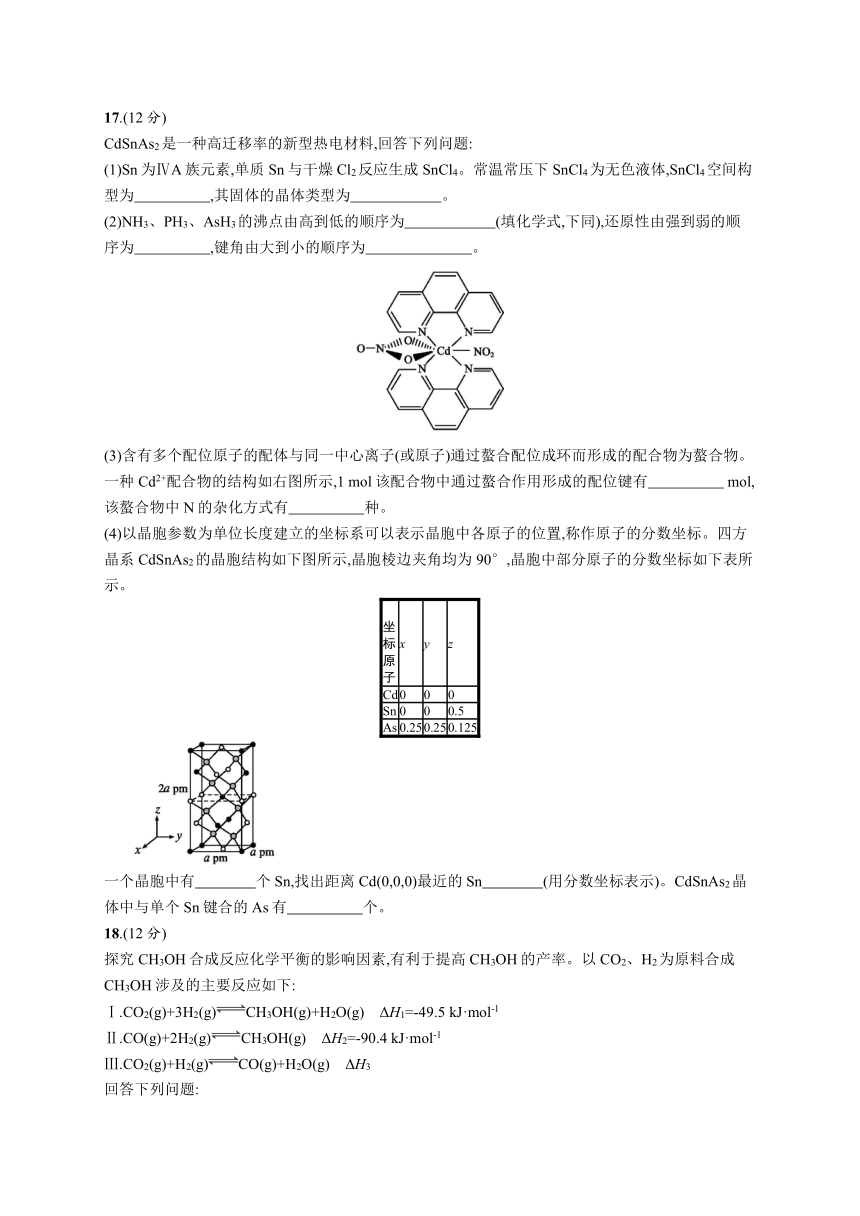
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 (填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。?
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如右图所示,1 mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。?
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn (用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。?
18.(12分)
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
Ⅱ.CO(g)+2H2(g)CH3OH(g) ΔH2=-90.4 kJ·mol-1
Ⅲ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
回答下列问题:
(1)ΔH3= kJ·mol-1。?
(2)一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为 mol·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。?
(3)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=n(CO2)初始-n(CO2)平衡n(CO2)初始×100%
CH3OH的平衡产率=n(CH3OH)平衡n(CO2)初始×100%
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。?
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填标号)。?
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
19.(12分)
化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:
ABCDEF(C10H9NO2)
已知:Ⅰ.
Ⅱ.
Ⅲ.Ar—X+
Ar为芳基;X=Cl,Br;Z或Z'=COR,CONHR,COOR等。
回答下列问题:
(1)实验室制备A的化学方程式为 ,提高A产率的方法是 ;A的某同分异构体只有一种化学环境的碳原子,其结构简式为 。?
(2)C→D的反应类型为 ;E中含氧官能团的名称为 。?
(3)C的结构简式为 ,F的结构简式为 。?
(4)Br2和的反应与Br2和苯酚的反应类似,以和为原料合成,写出能获得更多目标产物的较优合成路线(其他试剂任选)。
20.(12分)
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如右图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42-+2H2O2MnO4-+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。?
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。?
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。?
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75 ℃。用c mol·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30 s内不褪色,消耗KMnO4溶液V1 mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75 ℃继续用KMnO4溶液滴定至溶液出现粉红色且30 s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4·2H2O(M=126 g·mol-1)的质量分数表达式为 。?
下列关于样品组成分析的说法,正确的是 (填标号)。?
A.V1V2=3时,样品中一定不含杂质
B.V1V2越大,样品中H2C2O4·2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
参考答案
2020年化学(山东卷)
1.D 本题考查了实验的基础知识。A项,白磷易自燃,可保存在水中,从而隔绝空气;B项,浓硫酸属于酸性干燥剂;可以干燥SO2;C项,蒸发皿可用酒精灯直接加热;D项,钾在空气中燃烧会生成KO2,KO2能与CO2反应生成O2,因此钾燃烧时不能用CO2扑灭。
2.B 本题考查的内容是“化学与生活”,题目较简单。体现了化学学科核心素养中的“科学态度与社会责任”。A项,谷物发酵酿造食醋的过程是:谷物葡萄糖乙醇乙酸;B项,小苏打做膨松剂是因为小苏打受热分解及能与酸反应放出CO2,发生的是非氧化还原反应;C项,含氯消毒剂给环境消毒是利用了消毒剂的强氧化性,使蛋白质变性;D项,NO2形成酸雨过程中,NO2发生的反应为3NO2+H2O2HNO3+NO,该反应属于氧化还原反应。
3.C X为短周期元素,其电子总数为最高能级电子数的2倍,Z与X可形成淡黄色化合物Z2X2,故X为O元素,其核外电子排布式为1s22s22p4,Z为Na元素。Y与W同主族,Y为F,W为Cl。根据各元素在周期表中的位置关系和递变规律,第一电离能F>O>Cl>Na;离子还原性Cl->O2->F-;简单离子F-、Na+、O2-是电子层结构相同的离子,故离子半径rCl->rO2->rF->rNa+,C项符合题目要求。
4.C 本题立足于核心素养中的“宏观辨识和微观探析”。A项,键长C—CSi—Si、C—H>Si—H,则C2H6的稳定性>Si2H6;B项,金刚石与SiC均属于共价(原子)晶体,具有很高的硬度;C项,C与Si在同一主族,非金属性C>Si,故CH4的还原性弱于SiH4,C项错误;D项,π键是p轨道肩并肩重叠形成的,由于Si的原子半径较大,p轨道重叠程度小,所以Si原子间难以形成双键。
5.C 本题考查化学实验基础。A项,CO2的收集方法错误;B项,由于溴易挥发,挥发出的Br2能与AgNO3反应生成沉淀,会干扰HBr的检验;D项,电镀时,待镀金属作阴极,因此铁应该作阴极,连接电源负极。
6.D 本题考查了有机物官能团的性质。从Calebin A的结构简式可以看出,分子中存在、酮羰基、酚羟基、酯基等官能团,故A、B项正确;在1 mol该物质中有2 mol 、1 mol 、2 mol苯环,故1 mol该分子最多可与9 mol H2发生加成反应,D项错误;该分子结构不对称,在苯环上有6种等效氢原子,故发生氯代反应时,一氯代物有6种,C项正确。
7.A 由题意知,无机苯与苯结构相似,应属于分子晶体,其熔点取决于范德华力,A项错误;分子中所有原子共平面,D项正确;根据价键原理和题干信息,无机苯的结构式为,该分子属于平面形分子,分子中N原子和B原子都属于sp2杂化,N形成4个价键,故大π键的电子全部由N原子提供。
8.A 本题考查了元素及其化合物的性质与实验基本操作。A项,萃取振荡时,分液漏斗上口向下倾斜,故A项错误;分液时,下层液体从下口流出,上层液体从上口倒出,B项正确;根据题意,Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,分液后,水相为无色,说明Al3+与[FeCl4]-已完全分离。
9.B 本题是高中化学学习中非常熟悉的情境,以有关工艺流程为载体考查物质的制备。从流程可知,煅烧MgCO3可生成MgO,加入NH4Cl溶液,由于NH4Cl水解使溶液显酸性,因此会发生反应MgO+2NH4ClMgCl2+2NH3↑+H2O,A项正确;在沉镁过程中加入氨水,由于NH3·H2O易分解,因此该过程不能在较高温度下进行,B项错误;从整个流程中看出,沉镁后的滤液中含有NH4Cl,则可循环利用的物质是NH4Cl和NH3,故C项正确;Mg2+、Al3+、Fe3+的分离是利用了它们氢氧化物的Ksp不同,D项正确。
10.B 本题考查了原电池的工作原理和电极反应式的书写。由图可知,a极变化为CH3COO-CO2,该极的电极反应为CH3COO-+2H2O-8e-2CO2+7H+,a极发生氧化反应,则a极为负极,b极为正极,A项正确;由于可实现海水淡化,结合原电池原理分析,Cl-应移向a极,Na+应移向b极,故隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,B项错误;当转移8 mol e-时,CH3COO-减少1 mol,同时H+增加7 mol,应有8 mol Cl-通过隔膜1,则转移1 mol电子时理论上可除去1 mol NaCl,所以C项正确;工作一段时间后,由于正极反应式为2H++2e-H2↑,故正、负极生成气体的物质的量之比为2∶1,D项正确。
11.BC 本题以“科学探究与创新意识”为测试宗旨,考查选择常见仪器、装置和试剂完成特定实验的设计。A项,苯酚能与NaOH溶液反应生成苯酚钠,苯与NaOH溶液不反应且会分层,然后通过分液进行分离;B项,盐酸易挥发出HCl,HCl能与苯酚钠反应生成苯酚,因而会干扰CO2与苯酚钠的反应,无法验证酸性:H2CO3>苯酚;C项,驱赶碱式滴定管中气泡的正确方法是使尖嘴部分向上弯曲,然后挤压胶管中的玻璃球;D项,配制新制Cu(OH)2悬浊液过程中,由于溶液显碱性,因此,应将CuSO4溶液滴加到2 mL 10%的NaOH溶液中。
12.C 根据α-氰基丙烯酸异丁酯的结构简式可知,其分子式为C8H11NO2,A正确;在其结构简式()中,①号C为sp2杂化,②号碳为sp杂化,③号碳为sp3杂化,B正确;在分子中存在结构,可能共平面的碳原子最多为7个,C错误;D项,根据残基思想,由C8H11NO2-C6H5=C2H6NO2,可知,在—C2H6NO2中不存在不饱和键,则会存在—OH、—NH2、—CH3(或—CH2CH3、—CH2—),所以等效氢原子大于4种。
13.D 本题以“证据推理与模型认知”为测试宗旨,考查了电解池的工作原理及由电解现象进行的一些推断。图中电解池b极一端进入O2生成H2O2,其电极反应式为2H++O2+2e-H2O2,发生还原反应,b极为阴极。同理阳极反应式为2H2O-4e-4H++O2↑,H+由阳极区移向阴极区,A、C项正确。阳极区一段时间后,溶液pH不变;根据电子守恒可知生成的O2和消耗的O2物质的量之比为1∶2,D项错误。
14.AD 本题考查了核心素养中的“变化观念与平衡思想”,要求从原理上认识化学变化的本质和特征。从反应进程图上看,1,2-加成产物的能量高于1,4-加成产物的能量,所以1,4-加成产物稳定,A项正确;1,3-丁二烯与HBr反应转化为1,2-加成产物或1,4-加成产物,所以无法比较0 ℃、40 ℃时1,3-丁二烯转化率的大小,B项错误;C项,升高温度可以增大反应速率,因此1,4-加成反应速率不会减小,C项错误;D项,从0 ℃和40 ℃时1,2-加成产物与1,4-加成产物的比例可以看出,升高温度时,1,2-加成反应明显慢于1,4-加成反应,所以1,2-加成反应的正反应速率增大程度小于其逆反应的增大程度。
15.BC 在CH3COO-、CH3COOH的混合溶液中,随着pH的增大,lgc(CH3COOH)减小,lgc(CH3COO-)增大。当pH=0时,c(H+)=1 mol·L-1,又由于c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,所以c(H+)>c(CH3COOH)>c(CH3COO-)。N点时c(CH3COOH)=c(CH3COO-),Ka=c(H+)c(CH3COO-)c(CH3COOH)=c(H+),pH=-lgc(H+)=-lgKa,B项正确;O点时c(H+)=c(OH-),c(CH3COO-)>c(CH3COOH),该体系中,c(CH3COO-)=0.1 mol·L-1-c(CH3COOH),因为Ka=c(H+)c(CH3COO-)c(CH3COOH)=c(H+)·[0.1-c(CH3COOH)]c(CH3COOH),整理可得,c(CH3COOH)=0.1c(H+)Ka+c(H+) mol·L-1,故A项错误,C项正确;pH从7到14的过程中,存在随c(OH-)增大,CH3COO-+H2OCH3COOH+OH-水解平衡逆向移动的过程,D项错误。
16.答案 (1)增大接触面积,充分反应,提高反应速率 MnO2+BaS+H2OBa(OH)2+MnO+S
(2)过量的MnO2消耗了产生的Ba(OH)2
(3)蒸发
(4)H2O2 4.9
(5)Mn2++HCO3-+NH3·H2OMnCO3↓+NH4++H2O
解析 该题遵循化工生产的过程,对工艺流程的环节与条件进行简化处理,在科学基础上通过最简洁的呈现方式呈现生产过程,并设置问题,避免信息冗长对考生造成思维上的干扰。
(1)软锰矿预先粉碎可以增大接触面积,提高反应速率。根据信息,MnO2与BaS反应转化为MnO,再结合流程图反应后经过过滤、蒸发等一系列物理过程得到Ba(OH)2,过滤后酸解生成硫磺,硫磺不与H2SO4反应,故MnO2与BaS溶液反应的化学方程式为MnO2+BaS+H2OBa(OH)2+MnO+S。
(2)已知MnO2是两性氧化物,保持BaS投料量不变,增大MnO2与BaS的投料比,过量的MnO2能与Ba(OH)2反应,故Ba(OH)2的量达到最大值后会减小。
(3)将滤液Ⅰ导入蒸发装置可循环利用。
(4)根据表中Ksp[Fe(OH)3] (5)碳化过程中发生复分解反应:HCO3-+NH3·H2O+Mn2+MnCO3↓+NH4++H2O。
17.答案 (1)正四面体形 分子晶体
(2)NH3、AsH3、PH3 AsH3、PH3、NH3 NH3、PH3、AsH3
(3)6 1
(4)4 (0.5,0,0.25)、(0.5,0.5,0) 4
解析 本题以高迁移率的新型热电材料为素材,考查晶体结构、分子结构,具有一定的挑战性。
(1)Sn为ⅣA族元素,SnCl4的结构式为,空间构型应为正四面体形。常温常压下为液体,熔点较低,属于分子晶体。
(2)NH3分子间存在氢键,相对分子质量AsH3>PH3,故沸点:NH3>AsH3>PH3。N、P、As同主族,从上到下,原子半径依次增大,非金属性依次减弱,则NH3、PH3、AsH3的还原性依次增强,键角依次减小。
(3)根据配位键形成的条件:一方提供空轨道(图中Cd2+),一方提供孤电子对。由题图可知,1 mol该配合物中通过螯合作用形成6 mol配位键。分子中氮原子均采取sp2杂化。
(4)根据表中坐标Cd(0,0,0),又因为四方晶系的化学式为CdSnAs2,故Cd与Sn原子个数之比为1∶1,一个晶胞中Cd原子的个数为18×8+12×4+1=4,一个晶胞中Sn原子也是4个,Sn应为晶胞中的小白球。距离Cd(0,0,0)最近的Sn为底面和侧面的Sn,其坐标分别为(0.5,0.5,0),(0.5,0,0.25)。
18.答案 (1)+40.9
(2)a+bV b(a+b)(1-a-b)(3-3a-b)
(3)乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响
(4)A
解析 本题利用科研文献中图像、曲线及数据设题,要求考生在陌生情景中进行热力学分析,有一定难度。
(1)根据盖斯定律可得Ⅰ-Ⅱ=Ⅲ,则ΔH3=+40.9 kJ·mol-1。
(2)反应Ⅰ: CO2(g)+3H2(g)CH3OH(g)+H2O(g)
转化/mol x 3x x x
反应Ⅱ: CO(g)+2H2(g)CH3OH(g)
转化/mol a-x 2a-2x a-x
反应Ⅲ: CO2(g)+H2(g)CO(g)+H2O(g)
转化/mol y y y y
n(CO)=y mol-a mol+x mol=b mol,则x+y=a+b。
则c(H2O)=x+yV mol·L-1=a+bV mol·L-1
KⅢ=c(CO)c(H2O)c(CO2)c(H2)=b(a+b)V21-x-yV×3-3x-y-2a+2xV=b(a+b)(1-a-b)(3-3a-b)。
(3)从图乙中看到在T1时,p不同时三条曲线交于一点,说明压强的改变对平衡无影响。而反应Ⅲ前后分子数不变,反应以Ⅲ为主,所以升高温度平衡向正方向移动,CO2的转化率升高。图乙纵坐标表示CO2的平衡转化率,图甲纵坐标表示CH3OH的平衡产率,反应Ⅰ、Ⅱ都是体积减小的反应,增大压强平衡向正反应方向移动,故p1>p2>p3。
(4)由反应的方程式可知,低温、高压可提高CO2的平衡转化率和CH3OH的平衡产率。
19.答案 (1)CH3COOH+CH3CH2OHCH3COOC2H5+H2O 及时蒸出产物(或增大乙酸或乙醇的用量)
(2)取代反应 羰基、酰胺基
(3)CH3COCH2COOH
(4)
解析 本题以合成吲哚-2-酮类药物的一种中间体的合成路线为素材,题目在信息设计、问题设计等各方面都比较合理。根据题干信息Ⅰ很容易推出A。BC的水解反应也是高中常见的反应。CDE的过程需要利用题目中的信息Ⅱ,虽然信息相对陌生,但均为非常明确的取代反应。
(1)根据流程可知AB,根据信息Ⅰ可推出A为乙酸乙酯。乙酸乙酯的某种同分异构体只有一种化学环境的碳原子,说明结构高度对称,从而可写出其结构简式为。
(2)B中存在酯基,在题给条件下水解生成C(),根据信息Ⅱ可知D为,则CD为取代反应。由信息Ⅱ可得E为,E中含氧官能团为羰基和酰胺基。
(3)由以上分析知C的结构简式为CH3COCH2COOH;根据信息Ⅲ可知F的结构简式为。
(4)合成路线设计根据题干信息进行迁移。
20.答案 (1)平衡气压,使浓盐酸顺利滴下 NaOH溶液 Ca(ClO)2+4HClCaCl2+2Cl2↑+2H2O
(2)在装置A、B之间加装盛有饱和食盐水的洗气瓶
(3)酸式 C
(4)0.315c(V1-3V2)m×100% BD
解析 本题考查了物质的制备及定量实验设计。
(1)恒压分液漏斗是同学们熟知的仪器,作用是保持恒压。制备Cl2的化学方程式可根据氧化还原反应的原理写出。
(2)已知锰酸钾在浓强碱溶液中可稳定存在,碱性减弱易发生反应。制备Cl2的浓盐酸挥发出的HCl进入B装置使溶液碱性减弱,K2MnO4会发生反应,从而降低KMnO4的产率,因此应在A、B之间添加除去HCl的洗气瓶。
(3)考查常见仪器滴定管的结构及用法,难度较小。KMnO4溶液应放在酸式滴定管中。滴定管下端无刻度,因此KMnO4溶液的体积大于35.00 mL。
(4)根据题意,在第Ⅱ步反应中KMnO4溶液可氧化Fe2+生成Fe3+。根据得失电子守恒:Fe2+Fe3+、MnO4-Mn2+
n(Fe2+)×1=cV2×10-3×(7-2) mol
n(Fe2+)=5cV2×10-3 mol
在第Ⅰ步反应中KMnO4氧化了FeC2O4·2H2O和H2C2O4·2H2O以及Fe2(C2O4)3中的C2O42-,
该过程涉及的变化有:FeC2O4Fe3++CO2↑
H2C2O4、C2O42-CO2
MnO4-Mn2+
由电子守恒可得5cV2×10-3×3+n(H2C2O4)×2=5cV1×10-3,则:
n(H2C2O4)=5c(V1-3V2)×10-32 mol
H2C2O4·2H2O的质量分数=5c(V1-3V2)×10-3×126 g2mg×100%=0.315c(V1-3V2)m×100%。
根据H2C2O4质量分数的表达式可知,当V1=3V2时,样品中不含H2C2O4·2H2O,但可能含有其他物质。V1V2越大,H2C2O4·2H2O的含量一定越高,B项正确;若步骤Ⅰ滴入KMnO4溶液不足,V1偏低,H2C2O4·2H2O的含量一定偏低,则铁元素含量偏高,C项错误;若所用KMnO4溶液浓度偏低,V1、V2偏大,H2C2O4·2H2O含量偏低,则铁元素含量偏高。
山东省2020年普通高中学业水平等级考试
化学
(本试卷共4页,20题,满分100分,考试用时90分钟)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Fe 56
一、选择题:本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项符合题目要求。
1.实验室中下列做法错误的是( )
A.用冷水贮存白磷 B.用浓硫酸干燥二氧化硫
C.用酒精灯直接加热蒸发皿 D.用二氧化碳灭火器扑灭金属钾的燃烧
2.下列叙述不涉及氧化还原反应的是( )
A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成
3.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )
A.第一电离能:W>X>Y>Z B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z D.氢化物水溶液的酸性:Y>W
4.下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
A.用甲装置制备并收集CO2 B.用乙装置制备溴苯并验证有HBr产生
C.用丙装置制备无水MgCl2 D.用丁装置在铁上镀铜
6.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于calebin A的说法错误的是( )
A.可与FeCl3溶液发生显色反应
B.其酸性水解的产物均可与Na2CO3溶液反应
C.苯环上氢原子发生氯代时,一氯代物有6种
D.1 mol该分子最多与8 mol H2发生加成反应
7.B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )
A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供
C.分子中B和N的杂化方式相同 D.分子中所有原子共平面
8.实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
9.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4ClMgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
10.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用右图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )
A.负极反应为CH3COO-+2H2O-8e-2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列操作不能达到实验目的的是( )
目的
操作
A
除去苯中少量的苯酚
加入适量NaOH溶液,振荡、静置、分液
B
证明酸性:碳酸>苯酚
将盐酸与NaHCO3混合产生的气体直接通入苯酚钠溶液
C
除去碱式滴定管胶管内的气泡
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出
D
配制用于检验醛基的氢氧化铜悬浊液
向试管中加入2 mL 10% NaOH溶液,再滴加数滴2% CuSO4溶液,振荡
12.α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如右图。下列关于α-氰基丙烯酸异丁酯的说法错误的是( )
A.其分子式为C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
13.采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如右图所示。忽略温度变化的影响,下列说法错误的是( )
A.阳极反应为2H2O-4e-4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
14.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如右图所示。已知在0 ℃和40 ℃时,1,2-加成产物与1,4-加成产物的比例分别为70∶30和15∶85。下列说法正确的是( )
A.1,4-加成产物比1,2-加成产物稳定
B.与0 ℃相比,40 ℃时1,3-丁二烯的转化率增大
C.从0 ℃升至40 ℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0 ℃升至40 ℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
15.25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和lgc(OH-)随pH变化的关系如右图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lgKa
C.该体系中,c(CH3COOH)=0.1c(H+)Ka+c(H+) mol·L-1
D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大
三、非选择题:本题共5小题,共60分。
16.(12分)
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
已知:MnO2是一种两性氧化物;25 ℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2与BaS溶液反应转化为MnO的化学方程式为 。?
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。?
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中(填操作单元的名称)。?
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10-5 mol·L-1时,可认为该离子沉淀完全)。?
(5)碳化过程中发生反应的离子方程式为 。?
17.(12分)
CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。?
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 (填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。?
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如右图所示,1 mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。?
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn (用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。?
18.(12分)
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
Ⅱ.CO(g)+2H2(g)CH3OH(g) ΔH2=-90.4 kJ·mol-1
Ⅲ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
回答下列问题:
(1)ΔH3= kJ·mol-1。?
(2)一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为 mol·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。?
(3)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=n(CO2)初始-n(CO2)平衡n(CO2)初始×100%
CH3OH的平衡产率=n(CH3OH)平衡n(CO2)初始×100%
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。?
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填标号)。?
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
19.(12分)
化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:
ABCDEF(C10H9NO2)
已知:Ⅰ.
Ⅱ.
Ⅲ.Ar—X+
Ar为芳基;X=Cl,Br;Z或Z'=COR,CONHR,COOR等。
回答下列问题:
(1)实验室制备A的化学方程式为 ,提高A产率的方法是 ;A的某同分异构体只有一种化学环境的碳原子,其结构简式为 。?
(2)C→D的反应类型为 ;E中含氧官能团的名称为 。?
(3)C的结构简式为 ,F的结构简式为 。?
(4)Br2和的反应与Br2和苯酚的反应类似,以和为原料合成,写出能获得更多目标产物的较优合成路线(其他试剂任选)。
20.(12分)
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如右图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42-+2H2O2MnO4-+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。?
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。?
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。?
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75 ℃。用c mol·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30 s内不褪色,消耗KMnO4溶液V1 mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75 ℃继续用KMnO4溶液滴定至溶液出现粉红色且30 s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4·2H2O(M=126 g·mol-1)的质量分数表达式为 。?
下列关于样品组成分析的说法,正确的是 (填标号)。?
A.V1V2=3时,样品中一定不含杂质
B.V1V2越大,样品中H2C2O4·2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
参考答案
2020年化学(山东卷)
1.D 本题考查了实验的基础知识。A项,白磷易自燃,可保存在水中,从而隔绝空气;B项,浓硫酸属于酸性干燥剂;可以干燥SO2;C项,蒸发皿可用酒精灯直接加热;D项,钾在空气中燃烧会生成KO2,KO2能与CO2反应生成O2,因此钾燃烧时不能用CO2扑灭。
2.B 本题考查的内容是“化学与生活”,题目较简单。体现了化学学科核心素养中的“科学态度与社会责任”。A项,谷物发酵酿造食醋的过程是:谷物葡萄糖乙醇乙酸;B项,小苏打做膨松剂是因为小苏打受热分解及能与酸反应放出CO2,发生的是非氧化还原反应;C项,含氯消毒剂给环境消毒是利用了消毒剂的强氧化性,使蛋白质变性;D项,NO2形成酸雨过程中,NO2发生的反应为3NO2+H2O2HNO3+NO,该反应属于氧化还原反应。
3.C X为短周期元素,其电子总数为最高能级电子数的2倍,Z与X可形成淡黄色化合物Z2X2,故X为O元素,其核外电子排布式为1s22s22p4,Z为Na元素。Y与W同主族,Y为F,W为Cl。根据各元素在周期表中的位置关系和递变规律,第一电离能F>O>Cl>Na;离子还原性Cl->O2->F-;简单离子F-、Na+、O2-是电子层结构相同的离子,故离子半径rCl->rO2->rF->rNa+,C项符合题目要求。
4.C 本题立足于核心素养中的“宏观辨识和微观探析”。A项,键长C—C
5.C 本题考查化学实验基础。A项,CO2的收集方法错误;B项,由于溴易挥发,挥发出的Br2能与AgNO3反应生成沉淀,会干扰HBr的检验;D项,电镀时,待镀金属作阴极,因此铁应该作阴极,连接电源负极。
6.D 本题考查了有机物官能团的性质。从Calebin A的结构简式可以看出,分子中存在、酮羰基、酚羟基、酯基等官能团,故A、B项正确;在1 mol该物质中有2 mol 、1 mol 、2 mol苯环,故1 mol该分子最多可与9 mol H2发生加成反应,D项错误;该分子结构不对称,在苯环上有6种等效氢原子,故发生氯代反应时,一氯代物有6种,C项正确。
7.A 由题意知,无机苯与苯结构相似,应属于分子晶体,其熔点取决于范德华力,A项错误;分子中所有原子共平面,D项正确;根据价键原理和题干信息,无机苯的结构式为,该分子属于平面形分子,分子中N原子和B原子都属于sp2杂化,N形成4个价键,故大π键的电子全部由N原子提供。
8.A 本题考查了元素及其化合物的性质与实验基本操作。A项,萃取振荡时,分液漏斗上口向下倾斜,故A项错误;分液时,下层液体从下口流出,上层液体从上口倒出,B项正确;根据题意,Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,分液后,水相为无色,说明Al3+与[FeCl4]-已完全分离。
9.B 本题是高中化学学习中非常熟悉的情境,以有关工艺流程为载体考查物质的制备。从流程可知,煅烧MgCO3可生成MgO,加入NH4Cl溶液,由于NH4Cl水解使溶液显酸性,因此会发生反应MgO+2NH4ClMgCl2+2NH3↑+H2O,A项正确;在沉镁过程中加入氨水,由于NH3·H2O易分解,因此该过程不能在较高温度下进行,B项错误;从整个流程中看出,沉镁后的滤液中含有NH4Cl,则可循环利用的物质是NH4Cl和NH3,故C项正确;Mg2+、Al3+、Fe3+的分离是利用了它们氢氧化物的Ksp不同,D项正确。
10.B 本题考查了原电池的工作原理和电极反应式的书写。由图可知,a极变化为CH3COO-CO2,该极的电极反应为CH3COO-+2H2O-8e-2CO2+7H+,a极发生氧化反应,则a极为负极,b极为正极,A项正确;由于可实现海水淡化,结合原电池原理分析,Cl-应移向a极,Na+应移向b极,故隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,B项错误;当转移8 mol e-时,CH3COO-减少1 mol,同时H+增加7 mol,应有8 mol Cl-通过隔膜1,则转移1 mol电子时理论上可除去1 mol NaCl,所以C项正确;工作一段时间后,由于正极反应式为2H++2e-H2↑,故正、负极生成气体的物质的量之比为2∶1,D项正确。
11.BC 本题以“科学探究与创新意识”为测试宗旨,考查选择常见仪器、装置和试剂完成特定实验的设计。A项,苯酚能与NaOH溶液反应生成苯酚钠,苯与NaOH溶液不反应且会分层,然后通过分液进行分离;B项,盐酸易挥发出HCl,HCl能与苯酚钠反应生成苯酚,因而会干扰CO2与苯酚钠的反应,无法验证酸性:H2CO3>苯酚;C项,驱赶碱式滴定管中气泡的正确方法是使尖嘴部分向上弯曲,然后挤压胶管中的玻璃球;D项,配制新制Cu(OH)2悬浊液过程中,由于溶液显碱性,因此,应将CuSO4溶液滴加到2 mL 10%的NaOH溶液中。
12.C 根据α-氰基丙烯酸异丁酯的结构简式可知,其分子式为C8H11NO2,A正确;在其结构简式()中,①号C为sp2杂化,②号碳为sp杂化,③号碳为sp3杂化,B正确;在分子中存在结构,可能共平面的碳原子最多为7个,C错误;D项,根据残基思想,由C8H11NO2-C6H5=C2H6NO2,可知,在—C2H6NO2中不存在不饱和键,则会存在—OH、—NH2、—CH3(或—CH2CH3、—CH2—),所以等效氢原子大于4种。
13.D 本题以“证据推理与模型认知”为测试宗旨,考查了电解池的工作原理及由电解现象进行的一些推断。图中电解池b极一端进入O2生成H2O2,其电极反应式为2H++O2+2e-H2O2,发生还原反应,b极为阴极。同理阳极反应式为2H2O-4e-4H++O2↑,H+由阳极区移向阴极区,A、C项正确。阳极区一段时间后,溶液pH不变;根据电子守恒可知生成的O2和消耗的O2物质的量之比为1∶2,D项错误。
14.AD 本题考查了核心素养中的“变化观念与平衡思想”,要求从原理上认识化学变化的本质和特征。从反应进程图上看,1,2-加成产物的能量高于1,4-加成产物的能量,所以1,4-加成产物稳定,A项正确;1,3-丁二烯与HBr反应转化为1,2-加成产物或1,4-加成产物,所以无法比较0 ℃、40 ℃时1,3-丁二烯转化率的大小,B项错误;C项,升高温度可以增大反应速率,因此1,4-加成反应速率不会减小,C项错误;D项,从0 ℃和40 ℃时1,2-加成产物与1,4-加成产物的比例可以看出,升高温度时,1,2-加成反应明显慢于1,4-加成反应,所以1,2-加成反应的正反应速率增大程度小于其逆反应的增大程度。
15.BC 在CH3COO-、CH3COOH的混合溶液中,随着pH的增大,lgc(CH3COOH)减小,lgc(CH3COO-)增大。当pH=0时,c(H+)=1 mol·L-1,又由于c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,所以c(H+)>c(CH3COOH)>c(CH3COO-)。N点时c(CH3COOH)=c(CH3COO-),Ka=c(H+)c(CH3COO-)c(CH3COOH)=c(H+),pH=-lgc(H+)=-lgKa,B项正确;O点时c(H+)=c(OH-),c(CH3COO-)>c(CH3COOH),该体系中,c(CH3COO-)=0.1 mol·L-1-c(CH3COOH),因为Ka=c(H+)c(CH3COO-)c(CH3COOH)=c(H+)·[0.1-c(CH3COOH)]c(CH3COOH),整理可得,c(CH3COOH)=0.1c(H+)Ka+c(H+) mol·L-1,故A项错误,C项正确;pH从7到14的过程中,存在随c(OH-)增大,CH3COO-+H2OCH3COOH+OH-水解平衡逆向移动的过程,D项错误。
16.答案 (1)增大接触面积,充分反应,提高反应速率 MnO2+BaS+H2OBa(OH)2+MnO+S
(2)过量的MnO2消耗了产生的Ba(OH)2
(3)蒸发
(4)H2O2 4.9
(5)Mn2++HCO3-+NH3·H2OMnCO3↓+NH4++H2O
解析 该题遵循化工生产的过程,对工艺流程的环节与条件进行简化处理,在科学基础上通过最简洁的呈现方式呈现生产过程,并设置问题,避免信息冗长对考生造成思维上的干扰。
(1)软锰矿预先粉碎可以增大接触面积,提高反应速率。根据信息,MnO2与BaS反应转化为MnO,再结合流程图反应后经过过滤、蒸发等一系列物理过程得到Ba(OH)2,过滤后酸解生成硫磺,硫磺不与H2SO4反应,故MnO2与BaS溶液反应的化学方程式为MnO2+BaS+H2OBa(OH)2+MnO+S。
(2)已知MnO2是两性氧化物,保持BaS投料量不变,增大MnO2与BaS的投料比,过量的MnO2能与Ba(OH)2反应,故Ba(OH)2的量达到最大值后会减小。
(3)将滤液Ⅰ导入蒸发装置可循环利用。
(4)根据表中Ksp[Fe(OH)3]
17.答案 (1)正四面体形 分子晶体
(2)NH3、AsH3、PH3 AsH3、PH3、NH3 NH3、PH3、AsH3
(3)6 1
(4)4 (0.5,0,0.25)、(0.5,0.5,0) 4
解析 本题以高迁移率的新型热电材料为素材,考查晶体结构、分子结构,具有一定的挑战性。
(1)Sn为ⅣA族元素,SnCl4的结构式为,空间构型应为正四面体形。常温常压下为液体,熔点较低,属于分子晶体。
(2)NH3分子间存在氢键,相对分子质量AsH3>PH3,故沸点:NH3>AsH3>PH3。N、P、As同主族,从上到下,原子半径依次增大,非金属性依次减弱,则NH3、PH3、AsH3的还原性依次增强,键角依次减小。
(3)根据配位键形成的条件:一方提供空轨道(图中Cd2+),一方提供孤电子对。由题图可知,1 mol该配合物中通过螯合作用形成6 mol配位键。分子中氮原子均采取sp2杂化。
(4)根据表中坐标Cd(0,0,0),又因为四方晶系的化学式为CdSnAs2,故Cd与Sn原子个数之比为1∶1,一个晶胞中Cd原子的个数为18×8+12×4+1=4,一个晶胞中Sn原子也是4个,Sn应为晶胞中的小白球。距离Cd(0,0,0)最近的Sn为底面和侧面的Sn,其坐标分别为(0.5,0.5,0),(0.5,0,0.25)。
18.答案 (1)+40.9
(2)a+bV b(a+b)(1-a-b)(3-3a-b)
(3)乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响
(4)A
解析 本题利用科研文献中图像、曲线及数据设题,要求考生在陌生情景中进行热力学分析,有一定难度。
(1)根据盖斯定律可得Ⅰ-Ⅱ=Ⅲ,则ΔH3=+40.9 kJ·mol-1。
(2)反应Ⅰ: CO2(g)+3H2(g)CH3OH(g)+H2O(g)
转化/mol x 3x x x
反应Ⅱ: CO(g)+2H2(g)CH3OH(g)
转化/mol a-x 2a-2x a-x
反应Ⅲ: CO2(g)+H2(g)CO(g)+H2O(g)
转化/mol y y y y
n(CO)=y mol-a mol+x mol=b mol,则x+y=a+b。
则c(H2O)=x+yV mol·L-1=a+bV mol·L-1
KⅢ=c(CO)c(H2O)c(CO2)c(H2)=b(a+b)V21-x-yV×3-3x-y-2a+2xV=b(a+b)(1-a-b)(3-3a-b)。
(3)从图乙中看到在T1时,p不同时三条曲线交于一点,说明压强的改变对平衡无影响。而反应Ⅲ前后分子数不变,反应以Ⅲ为主,所以升高温度平衡向正方向移动,CO2的转化率升高。图乙纵坐标表示CO2的平衡转化率,图甲纵坐标表示CH3OH的平衡产率,反应Ⅰ、Ⅱ都是体积减小的反应,增大压强平衡向正反应方向移动,故p1>p2>p3。
(4)由反应的方程式可知,低温、高压可提高CO2的平衡转化率和CH3OH的平衡产率。
19.答案 (1)CH3COOH+CH3CH2OHCH3COOC2H5+H2O 及时蒸出产物(或增大乙酸或乙醇的用量)
(2)取代反应 羰基、酰胺基
(3)CH3COCH2COOH
(4)
解析 本题以合成吲哚-2-酮类药物的一种中间体的合成路线为素材,题目在信息设计、问题设计等各方面都比较合理。根据题干信息Ⅰ很容易推出A。BC的水解反应也是高中常见的反应。CDE的过程需要利用题目中的信息Ⅱ,虽然信息相对陌生,但均为非常明确的取代反应。
(1)根据流程可知AB,根据信息Ⅰ可推出A为乙酸乙酯。乙酸乙酯的某种同分异构体只有一种化学环境的碳原子,说明结构高度对称,从而可写出其结构简式为。
(2)B中存在酯基,在题给条件下水解生成C(),根据信息Ⅱ可知D为,则CD为取代反应。由信息Ⅱ可得E为,E中含氧官能团为羰基和酰胺基。
(3)由以上分析知C的结构简式为CH3COCH2COOH;根据信息Ⅲ可知F的结构简式为。
(4)合成路线设计根据题干信息进行迁移。
20.答案 (1)平衡气压,使浓盐酸顺利滴下 NaOH溶液 Ca(ClO)2+4HClCaCl2+2Cl2↑+2H2O
(2)在装置A、B之间加装盛有饱和食盐水的洗气瓶
(3)酸式 C
(4)0.315c(V1-3V2)m×100% BD
解析 本题考查了物质的制备及定量实验设计。
(1)恒压分液漏斗是同学们熟知的仪器,作用是保持恒压。制备Cl2的化学方程式可根据氧化还原反应的原理写出。
(2)已知锰酸钾在浓强碱溶液中可稳定存在,碱性减弱易发生反应。制备Cl2的浓盐酸挥发出的HCl进入B装置使溶液碱性减弱,K2MnO4会发生反应,从而降低KMnO4的产率,因此应在A、B之间添加除去HCl的洗气瓶。
(3)考查常见仪器滴定管的结构及用法,难度较小。KMnO4溶液应放在酸式滴定管中。滴定管下端无刻度,因此KMnO4溶液的体积大于35.00 mL。
(4)根据题意,在第Ⅱ步反应中KMnO4溶液可氧化Fe2+生成Fe3+。根据得失电子守恒:Fe2+Fe3+、MnO4-Mn2+
n(Fe2+)×1=cV2×10-3×(7-2) mol
n(Fe2+)=5cV2×10-3 mol
在第Ⅰ步反应中KMnO4氧化了FeC2O4·2H2O和H2C2O4·2H2O以及Fe2(C2O4)3中的C2O42-,
该过程涉及的变化有:FeC2O4Fe3++CO2↑
H2C2O4、C2O42-CO2
MnO4-Mn2+
由电子守恒可得5cV2×10-3×3+n(H2C2O4)×2=5cV1×10-3,则:
n(H2C2O4)=5c(V1-3V2)×10-32 mol
H2C2O4·2H2O的质量分数=5c(V1-3V2)×10-3×126 g2mg×100%=0.315c(V1-3V2)m×100%。
根据H2C2O4质量分数的表达式可知,当V1=3V2时,样品中不含H2C2O4·2H2O,但可能含有其他物质。V1V2越大,H2C2O4·2H2O的含量一定越高,B项正确;若步骤Ⅰ滴入KMnO4溶液不足,V1偏低,H2C2O4·2H2O的含量一定偏低,则铁元素含量偏高,C项错误;若所用KMnO4溶液浓度偏低,V1、V2偏大,H2C2O4·2H2O含量偏低,则铁元素含量偏高。
同课章节目录
