高二化学苏教版(2019)选择性必修1:专题三第三单元盐类的水解期末复习练 含答案
文档属性
| 名称 | 高二化学苏教版(2019)选择性必修1:专题三第三单元盐类的水解期末复习练 含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 281.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-08 14:57:36 | ||
图片预览



文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
高二上学期化学苏教版(2019)选择性必修1:专题三第三单元盐类的水解期末复习练
一、单选题
1.下列各式中属于正确的水解反应离子方程式的是(
)
A.
B.
C.
D.
2.下列各组溶液混合后,溶液显碱性的是(
)
A.10
mL
0.1
mol·L-1
NH3·H2O与10
mL
0.1
mol·L-1
HCl
B.10
mL
0.1
mol·L-1
K2S与10
mL
0.1
mol·L-1
K2SO4
C.10
mL
0.1
mol·L-1
KOH与10
mL
0.1
mol·L-1
KHCO3,再加入10
mL
0.1
mol·L-1
BaCl2
D.10
mL
0.1
mol·L-1
NaOH与5
mL
0.1
mol·L-1
H2SO4
3.常温下,0.1mol/L的氯化铵溶液中,离子浓度最大的是
A.Cl-
B.OH-
C.H+
D.NH
4.将醋酸钠饱和溶液加热
A.碱性增强
B.碱性不变
C.pH不变
D.碱性变弱
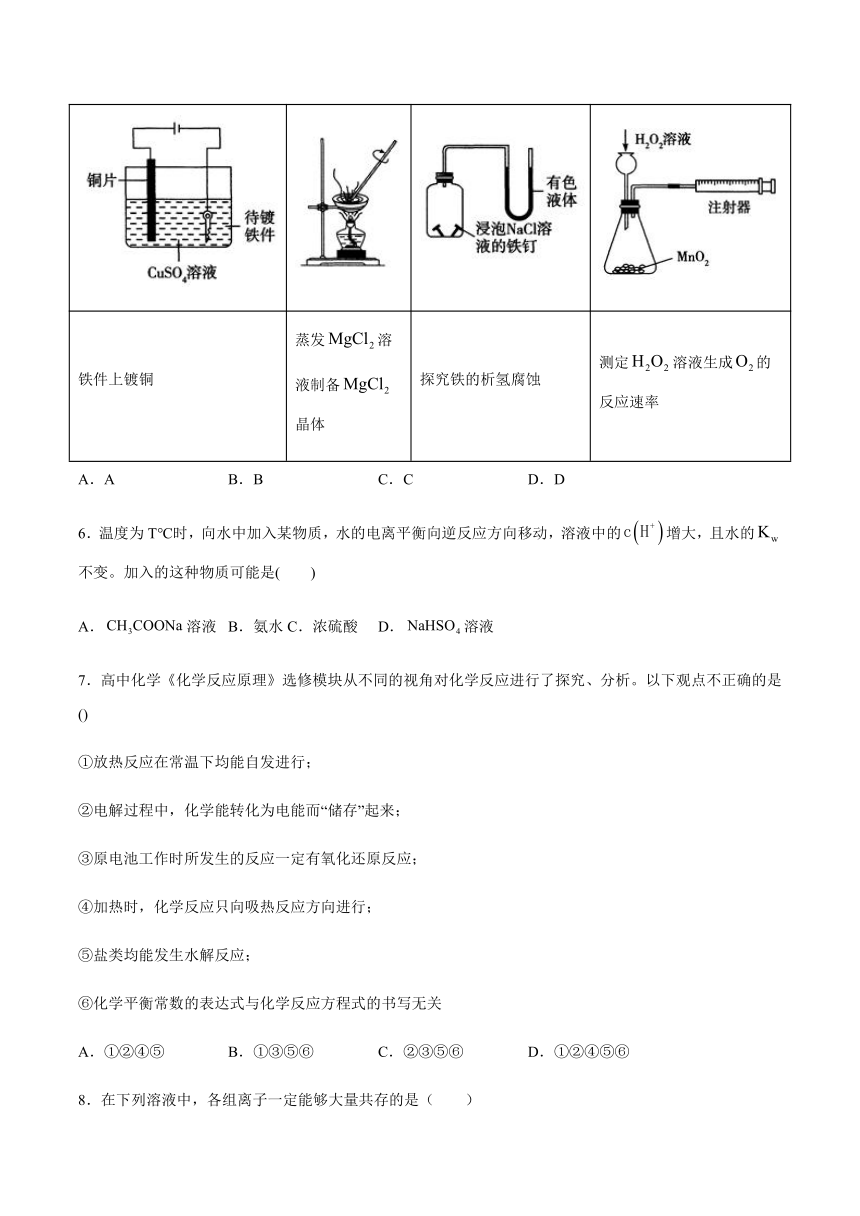
5.下列实验装置设计完全正确且能达到目的的是(
)
A
B
C
D
铁件上镀铜
蒸发溶液制备晶体
探究铁的析氢腐蚀
测定溶液生成的反应速率
A.A
B.B
C.C
D.D
6.温度为T℃时,向水中加入某物质,水的电离平衡向逆反应方向移动,溶液中的增大,且水的不变。加入的这种物质可能是(
)
A.溶液
B.氨水C.浓硫酸
D.溶液
7.高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点不正确的是()
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;
⑥化学平衡常数的表达式与化学反应方程式的书写无关
A.①②④⑤
B.①③⑤⑥
C.②③⑤⑥
D.①②④⑤⑥
8.在下列溶液中,各组离子一定能够大量共存的是(
)
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下=1012的溶液:Fe2+、Mg2+、NO、Cl-
C.含有大量Al3+的溶液:Na+、Cl-、AlO、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO、S2-、SO
9.下列溶液中有关物质的量浓度关系不正确的是(
)
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.常温时pH=2的HA溶液与pH=12的MOH溶液任意比混合都有c(H+)+c(M+)=c(OH-)+c(A-)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol/L的NaHA溶液pH=4:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)
10.下列说法正确的是(
)
A.用广泛pH试纸测得某河水的pH为6.2
B.常温下,同浓度的Na2S溶液与NaHS溶液相比,Na2S溶液的pH大
C.用待测液润洗锥形瓶后才能进行滴定操作
D.某雨水样品采集后放置一段时间,pH由4.6变为4.2,是因为溶液中的SO水解
11.常温时,下列关于溶液的说法正确的是(
)
A.溶液中存在电离平衡:
?NH+Cl-
B.加水稀释,溶液中所有离子的浓度均减小
C.通入少量气体,与均增大
D.通入少量气体,增大
12.下列说法正确的是(
)
A.一定温度时,的纯水中,
B.的电离方程式为+H2O?H2CO3+OH-
C.铁制自来水管与铜制水龙头连接会加快水龙头的锈蚀
D.醋酸溶液在稀释时的电离程度增大,溶液的导电性增强
13.化学与生活、生产、学习密切相关,下列有关物质的应用与水解无关的是(
)
A.用热的纯碱溶液洗涤厨具
B.向豆浆中滴加卤水制豆腐
C.向沸水中滴加饱和溶液制备胶体
D.向天然水中加适量明矾达到净水的目的
14.用NA表示阿伏加德罗常数,下列叙述中正确的是()
A.标准状况下,22.4L的CHCl3中含有的氯原子数目为2NA
B.向恒容密闭容器中充入2molNO和1molO2充分反应后容器中的分子总数一定是2NA
C.1L的硫酸铝溶液中,c()=1.5amo1/L,则Al3+数目为aNA
D.用惰性电极电解100mL
0.1mol/L的硫酸铜溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数目为0.04NA
15.常温下,下列离子在指定溶液中能大量共存的是()
A.澄清透明的溶液中Na+、Cu2+、、Cl-
B.中性溶液中Fe3+、Br-、、
C.
c(OH-)<的溶液:Na+、ClO-、Ca2+、F-
D.1mo1/L的KNO3溶液中:H+、Fe2+、SCN-、
二、解答题
16.(1)丙烷通过脱氢反应可得丙烯。
则相同条件下,反应的______。
(2)一定条件下,当1
molO2反应时放出15.6
kJ热量,健键能243
kJ/mol,O=O键键能498
kJ/mol,则断裂1
mol
H-O键与断裂1
molH-Cl键所需能量差为______kJ。
(3)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)
______填“”或“”,原因是______
用离子方程式和必要的文字说明。
(4)已知:时,0.1
mol/L的HA溶液中:
①HA是______填“强电解质”或“弱电解质”。
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是______(填字用)。
A.
B.
C.与
的乘积
D.
③若M溶液是由上述HA溶液V1
mL与的NaOH溶液V2
mL混合充分反应而得,则下列说法中正确的是______。
A.若溶液M呈由性,则溶液M中
B.若,则溶液M的pH也一定等于7
C.若溶液M呈酸性,一定大于
D.若溶液M呈碱性,一定小于
(5)在下,将a
mol/L的氨水与0.01
mol/L的盐酸等体积混合,反应平衡时溶液中,则溶液显______
填“酸”、“碱”或“中”性,用含a的代数式表示的电离常数Kb=______。
(6)常温下,0.1
mol/LCH3COONa溶液的pH为9;则由水电离出的c(H+)=______。
(7)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m______n(填>、<、=)。
(8)已知:在水中分两步电离,常温时的电离常数分别为,,计算常温时,0.1
mol/L的溶液中的水解常数(忽略第二步水解)Kb=______,溶液的pH=______。
17.以煤为原料的化工原料气中含有CO、氧硫化碳(COS)等有毒气体,它们能使催化剂中毒和大气污染。使用这样的原料气时需要进行净化处理。
I.?CO的处理。硝酸的工业尾气中含有大量的氮氧化物,在一定条件下用氮氧化物处理CO能使有毒气体都变为环境友好型物质。已知有下列反应:
①2CO(g)+O2(g)=2CO2(g)
△H=-566?kJ/mol
②N2(g)+O2(g)=2NO(g)
△H=+181?kJ/mol
(1)请写出用NO处理CO反应的热化学方程式____________。下列措施中能够增大该反应有毒气体平衡转化率的是__________(填字母标号)。
a
增大反应体系的压强
b
使用优质催化剂
c
适当降低温度
d
增大NO的浓度
II.氧硫化碳(COS)的脱硫处理。在一定条件下用水蒸气与氧硫化碳反应是常用的脱硫方法,其热化学方程式为:COS(g)+H2O(g)H2S(g)+CO2(g)?△H=-?35?kJ/mol
(2)向容积为2
L的密闭容器中加人等物质的量的水蒸气和氧硫化碳,在一定条件发生上述脱硫反应,测得一定时间内COS(g)和CO2(g)的物质的量变化如下表所示:
物质的量/mol
T1/℃
T2/℃
0min
5min
10min
15min
20min
25min
30min
COS(g)
2.0
1.16
0.80
0.80
0.50
0.40
0.40
CO2(g)
0
0.84
1.20
1.20
1.50
1.60
1.60
①0~5?min内以COS(g)表示的反应速率v(COS)=________mol/(L·min)。
②由表中数据变化判断T1_____T2(填“>”、“<"或“=”)。
③若30
min时,保持T2℃不变,向该容器中再加入该反应的四种物质各2
mol,则此时化学平衡______移动(?填"向正反应方向”、“向逆反应方向”或“不")。
(3)实验测得:v正=k正·c(COS)·c(H2O),v逆=k逆c(H2S)·c(CO2)(k正、k逆为速率常数,只与温度有关)。若在2?L的密闭容器中充入1?mol?COS和1?mol?H2O,?在T2℃温度下达到平衡时,k正:k逆=_________。
(4)脱硫反应生成的H2S(g)经分离提纯后通入氢氧化钠溶液中可制得常用的化工原料。若测得H2S通入NaOH溶液所得的溶液中存在浓度关系:c(Na+)=c(S2-)+c(HS-)+c(H2S),则该溶液的溶质主要是__________。
18.工业上用绿矾制取还原性铁粉的简单工艺流程如下:
(1)绿矾用酸浸而不用水浸的原因是____;转化过程中为了加快转化速率,需适当加热,但是温度不宜过高的原因是____。
(2)干燥过程是为了脱去沉淀FeCO3?nH2O表面的水和结晶水,该过程会产生一种杂质FeO(OH),写出化学方程式:____;为了避免干燥过程中生成FeO(OH),正确操作是____。
(3)下图是焙烧过程中加CaCO3与未加CaCO3的铁粉产率变化图,请分析加入CaCO3导致铁粉产率提高的原因:____。
(4)还原性铁粉中含有少量的FexC,用下列装置通过检测CO2来测定还原性铁粉中碳的含量,则各装置的连接顺序为____。
试卷第1页,总3页
参考答案
1.A2.B3.A4.A5.A6.D7.D8.A9.A10.B11.C12.A13.B14.D15.A
16.+124.2
kJ/mol
7.6
>
因为溶液中既存在电离平衡:,又存在水解平衡:,而水解程度大于电离程度
弱电解质
B
AD
中
>
11.7
17.2CO(g)+2NO(g)N2(g)+2CO2(g)?△H=-747?kJ/mol
a
c
0.084
>
向正反应方向
16
NaHS或硫氢化钠
18.H+可抑制Fe2+水解,防止铁的流失及引入新的杂质
温度过高会导致原料(NH4)2CO3的分解
4FeCO3?nH2O
+
O2
=
4FeO(OH)
+
4CO2
+
(4n﹣2)H2O
在隔绝空气环境下操作,防止有少量FeCO3?nH2O被空气氧化
高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以加入碳酸钙能增加一氧化碳的含量,则还原性铁粉的产率增大
ABCBB
答案第1页,总2页
高二上学期化学苏教版(2019)选择性必修1:专题三第三单元盐类的水解期末复习练
一、单选题
1.下列各式中属于正确的水解反应离子方程式的是(
)
A.
B.
C.
D.
2.下列各组溶液混合后,溶液显碱性的是(
)
A.10
mL
0.1
mol·L-1
NH3·H2O与10
mL
0.1
mol·L-1
HCl
B.10
mL
0.1
mol·L-1
K2S与10
mL
0.1
mol·L-1
K2SO4
C.10
mL
0.1
mol·L-1
KOH与10
mL
0.1
mol·L-1
KHCO3,再加入10
mL
0.1
mol·L-1
BaCl2
D.10
mL
0.1
mol·L-1
NaOH与5
mL
0.1
mol·L-1
H2SO4
3.常温下,0.1mol/L的氯化铵溶液中,离子浓度最大的是
A.Cl-
B.OH-
C.H+
D.NH
4.将醋酸钠饱和溶液加热
A.碱性增强
B.碱性不变
C.pH不变
D.碱性变弱
5.下列实验装置设计完全正确且能达到目的的是(
)
A
B
C
D
铁件上镀铜
蒸发溶液制备晶体
探究铁的析氢腐蚀
测定溶液生成的反应速率
A.A
B.B
C.C
D.D
6.温度为T℃时,向水中加入某物质,水的电离平衡向逆反应方向移动,溶液中的增大,且水的不变。加入的这种物质可能是(
)
A.溶液
B.氨水C.浓硫酸
D.溶液
7.高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点不正确的是()
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;
⑥化学平衡常数的表达式与化学反应方程式的书写无关
A.①②④⑤
B.①③⑤⑥
C.②③⑤⑥
D.①②④⑤⑥
8.在下列溶液中,各组离子一定能够大量共存的是(
)
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下=1012的溶液:Fe2+、Mg2+、NO、Cl-
C.含有大量Al3+的溶液:Na+、Cl-、AlO、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO、S2-、SO
9.下列溶液中有关物质的量浓度关系不正确的是(
)
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.常温时pH=2的HA溶液与pH=12的MOH溶液任意比混合都有c(H+)+c(M+)=c(OH-)+c(A-)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol/L的NaHA溶液pH=4:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)
10.下列说法正确的是(
)
A.用广泛pH试纸测得某河水的pH为6.2
B.常温下,同浓度的Na2S溶液与NaHS溶液相比,Na2S溶液的pH大
C.用待测液润洗锥形瓶后才能进行滴定操作
D.某雨水样品采集后放置一段时间,pH由4.6变为4.2,是因为溶液中的SO水解
11.常温时,下列关于溶液的说法正确的是(
)
A.溶液中存在电离平衡:
?NH+Cl-
B.加水稀释,溶液中所有离子的浓度均减小
C.通入少量气体,与均增大
D.通入少量气体,增大
12.下列说法正确的是(
)
A.一定温度时,的纯水中,
B.的电离方程式为+H2O?H2CO3+OH-
C.铁制自来水管与铜制水龙头连接会加快水龙头的锈蚀
D.醋酸溶液在稀释时的电离程度增大,溶液的导电性增强
13.化学与生活、生产、学习密切相关,下列有关物质的应用与水解无关的是(
)
A.用热的纯碱溶液洗涤厨具
B.向豆浆中滴加卤水制豆腐
C.向沸水中滴加饱和溶液制备胶体
D.向天然水中加适量明矾达到净水的目的
14.用NA表示阿伏加德罗常数,下列叙述中正确的是()
A.标准状况下,22.4L的CHCl3中含有的氯原子数目为2NA
B.向恒容密闭容器中充入2molNO和1molO2充分反应后容器中的分子总数一定是2NA
C.1L的硫酸铝溶液中,c()=1.5amo1/L,则Al3+数目为aNA
D.用惰性电极电解100mL
0.1mol/L的硫酸铜溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数目为0.04NA
15.常温下,下列离子在指定溶液中能大量共存的是()
A.澄清透明的溶液中Na+、Cu2+、、Cl-
B.中性溶液中Fe3+、Br-、、
C.
c(OH-)<的溶液:Na+、ClO-、Ca2+、F-
D.1mo1/L的KNO3溶液中:H+、Fe2+、SCN-、
二、解答题
16.(1)丙烷通过脱氢反应可得丙烯。
则相同条件下,反应的______。
(2)一定条件下,当1
molO2反应时放出15.6
kJ热量,健键能243
kJ/mol,O=O键键能498
kJ/mol,则断裂1
mol
H-O键与断裂1
molH-Cl键所需能量差为______kJ。
(3)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)
______填“”或“”,原因是______
用离子方程式和必要的文字说明。
(4)已知:时,0.1
mol/L的HA溶液中:
①HA是______填“强电解质”或“弱电解质”。
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是______(填字用)。
A.
B.
C.与
的乘积
D.
③若M溶液是由上述HA溶液V1
mL与的NaOH溶液V2
mL混合充分反应而得,则下列说法中正确的是______。
A.若溶液M呈由性,则溶液M中
B.若,则溶液M的pH也一定等于7
C.若溶液M呈酸性,一定大于
D.若溶液M呈碱性,一定小于
(5)在下,将a
mol/L的氨水与0.01
mol/L的盐酸等体积混合,反应平衡时溶液中,则溶液显______
填“酸”、“碱”或“中”性,用含a的代数式表示的电离常数Kb=______。
(6)常温下,0.1
mol/LCH3COONa溶液的pH为9;则由水电离出的c(H+)=______。
(7)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m______n(填>、<、=)。
(8)已知:在水中分两步电离,常温时的电离常数分别为,,计算常温时,0.1
mol/L的溶液中的水解常数(忽略第二步水解)Kb=______,溶液的pH=______。
17.以煤为原料的化工原料气中含有CO、氧硫化碳(COS)等有毒气体,它们能使催化剂中毒和大气污染。使用这样的原料气时需要进行净化处理。
I.?CO的处理。硝酸的工业尾气中含有大量的氮氧化物,在一定条件下用氮氧化物处理CO能使有毒气体都变为环境友好型物质。已知有下列反应:
①2CO(g)+O2(g)=2CO2(g)
△H=-566?kJ/mol
②N2(g)+O2(g)=2NO(g)
△H=+181?kJ/mol
(1)请写出用NO处理CO反应的热化学方程式____________。下列措施中能够增大该反应有毒气体平衡转化率的是__________(填字母标号)。
a
增大反应体系的压强
b
使用优质催化剂
c
适当降低温度
d
增大NO的浓度
II.氧硫化碳(COS)的脱硫处理。在一定条件下用水蒸气与氧硫化碳反应是常用的脱硫方法,其热化学方程式为:COS(g)+H2O(g)H2S(g)+CO2(g)?△H=-?35?kJ/mol
(2)向容积为2
L的密闭容器中加人等物质的量的水蒸气和氧硫化碳,在一定条件发生上述脱硫反应,测得一定时间内COS(g)和CO2(g)的物质的量变化如下表所示:
物质的量/mol
T1/℃
T2/℃
0min
5min
10min
15min
20min
25min
30min
COS(g)
2.0
1.16
0.80
0.80
0.50
0.40
0.40
CO2(g)
0
0.84
1.20
1.20
1.50
1.60
1.60
①0~5?min内以COS(g)表示的反应速率v(COS)=________mol/(L·min)。
②由表中数据变化判断T1_____T2(填“>”、“<"或“=”)。
③若30
min时,保持T2℃不变,向该容器中再加入该反应的四种物质各2
mol,则此时化学平衡______移动(?填"向正反应方向”、“向逆反应方向”或“不")。
(3)实验测得:v正=k正·c(COS)·c(H2O),v逆=k逆c(H2S)·c(CO2)(k正、k逆为速率常数,只与温度有关)。若在2?L的密闭容器中充入1?mol?COS和1?mol?H2O,?在T2℃温度下达到平衡时,k正:k逆=_________。
(4)脱硫反应生成的H2S(g)经分离提纯后通入氢氧化钠溶液中可制得常用的化工原料。若测得H2S通入NaOH溶液所得的溶液中存在浓度关系:c(Na+)=c(S2-)+c(HS-)+c(H2S),则该溶液的溶质主要是__________。
18.工业上用绿矾制取还原性铁粉的简单工艺流程如下:
(1)绿矾用酸浸而不用水浸的原因是____;转化过程中为了加快转化速率,需适当加热,但是温度不宜过高的原因是____。
(2)干燥过程是为了脱去沉淀FeCO3?nH2O表面的水和结晶水,该过程会产生一种杂质FeO(OH),写出化学方程式:____;为了避免干燥过程中生成FeO(OH),正确操作是____。
(3)下图是焙烧过程中加CaCO3与未加CaCO3的铁粉产率变化图,请分析加入CaCO3导致铁粉产率提高的原因:____。
(4)还原性铁粉中含有少量的FexC,用下列装置通过检测CO2来测定还原性铁粉中碳的含量,则各装置的连接顺序为____。
试卷第1页,总3页
参考答案
1.A2.B3.A4.A5.A6.D7.D8.A9.A10.B11.C12.A13.B14.D15.A
16.+124.2
kJ/mol
7.6
>
因为溶液中既存在电离平衡:,又存在水解平衡:,而水解程度大于电离程度
弱电解质
B
AD
中
>
11.7
17.2CO(g)+2NO(g)N2(g)+2CO2(g)?△H=-747?kJ/mol
a
c
0.084
>
向正反应方向
16
NaHS或硫氢化钠
18.H+可抑制Fe2+水解,防止铁的流失及引入新的杂质
温度过高会导致原料(NH4)2CO3的分解
4FeCO3?nH2O
+
O2
=
4FeO(OH)
+
4CO2
+
(4n﹣2)H2O
在隔绝空气环境下操作,防止有少量FeCO3?nH2O被空气氧化
高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以加入碳酸钙能增加一氧化碳的含量,则还原性铁粉的产率增大
ABCBB
答案第1页,总2页
