高二化学苏教版(2019)选择性必修1:专题一第一单元化学反应的热效应基础提升练习 含答案
文档属性
| 名称 | 高二化学苏教版(2019)选择性必修1:专题一第一单元化学反应的热效应基础提升练习 含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 190.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-08 15:11:05 | ||
图片预览



文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
高二上学期化学苏教版(2019)选择性必修1:专题一第一单元化学反应的热效应基础提升练习
一、单选题
1.目前脱硫工艺涉及的主要反应有
①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②S(g)+O2(g)=SO2(g) ΔH2
③S(g)+H2(g)=H2S(g) ΔH3
则“2H2(g)+O2(g)=2H2O(g) ΔH4”中ΔH4的正确表达式为(
)
A.ΔH4=(ΔH1+ΔH2-ΔH3)
B.ΔH4=2(ΔH1-ΔH2+ΔH3)
C.ΔH4=(ΔH1-ΔH2+ΔH3)
D.ΔH4=ΔH1-2(ΔH2-ΔH3)
2.已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=
-348.3
kJ/mol;(2)
2Ag(s)+1/2
O2(g)==
Ag2O(s),ΔH=
-31.0
kJ/mol
则ZnO(s)+
2Ag(s)==
Zn(s)+
Ag2O(s)的ΔH等于(
)
A.-317.3kJ/mol
B.-379.3kJ/mol
C.-332.8
kJ/mol
D.+317.3
kJ/mol
3.下图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.拆开2molH2
(g)和1
molO2(g)中的化学键成为H、O原子,共放出1368
kJ能量
B.由H、O原子形成2
molH2O(g),共吸收1852
kJ能量
C.2
molH2(g)和1
molO2
(g)反应生成2
mol
H2O(1),共吸收484
kJ能量
D.2
molH2
(g)和1
molO2(g)反应生成2
moIH2O(g),共放出484
kJ能量
4.已知H-H、N≡N、N-H的键能分别为436
kJ/mol、946
kJ/mol、391
kJ/mol则反应3H2(g)+N2(g)=2NH3(g)的焓变为(
)
A.-92
kJ/mol
B.+92kJ/mol
C.+1472kJ/mol
D.-1472kJ/mol
5.下列关于燃烧热的说法正确的是
A.
B.
C.
D.
6.已知CH4和CO的燃烧热分别为ΔH1
=
?890
kJ?mol?1、ΔH2
=?282
kJ?mol?1。现有4mol由CH4和CO组成的混合气体,完全燃烧共放出热量2952kJ。则CH4和CO的体积比为( )
A.3:1
B.2:1
C.1:2
D.1:3
7.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
已知:①C4H10(g)+O2(g)=C4H8(g)+H2O(g)△H=-119kJ·mol-1
②H2(g)+O2(g)=H2O(g)△H2=-242kJ·mol-1
丁烷(C4H10)脱氢制丁烯(C4H8)的热化学方程式为C4H10(g)C4H8(g)+H2(g)△H3。
下列叙述正确的是(
)
A.△H3=-123kJ·mol-1
B.其他条件不变时,反应平衡后升高温度,能提高该反应中丁烯产率
C.恒温恒容条件下,反应平衡后再充入C4H10(g),混合气体中丁烯的百分含量增大
D.其他条件不变时,反应平衡后增大压强,能提高该反应中丁烯产率
8.下列依据热化学方程式得出的结论正确的是(
)
选项
热化学方程式
结论
A
2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ/mol
H2的燃烧热为241.8kJ/mol
B
OH-(aq)+H+(aq)=H2O(l)ΔH=-57.3kJ/mol
含1molNaOH的稀溶液与浓H2SO4完全中和,放出热量小于57.3kJ
C
2C(s)+2O2(g)=2CO2(g)ΔH=-akJ/mol
2C(s)+O2(g)=2CO(g)ΔH=-bkJ/mol
b<a
D
C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ/mol
金刚石比石墨稳定
A.A
B.B
C.C
D.D
9.已知常温时红磷比白磷稳定,则反应中:P4(白磷,s)+5O2(g)=P4O10(s)ΔH=-akJ/mol
4P
(红磷,s)+5O2(g)=P4O10(s)ΔH=-bkJ/mol
若a、b均大于零,则a和b的关系为(
)
A.a<b
B.a=b
C.a>b
D.无法确定
10.下列有关叙述正确的是(
)
A.需要加热才能发生的反应一定是吸热反应
B.已知4P(红磷,s)=
P4(白磷,s)
△H>0,则白磷比红磷稳定
C.含20.0g
NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则OH-(aq)+H+
(aq)=
H2O(l)
△H=
-
57.4kJ/mol
D.已知2H2(g)+O2(g)
=
2H2O(g)
△H=
-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
11.在298K、100kPa时,有下列反应:
O2(g)+2H2(g)=2H2O(g)?H1;Cl2(g)+H2(g)=2HCl(g)?H2;2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)?H3,则?H3与?H1和?H2间的关系正确的是(
)
A.?H3=?H1+?H2
B.?H3=?H1+2?H2
C.?H3=2?H2-?H1
D.?H3=?H1-?H2
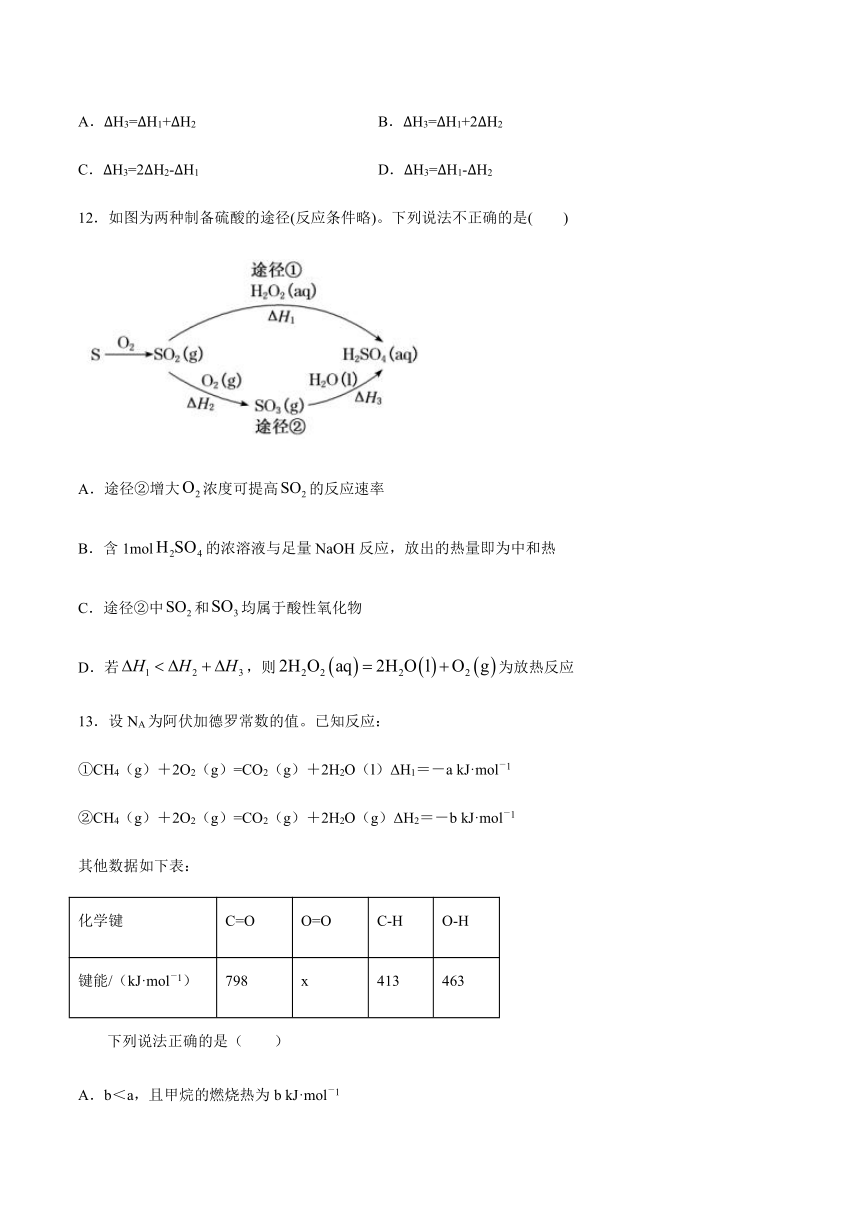
12.如图为两种制备硫酸的途径(反应条件略)。下列说法不正确的是(
)
A.途径②增大浓度可提高的反应速率
B.含1mol的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中和均属于酸性氧化物
D.若,则为放热反应
13.设NA为阿伏加德罗常数的值。已知反应:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-a
kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH2=-b
kJ·mol-1
其他数据如下表:
化学键
C=O
O=O
C-H
O-H
键能/(kJ·mol-1)
798
x
413
463
下列说法正确的是( )
A.b<a,且甲烷的燃烧热为b
kJ·mol-1
B.上表中x=
C.H2O(g)=H2O(l) ΔH=-(a-b)kJ·mol-1
D.当有4NA个C—H键断裂时,该反应放出热量一定为b
kJ
14.下列有关反应热的说法不正确的是(
)
A.在稀溶液中:H+(aq)+OH-(aq)=H2O(l),ΔH=-57.3kJ/mol,若将含0.5molH2SO4的稀硫酸与含1.1molNaOH的稀溶液混合,放出的热量等于57.3kJ
B.甲烷的燃烧热ΔH=-890kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
C.H-H键、O=O键和O-H键的键能分别为436kJ/mol,496kJ/mol和462kJ/mol,则反应2H2+O2=2H2O的△H=-1832kJ/mol
D.已知:S(s)+O2(g)=SO2(g)ΔH1=-Q1kJ·mol-1,S(g)+O2(g)=SO2(g)ΔH2=-Q2kJ·mol-1,则Q1<Q2
15.下列各组热化学方程式中,化学反应的△H前者大于后者的是(
)
A.C(s)+O2(g)=CO2(g)
△H1
C(s)+O2(g)=CO(g)
△H2
B.S(s)+O2(g)=SO2(g)
△H3
S(g)+O2(g)=SO2(g)
△H4
C.H2(g)+O2(g)=H2O(l)
△H
5
H2(g)+O2(g)=H2O(g)
△H6
D.CaO(s)+H2O(l)=Ca(OH)2(s)
△H7
CaCO3(s)=CaO(s)+CO2(g)
△H8
二、解答题
16.碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
;ΔH=+88.6
kJ·mol-1。
则M、N相比,较稳定的是____。
(2)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如下图所示,则CO从燃煤烟气中脱硫的热化学方程式为__________________
(△H用含m的代数式表示)
。
(3)已知CH3OH(l)的燃烧热ΔH=-238.6
kJ·mol-1,CH3OH(l)+O2(g)=CO2(g)+2H2(g)
ΔH=-a
kJ·mol-1,则a____(填“>”“
<”或“=”)
238.6。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176
kJ·mol-1,则反应过程中,每转移1
mol电子放出的热量为______。
(5)实验室用该耐高温材料废料(含Al2O3、TiC及少量C和Fe2O3)制备净水剂——液体聚合硫酸铝铁[AlFe(OH)n(SO4)m],操作步骤如下(部分操作和条件略):
I.向废料中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
①写出步骤I主反应的化学反应方程式__________________________________________,
②步骤I中反应温度与H2SO4的质量分数会影响铁与铝的浸出率。根据下图分析,
步骤I中反应的适宜温度是_______,H2SO4质量分数的适宜范围是_________.
③步骤II中加入双氧水所发生的离子方程式是_______________________。
④.......
17.铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s)
+
2H+(aq)
=
Cu2+(aq)
+
H2(g)
△H=
+64.39kJ/mol
2H2O2(l)
=
2H2O(l)
+
O2(g)
△H=
﹣196.46kJ/mol
H2(g)
+1/2
O2(g)=
H2O(l)
△H=
﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______________________________________________
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml
5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_______________,向反应后溶液中加入4mol/L
NaOH溶液_______ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为____ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量_________g。(用含a的代数式表示)
18.写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为_____
(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是_________
(3)已知断开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____
(4)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:____
(5)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g)2SO3(g)ΔH1=-197kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)2H2SO4(l)
ΔH3=-545kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式为____________________
试卷第1页,总3页
参考答案
1.B2.D3.D4.A5.D6.A7.B8.C9.C10.C11.C12.B13.B14.C15.B
16.M
2CO(g)+SO2(g)=S(s)+2CO2(g)
△H=(m-566)kJ·mol-1
<
98
kJ
Al2O3+3H2SO4=Al2(SO4)3+3H2O
100℃
45%~50%
H2O2+2Fe2++2H+=2H2O+2Fe3+
17.(1)Cu(s)
+2H+(aq)
+
H2O2(l)
=
Cu2+(aq)
+
2H2O(l)⊿H
=
-319.68
kJ/mol
(2)2.7(3)250
(4)89.6
(5)a+0.204
18.SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1
4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s)ΔH=-177.6kJ·mol-1
N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ·mol-1
A2(g)+B2(g)===2AB(g)ΔH=+(a-b)
kJ·mol-1
SO3(g)+H2O(l)===H2SO4(l) ΔH=-130kJ·mol-1
答案第1页,总2页
高二上学期化学苏教版(2019)选择性必修1:专题一第一单元化学反应的热效应基础提升练习
一、单选题
1.目前脱硫工艺涉及的主要反应有
①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②S(g)+O2(g)=SO2(g) ΔH2
③S(g)+H2(g)=H2S(g) ΔH3
则“2H2(g)+O2(g)=2H2O(g) ΔH4”中ΔH4的正确表达式为(
)
A.ΔH4=(ΔH1+ΔH2-ΔH3)
B.ΔH4=2(ΔH1-ΔH2+ΔH3)
C.ΔH4=(ΔH1-ΔH2+ΔH3)
D.ΔH4=ΔH1-2(ΔH2-ΔH3)
2.已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=
-348.3
kJ/mol;(2)
2Ag(s)+1/2
O2(g)==
Ag2O(s),ΔH=
-31.0
kJ/mol
则ZnO(s)+
2Ag(s)==
Zn(s)+
Ag2O(s)的ΔH等于(
)
A.-317.3kJ/mol
B.-379.3kJ/mol
C.-332.8
kJ/mol
D.+317.3
kJ/mol
3.下图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.拆开2molH2
(g)和1
molO2(g)中的化学键成为H、O原子,共放出1368
kJ能量
B.由H、O原子形成2
molH2O(g),共吸收1852
kJ能量
C.2
molH2(g)和1
molO2
(g)反应生成2
mol
H2O(1),共吸收484
kJ能量
D.2
molH2
(g)和1
molO2(g)反应生成2
moIH2O(g),共放出484
kJ能量
4.已知H-H、N≡N、N-H的键能分别为436
kJ/mol、946
kJ/mol、391
kJ/mol则反应3H2(g)+N2(g)=2NH3(g)的焓变为(
)
A.-92
kJ/mol
B.+92kJ/mol
C.+1472kJ/mol
D.-1472kJ/mol
5.下列关于燃烧热的说法正确的是
A.
B.
C.
D.
6.已知CH4和CO的燃烧热分别为ΔH1
=
?890
kJ?mol?1、ΔH2
=?282
kJ?mol?1。现有4mol由CH4和CO组成的混合气体,完全燃烧共放出热量2952kJ。则CH4和CO的体积比为( )
A.3:1
B.2:1
C.1:2
D.1:3
7.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
已知:①C4H10(g)+O2(g)=C4H8(g)+H2O(g)△H=-119kJ·mol-1
②H2(g)+O2(g)=H2O(g)△H2=-242kJ·mol-1
丁烷(C4H10)脱氢制丁烯(C4H8)的热化学方程式为C4H10(g)C4H8(g)+H2(g)△H3。
下列叙述正确的是(
)
A.△H3=-123kJ·mol-1
B.其他条件不变时,反应平衡后升高温度,能提高该反应中丁烯产率
C.恒温恒容条件下,反应平衡后再充入C4H10(g),混合气体中丁烯的百分含量增大
D.其他条件不变时,反应平衡后增大压强,能提高该反应中丁烯产率
8.下列依据热化学方程式得出的结论正确的是(
)
选项
热化学方程式
结论
A
2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ/mol
H2的燃烧热为241.8kJ/mol
B
OH-(aq)+H+(aq)=H2O(l)ΔH=-57.3kJ/mol
含1molNaOH的稀溶液与浓H2SO4完全中和,放出热量小于57.3kJ
C
2C(s)+2O2(g)=2CO2(g)ΔH=-akJ/mol
2C(s)+O2(g)=2CO(g)ΔH=-bkJ/mol
b<a
D
C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ/mol
金刚石比石墨稳定
A.A
B.B
C.C
D.D
9.已知常温时红磷比白磷稳定,则反应中:P4(白磷,s)+5O2(g)=P4O10(s)ΔH=-akJ/mol
4P
(红磷,s)+5O2(g)=P4O10(s)ΔH=-bkJ/mol
若a、b均大于零,则a和b的关系为(
)
A.a<b
B.a=b
C.a>b
D.无法确定
10.下列有关叙述正确的是(
)
A.需要加热才能发生的反应一定是吸热反应
B.已知4P(红磷,s)=
P4(白磷,s)
△H>0,则白磷比红磷稳定
C.含20.0g
NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则OH-(aq)+H+
(aq)=
H2O(l)
△H=
-
57.4kJ/mol
D.已知2H2(g)+O2(g)
=
2H2O(g)
△H=
-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
11.在298K、100kPa时,有下列反应:
O2(g)+2H2(g)=2H2O(g)?H1;Cl2(g)+H2(g)=2HCl(g)?H2;2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)?H3,则?H3与?H1和?H2间的关系正确的是(
)
A.?H3=?H1+?H2
B.?H3=?H1+2?H2
C.?H3=2?H2-?H1
D.?H3=?H1-?H2
12.如图为两种制备硫酸的途径(反应条件略)。下列说法不正确的是(
)
A.途径②增大浓度可提高的反应速率
B.含1mol的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中和均属于酸性氧化物
D.若,则为放热反应
13.设NA为阿伏加德罗常数的值。已知反应:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-a
kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH2=-b
kJ·mol-1
其他数据如下表:
化学键
C=O
O=O
C-H
O-H
键能/(kJ·mol-1)
798
x
413
463
下列说法正确的是( )
A.b<a,且甲烷的燃烧热为b
kJ·mol-1
B.上表中x=
C.H2O(g)=H2O(l) ΔH=-(a-b)kJ·mol-1
D.当有4NA个C—H键断裂时,该反应放出热量一定为b
kJ
14.下列有关反应热的说法不正确的是(
)
A.在稀溶液中:H+(aq)+OH-(aq)=H2O(l),ΔH=-57.3kJ/mol,若将含0.5molH2SO4的稀硫酸与含1.1molNaOH的稀溶液混合,放出的热量等于57.3kJ
B.甲烷的燃烧热ΔH=-890kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
C.H-H键、O=O键和O-H键的键能分别为436kJ/mol,496kJ/mol和462kJ/mol,则反应2H2+O2=2H2O的△H=-1832kJ/mol
D.已知:S(s)+O2(g)=SO2(g)ΔH1=-Q1kJ·mol-1,S(g)+O2(g)=SO2(g)ΔH2=-Q2kJ·mol-1,则Q1<Q2
15.下列各组热化学方程式中,化学反应的△H前者大于后者的是(
)
A.C(s)+O2(g)=CO2(g)
△H1
C(s)+O2(g)=CO(g)
△H2
B.S(s)+O2(g)=SO2(g)
△H3
S(g)+O2(g)=SO2(g)
△H4
C.H2(g)+O2(g)=H2O(l)
△H
5
H2(g)+O2(g)=H2O(g)
△H6
D.CaO(s)+H2O(l)=Ca(OH)2(s)
△H7
CaCO3(s)=CaO(s)+CO2(g)
△H8
二、解答题
16.碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
;ΔH=+88.6
kJ·mol-1。
则M、N相比,较稳定的是____。
(2)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如下图所示,则CO从燃煤烟气中脱硫的热化学方程式为__________________
(△H用含m的代数式表示)
。
(3)已知CH3OH(l)的燃烧热ΔH=-238.6
kJ·mol-1,CH3OH(l)+O2(g)=CO2(g)+2H2(g)
ΔH=-a
kJ·mol-1,则a____(填“>”“
<”或“=”)
238.6。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176
kJ·mol-1,则反应过程中,每转移1
mol电子放出的热量为______。
(5)实验室用该耐高温材料废料(含Al2O3、TiC及少量C和Fe2O3)制备净水剂——液体聚合硫酸铝铁[AlFe(OH)n(SO4)m],操作步骤如下(部分操作和条件略):
I.向废料中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
①写出步骤I主反应的化学反应方程式__________________________________________,
②步骤I中反应温度与H2SO4的质量分数会影响铁与铝的浸出率。根据下图分析,
步骤I中反应的适宜温度是_______,H2SO4质量分数的适宜范围是_________.
③步骤II中加入双氧水所发生的离子方程式是_______________________。
④.......
17.铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s)
+
2H+(aq)
=
Cu2+(aq)
+
H2(g)
△H=
+64.39kJ/mol
2H2O2(l)
=
2H2O(l)
+
O2(g)
△H=
﹣196.46kJ/mol
H2(g)
+1/2
O2(g)=
H2O(l)
△H=
﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______________________________________________
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml
5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_______________,向反应后溶液中加入4mol/L
NaOH溶液_______ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为____ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量_________g。(用含a的代数式表示)
18.写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为_____
(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是_________
(3)已知断开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____
(4)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:____
(5)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g)2SO3(g)ΔH1=-197kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)2H2SO4(l)
ΔH3=-545kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式为____________________
试卷第1页,总3页
参考答案
1.B2.D3.D4.A5.D6.A7.B8.C9.C10.C11.C12.B13.B14.C15.B
16.M
2CO(g)+SO2(g)=S(s)+2CO2(g)
△H=(m-566)kJ·mol-1
<
98
kJ
Al2O3+3H2SO4=Al2(SO4)3+3H2O
100℃
45%~50%
H2O2+2Fe2++2H+=2H2O+2Fe3+
17.(1)Cu(s)
+2H+(aq)
+
H2O2(l)
=
Cu2+(aq)
+
2H2O(l)⊿H
=
-319.68
kJ/mol
(2)2.7
(4)89.6
(5)a+0.204
18.SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1
4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s)ΔH=-177.6kJ·mol-1
N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ·mol-1
A2(g)+B2(g)===2AB(g)ΔH=+(a-b)
kJ·mol-1
SO3(g)+H2O(l)===H2SO4(l) ΔH=-130kJ·mol-1
答案第1页,总2页
