山东省日照市五莲县2020-2021学年高二下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 山东省日照市五莲县2020-2021学年高二下学期期中考试化学试题 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 509.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-08 00:00:00 | ||
图片预览


文档简介
五莲县2020-2021学年高二下学期期中考试
化学试题
2021.04
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列说法错误的是
A.p能级电子能量一定高于s能级电子能量
B.同一原子处于激发态时的能量一定高于基态时的能量
C.Fe3+的最外层电子排布式:3s23p63d5
D.S电子云呈球形,有无数条对称轴
2.下列正确的是
A.丙烯的结构简式:CH3CHCH2
B.甲醛(HCHO)和光气(COCl2)分子中:键角∠H-C-H<∠Cl-C-Cl
C.1mol O22-的电子数是18NA
D.基态铜原子的价层电子排布图:
3.下列分子中,所有原子都满足最外层8电子稳定结构的是
A.光气(COCl2) B.六氟化硫(SF6)
C.五氯化磷(PCl5) D. 三氟化硼(BF3)
4.等电子体具有相似的空间结构,下列物质不属于等电子体的是
A.SO3和NO3- B.B3H6N3和C6H6
C.金刚石和晶体硅 D.CO2和SiO2
5.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
A.Y为O或S元素 B.元素电负性的顺序为X>Y>Z
C.元素的第一电离能顺序Z>Y>X >W D.对应简单离子的半径顺序W>X>Y>Z
6.下列说法中,正确的是
A.离子化合物中只有离子键
B.非极性分子中肯定没有极性键
C.氮气分子中有一个键和两个键
D.水分子间可以生成氢键,所以水比硫化氢更稳定
7.下列大小关系不正确的是
A.熔点:SiC>MgO>NaBr>NaI>S
B.密度:溴苯>水>甲苯
C.水溶性:丙三醇>丙醇>苯甲醇
D.-OH上H的活泼性:苯酚>乙醇>水
8.下列说法正确的是
A.凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
9.下列现象的变化与配合物的形成无关的是
A.向FeCl3溶液中滴加KSCN,出现红色
B.用王水(1体积浓硝酸和3体积浓盐酸混合而成)清洗金币,会使金币质量减轻
C.向AgNO3溶液中滴加氨水,先出现白色沉淀后溶解
D.向AlCl3溶液中逐滴加入NH3·H2O溶液至过量,出现白色沉淀
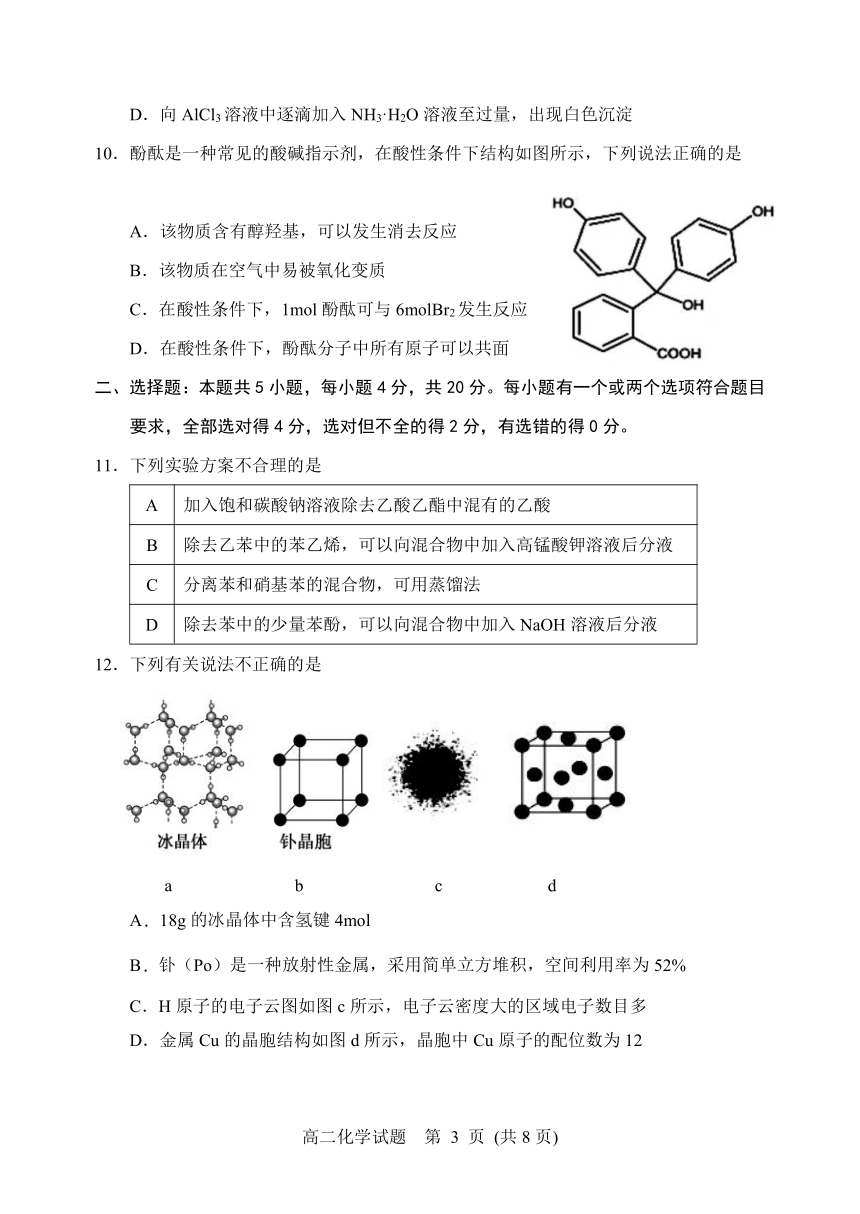
10.酚酞是一种常见的酸碱指示剂,在酸性条件下结构如图所示,下列说法正确的是
A.该物质含有醇羟基,可以发生消去反应
B.该物质在空气中易被氧化变质
C.在酸性条件下,1mol酚酞可与6molBr2发生反应
D.在酸性条件下,酚酞分子中所有原子可以共面
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验方案不合理的是
A 加入饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸
B 除去乙苯中的苯乙烯,可以向混合物中加入高锰酸钾溶液后分液
C 分离苯和硝基苯的混合物,可用蒸馏法
D 除去苯中的少量苯酚,可以向混合物中加入NaOH溶液后分液
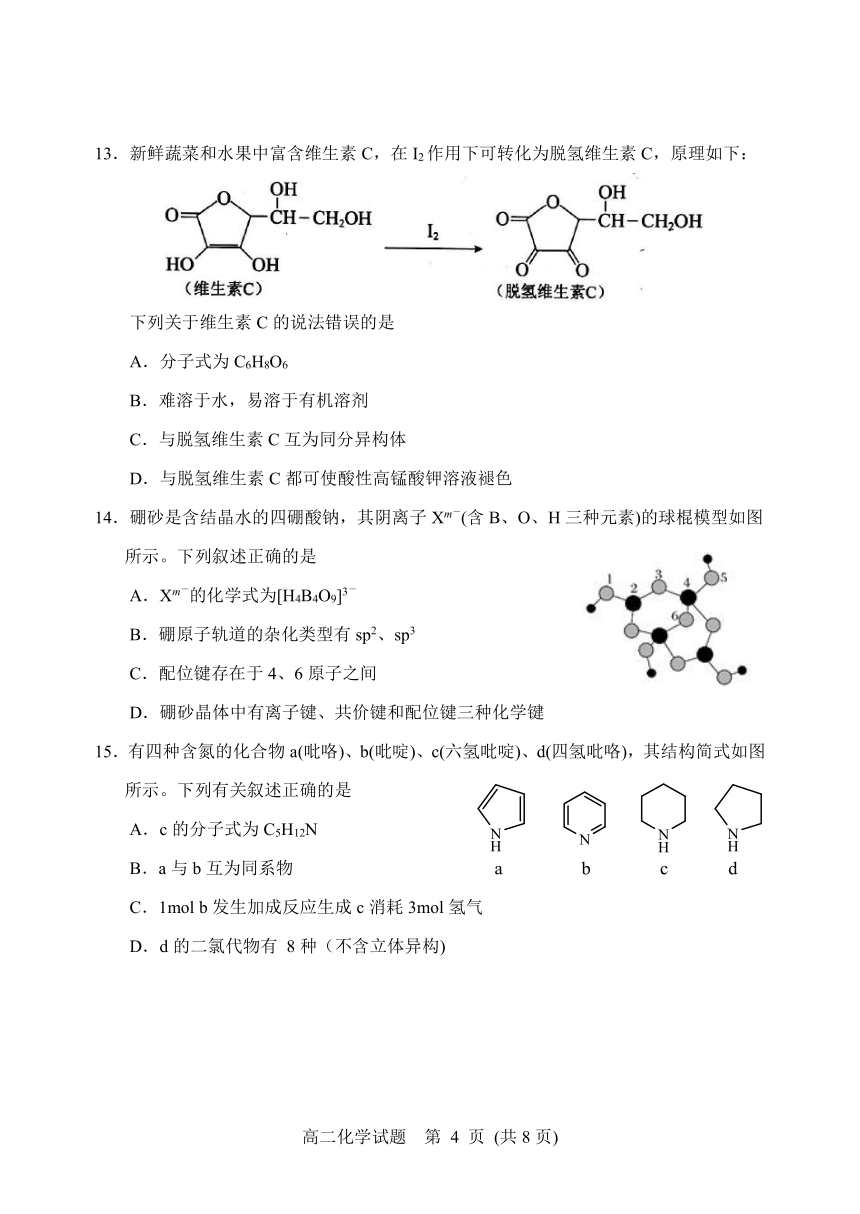
12.下列有关说法不正确的是
a b c d
A.18g的冰晶体中含氢键4mol
B.钋(Po)是一种放射性金属,采用简单立方堆积,空间利用率为52%
C.H原子的电子云图如图c所示,电子云密度大的区域电子数目多
D.金属Cu的晶胞结构如图d所示,晶胞中Cu原子的配位数为12
13.新鲜蔬菜和水果中富含维生素C,在I2作用下可转化为脱氢维生素C,原理如下:
下列关于维生素C的说法错误的是
A.分子式为C6H8O6
B.难溶于水,易溶于有机溶剂
C.与脱氢维生素C互为同分异构体
D.与脱氢维生素C都可使酸性高锰酸钾溶液褪色
14.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列叙述正确的是
A.Xm-的化学式为[H4B4O9]3-
B.硼原子轨道的杂化类型有sp2、sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、共价键和配位键三种化学键
15.有四种含氮的化合物a(吡咯)、b(吡啶)、c(六氢吡啶)、d(四氢吡咯),其结构简式如图所示。下列有关叙述正确的是
A.c的分子式为C5H12N
B.a与b互为同系物
C.1mol b发生加成反应生成c消耗3mol氢气
D.d的二氯代物有 8种(不含立体异构)
三、非选择题:本题共5大题,共60分。
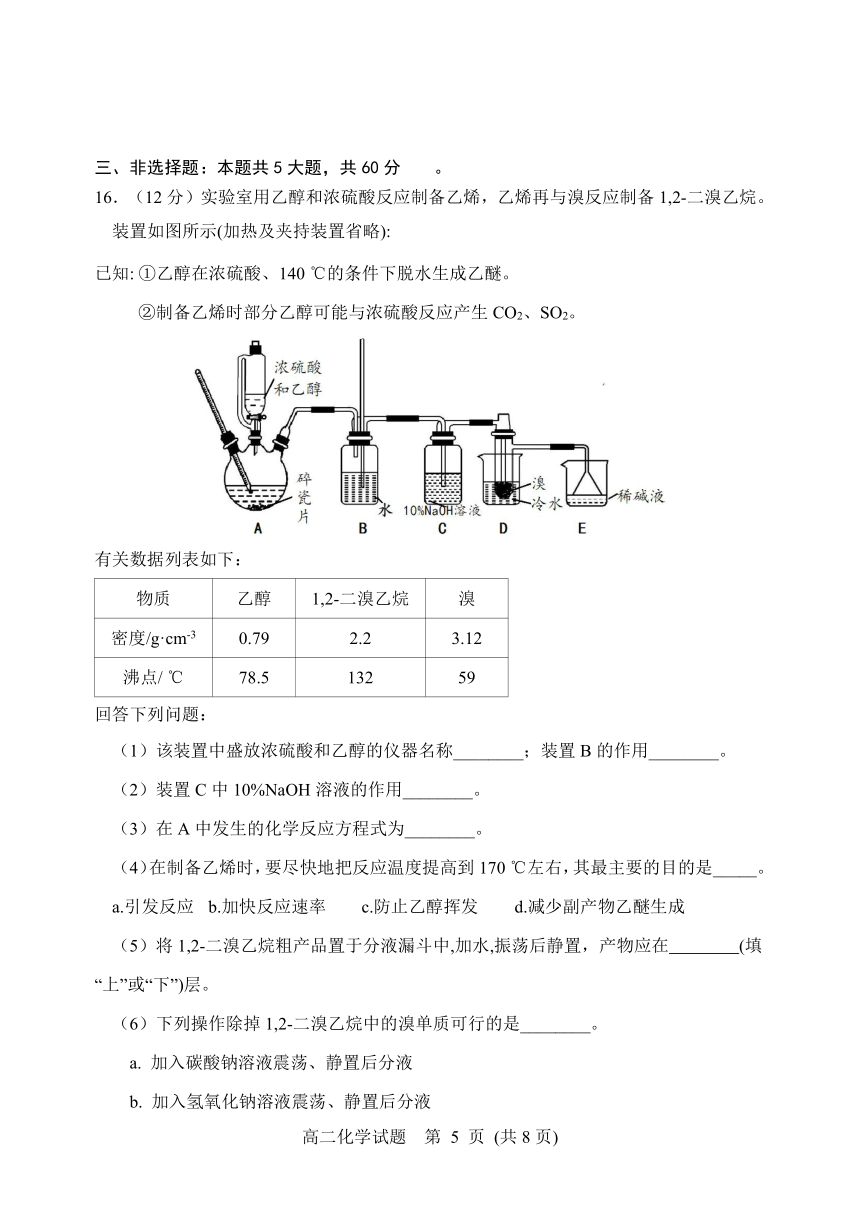
16.(12分)实验室用乙醇和浓硫酸反应制备乙烯,乙烯再与溴反应制备1,2-二溴乙烷。装置如图所示(加热及夹持装置省略):
已知: ①乙醇在浓硫酸、140 ℃的条件下脱水生成乙醚。
②制备乙烯时部分乙醇可能与浓硫酸反应产生CO2、SO2。
有关数据列表如下:
物质 乙醇 1,2-二溴乙烷 溴
密度/g·cm-3 0.79 2.2 3.12
沸点/ ℃ 78.5 132 59
回答下列问题:
(1)该装置中盛放浓硫酸和乙醇的仪器名称________;装置B的作用________。
(2)装置C中10%NaOH溶液的作用________。
(3)在A中发生的化学反应方程式为________。
(4)在制备乙烯时,要尽快地把反应温度提高到170 ℃左右,其最主要的目的是_____。
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(5)将1,2-二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在 (填“上”或“下”)层。?
(6)下列操作除掉1,2-二溴乙烷中的溴单质可行的是________。
a. 加入碳酸钠溶液震荡、静置后分液
b. 加入氢氧化钠溶液震荡、静置后分液
c. 蒸馏
17.(12分)下表为元素周期表的一部分,其中编号代表对应的元素。
回答下列问题:
(1)表中属于d区元素的是______ (填元素符号)。
(2)表中元素①的2个原子与元素③的2个原子形成的物质,其空间构型为______。
(3)某元素原子的价电子排布式为nsnnpn,该原子的电子层上未成对电子数为___。
(4)元素⑤的第一电离能_____(填“>”“<”“=”)元素⑥的第一电离能。
(5)元素⑦的基态原子核外电子排布式是________。
(6)处于对角线位置的元素,性质也有一定的相似性,如上表中元素②与元素⑥的氢氧化物具有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程____。
18.(12分)配位化合物一般指由过渡金属的原子或离子与含有孤对电子的分子或离子等通过配位键结合形成的化合物,广泛应用于日常生活、工业生产及生命科学中。
回答下列问题:
(1)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1mol配合物中通过螯合作用形成的配位键有____mol,螯合物中N的杂化方式为_____,该配合物中除含有配位键外还有____键。
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
(3)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,写出能体现配位键的结构式:________。
(4)K3[Fe(CN)6]晶体中各种微粒的作用力有_____(填字母)。
a.金属键 b.共价键 c.配位键 d.离子键
19.(12分)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,工作原理为
LiFePO4+CLixC+Li1-xFePO4。回答下列问题:
(1)下列关于Li原子电子排布图表示的状态中,能量最高的为________(填标号)。
a. b.
c. d.
(2)LiFePO4中PO43-的空间构型为________,与其互为等电子体的分子有_____(填一种即可)。
(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3 、PI3,则他们的熔点由高到底的顺序为________,键角由小到大的顺序为________。
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是________ (填元素符号),判断依据是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,上图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为______g·cm-3(用含x的式子表示)。
20.(12分)实验室以有机物A、E为原料,制备混合酯J的合成路线如下:
回答下列问题:
(1) BCD的反应类型分别为_______、_______。
(2)D中含有的官能团名称为 ,I的结构简式为_____。
(3)关于G的说法正确的是_______(填选项字母)
a.分子中所有C原子在同一平面上
b.分子中含有手性碳原子
c.该分子既能发生消去反应又能发生取代反应
d.一溴代物有4种
(4)A的同系物M()的名称为_______(用系统命名法命名)。
(5)写出GH的化学方程式_______。
(6)N为比F多一个碳原子的同系物,则N的同分异构体有_______种。
高二化学参考答案
1—5 ACADC 6—10 CDCDB 11—15 B AC BC BD CD
16.(12分)
(1)恒压滴液漏斗(1分)作安全瓶(1分)(2)除CO2、SO2(2分)
(3)CH3CH2OH+H2O(2分)
(4)d(2分)(5)下(2分) (6)ac(2分)
17.(12分)(1)Cr(2分) (2)直线型(2分) (3)2 (2分)
(4)>(2分)(5)1s22s22p63s23p63d54s1(或[Ar]3d54s1) (2分)
(6)Be(OH)2+2NaOH===Na2BeO2+2H2O(2分)
18.(12分)(1)4(2分) sp2(2分) 共价(2分)
(2)平面正方形(2分) (3) (2分) (4)bcd(2分)
19.(12分)
(1)c(1分)
(2)正四面体(1分)CCl4、SiCl4、CBr4、SiF4(任写一种) (1分)
(3)PI3 PBr3 PCl3 PF3(1分) PF3 PCl3 PBr3 PI3(1分)
(4)N(1分)N和P位于同主族,N的原子半径小于P,N的第一电离能大于P;N和O位于同周期,N原子的2p能级达到半充满的稳定状态,N的第一电离能大于O(2分)
(5)①(0.25,0.25,0.25) (2分) ②(2分)
20.(12分)(1) 加成反应(1分)、取代反应(1分)
(2) 羟基(1分)、HOOC(CH2)4COOH (1分)
(3)cd (2分)(4)2,3-二甲基-2-丁醇(2分)
(5) (2分)
(6)4(2分)
高二化学试题 第 8 页 (共8页)
化学试题
2021.04
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列说法错误的是
A.p能级电子能量一定高于s能级电子能量
B.同一原子处于激发态时的能量一定高于基态时的能量
C.Fe3+的最外层电子排布式:3s23p63d5
D.S电子云呈球形,有无数条对称轴
2.下列正确的是
A.丙烯的结构简式:CH3CHCH2
B.甲醛(HCHO)和光气(COCl2)分子中:键角∠H-C-H<∠Cl-C-Cl
C.1mol O22-的电子数是18NA
D.基态铜原子的价层电子排布图:
3.下列分子中,所有原子都满足最外层8电子稳定结构的是
A.光气(COCl2) B.六氟化硫(SF6)
C.五氯化磷(PCl5) D. 三氟化硼(BF3)
4.等电子体具有相似的空间结构,下列物质不属于等电子体的是
A.SO3和NO3- B.B3H6N3和C6H6
C.金刚石和晶体硅 D.CO2和SiO2
5.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
A.Y为O或S元素 B.元素电负性的顺序为X>Y>Z
C.元素的第一电离能顺序Z>Y>X >W D.对应简单离子的半径顺序W>X>Y>Z
6.下列说法中,正确的是
A.离子化合物中只有离子键
B.非极性分子中肯定没有极性键
C.氮气分子中有一个键和两个键
D.水分子间可以生成氢键,所以水比硫化氢更稳定
7.下列大小关系不正确的是
A.熔点:SiC>MgO>NaBr>NaI>S
B.密度:溴苯>水>甲苯
C.水溶性:丙三醇>丙醇>苯甲醇
D.-OH上H的活泼性:苯酚>乙醇>水
8.下列说法正确的是
A.凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
9.下列现象的变化与配合物的形成无关的是
A.向FeCl3溶液中滴加KSCN,出现红色
B.用王水(1体积浓硝酸和3体积浓盐酸混合而成)清洗金币,会使金币质量减轻
C.向AgNO3溶液中滴加氨水,先出现白色沉淀后溶解
D.向AlCl3溶液中逐滴加入NH3·H2O溶液至过量,出现白色沉淀
10.酚酞是一种常见的酸碱指示剂,在酸性条件下结构如图所示,下列说法正确的是
A.该物质含有醇羟基,可以发生消去反应
B.该物质在空气中易被氧化变质
C.在酸性条件下,1mol酚酞可与6molBr2发生反应
D.在酸性条件下,酚酞分子中所有原子可以共面
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验方案不合理的是
A 加入饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸
B 除去乙苯中的苯乙烯,可以向混合物中加入高锰酸钾溶液后分液
C 分离苯和硝基苯的混合物,可用蒸馏法
D 除去苯中的少量苯酚,可以向混合物中加入NaOH溶液后分液
12.下列有关说法不正确的是
a b c d
A.18g的冰晶体中含氢键4mol
B.钋(Po)是一种放射性金属,采用简单立方堆积,空间利用率为52%
C.H原子的电子云图如图c所示,电子云密度大的区域电子数目多
D.金属Cu的晶胞结构如图d所示,晶胞中Cu原子的配位数为12
13.新鲜蔬菜和水果中富含维生素C,在I2作用下可转化为脱氢维生素C,原理如下:
下列关于维生素C的说法错误的是
A.分子式为C6H8O6
B.难溶于水,易溶于有机溶剂
C.与脱氢维生素C互为同分异构体
D.与脱氢维生素C都可使酸性高锰酸钾溶液褪色
14.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列叙述正确的是
A.Xm-的化学式为[H4B4O9]3-
B.硼原子轨道的杂化类型有sp2、sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、共价键和配位键三种化学键
15.有四种含氮的化合物a(吡咯)、b(吡啶)、c(六氢吡啶)、d(四氢吡咯),其结构简式如图所示。下列有关叙述正确的是
A.c的分子式为C5H12N
B.a与b互为同系物
C.1mol b发生加成反应生成c消耗3mol氢气
D.d的二氯代物有 8种(不含立体异构)
三、非选择题:本题共5大题,共60分。
16.(12分)实验室用乙醇和浓硫酸反应制备乙烯,乙烯再与溴反应制备1,2-二溴乙烷。装置如图所示(加热及夹持装置省略):
已知: ①乙醇在浓硫酸、140 ℃的条件下脱水生成乙醚。
②制备乙烯时部分乙醇可能与浓硫酸反应产生CO2、SO2。
有关数据列表如下:
物质 乙醇 1,2-二溴乙烷 溴
密度/g·cm-3 0.79 2.2 3.12
沸点/ ℃ 78.5 132 59
回答下列问题:
(1)该装置中盛放浓硫酸和乙醇的仪器名称________;装置B的作用________。
(2)装置C中10%NaOH溶液的作用________。
(3)在A中发生的化学反应方程式为________。
(4)在制备乙烯时,要尽快地把反应温度提高到170 ℃左右,其最主要的目的是_____。
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(5)将1,2-二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在 (填“上”或“下”)层。?
(6)下列操作除掉1,2-二溴乙烷中的溴单质可行的是________。
a. 加入碳酸钠溶液震荡、静置后分液
b. 加入氢氧化钠溶液震荡、静置后分液
c. 蒸馏
17.(12分)下表为元素周期表的一部分,其中编号代表对应的元素。
回答下列问题:
(1)表中属于d区元素的是______ (填元素符号)。
(2)表中元素①的2个原子与元素③的2个原子形成的物质,其空间构型为______。
(3)某元素原子的价电子排布式为nsnnpn,该原子的电子层上未成对电子数为___。
(4)元素⑤的第一电离能_____(填“>”“<”“=”)元素⑥的第一电离能。
(5)元素⑦的基态原子核外电子排布式是________。
(6)处于对角线位置的元素,性质也有一定的相似性,如上表中元素②与元素⑥的氢氧化物具有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程____。
18.(12分)配位化合物一般指由过渡金属的原子或离子与含有孤对电子的分子或离子等通过配位键结合形成的化合物,广泛应用于日常生活、工业生产及生命科学中。
回答下列问题:
(1)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1mol配合物中通过螯合作用形成的配位键有____mol,螯合物中N的杂化方式为_____,该配合物中除含有配位键外还有____键。
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
(3)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,写出能体现配位键的结构式:________。
(4)K3[Fe(CN)6]晶体中各种微粒的作用力有_____(填字母)。
a.金属键 b.共价键 c.配位键 d.离子键
19.(12分)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,工作原理为
LiFePO4+CLixC+Li1-xFePO4。回答下列问题:
(1)下列关于Li原子电子排布图表示的状态中,能量最高的为________(填标号)。
a. b.
c. d.
(2)LiFePO4中PO43-的空间构型为________,与其互为等电子体的分子有_____(填一种即可)。
(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3 、PI3,则他们的熔点由高到底的顺序为________,键角由小到大的顺序为________。
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是________ (填元素符号),判断依据是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,上图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为______g·cm-3(用含x的式子表示)。
20.(12分)实验室以有机物A、E为原料,制备混合酯J的合成路线如下:
回答下列问题:
(1) BCD的反应类型分别为_______、_______。
(2)D中含有的官能团名称为 ,I的结构简式为_____。
(3)关于G的说法正确的是_______(填选项字母)
a.分子中所有C原子在同一平面上
b.分子中含有手性碳原子
c.该分子既能发生消去反应又能发生取代反应
d.一溴代物有4种
(4)A的同系物M()的名称为_______(用系统命名法命名)。
(5)写出GH的化学方程式_______。
(6)N为比F多一个碳原子的同系物,则N的同分异构体有_______种。
高二化学参考答案
1—5 ACADC 6—10 CDCDB 11—15 B AC BC BD CD
16.(12分)
(1)恒压滴液漏斗(1分)作安全瓶(1分)(2)除CO2、SO2(2分)
(3)CH3CH2OH+H2O(2分)
(4)d(2分)(5)下(2分) (6)ac(2分)
17.(12分)(1)Cr(2分) (2)直线型(2分) (3)2 (2分)
(4)>(2分)(5)1s22s22p63s23p63d54s1(或[Ar]3d54s1) (2分)
(6)Be(OH)2+2NaOH===Na2BeO2+2H2O(2分)
18.(12分)(1)4(2分) sp2(2分) 共价(2分)
(2)平面正方形(2分) (3) (2分) (4)bcd(2分)
19.(12分)
(1)c(1分)
(2)正四面体(1分)CCl4、SiCl4、CBr4、SiF4(任写一种) (1分)
(3)PI3 PBr3 PCl3 PF3(1分) PF3 PCl3 PBr3 PI3(1分)
(4)N(1分)N和P位于同主族,N的原子半径小于P,N的第一电离能大于P;N和O位于同周期,N原子的2p能级达到半充满的稳定状态,N的第一电离能大于O(2分)
(5)①(0.25,0.25,0.25) (2分) ②(2分)
20.(12分)(1) 加成反应(1分)、取代反应(1分)
(2) 羟基(1分)、HOOC(CH2)4COOH (1分)
(3)cd (2分)(4)2,3-二甲基-2-丁醇(2分)
(5) (2分)
(6)4(2分)
高二化学试题 第 8 页 (共8页)
同课章节目录
