山东省日照市五莲县2020-2021学年高一下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 山东省日照市五莲县2020-2021学年高一下学期期中考试化学试题 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-08 20:41:16 | ||
图片预览



文档简介
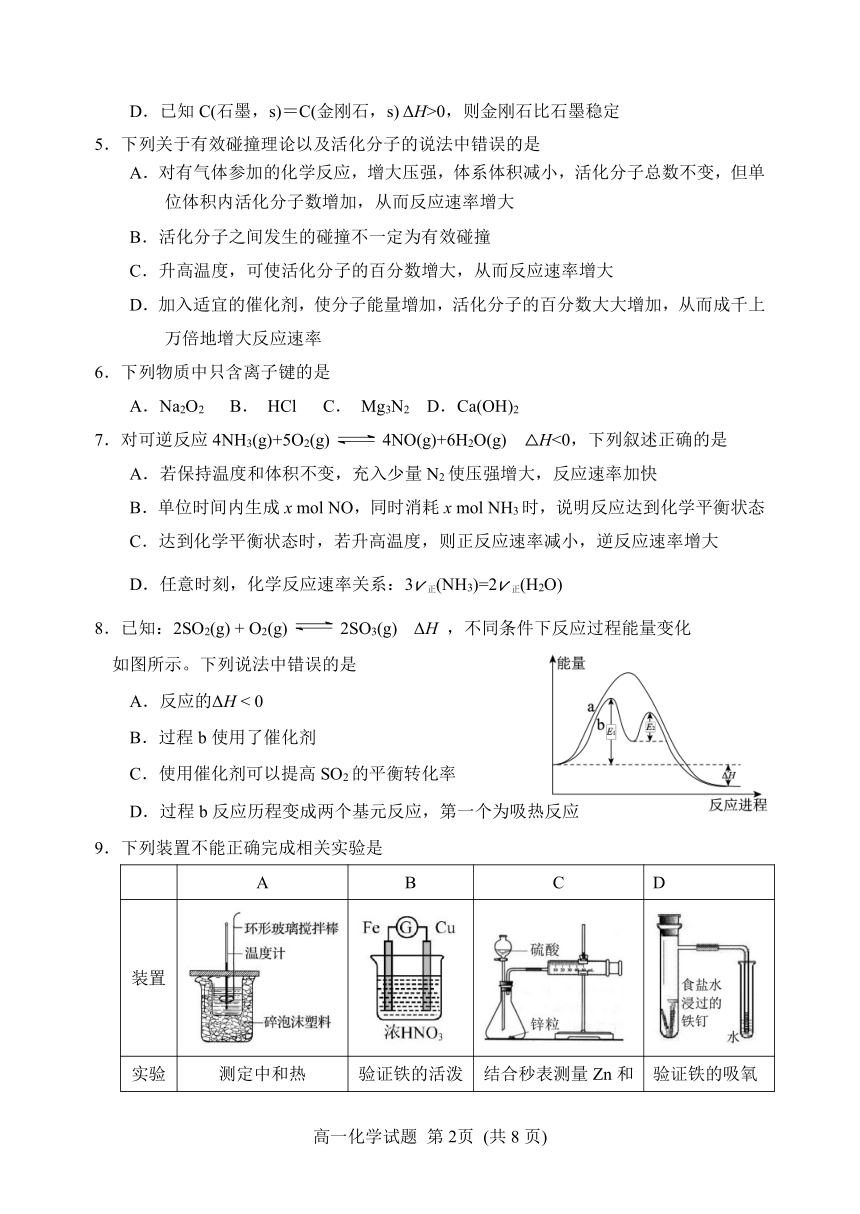
五莲县2020-2021学年高一下学期期中考试
化学试题
2021.04
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Cl 35.5 K 39
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法正确的是
A.如图,对钢管的防护措施为牺牲阳极保护法
B.硅太阳能电池将化学能转化为电能
C.燃料电池的能量转化率为100%
D. 太阳能、氢能、核能、生物质能、水能都属于新能源
2.下列叙述正确的是
A.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
B.离子化合物中一定有离子键,可能有共价键;非金属单质中一定含有共价键
C.硝酸水溶液中含有H+和NO3-,故HNO3为离子化合物。
D.某化合物熔融状态下能导电,该化合物一定为离子化合物
3.下列有关电解的叙述正确的是
A.工业上用电解熔融NaCl的方法制取Na时,阳极材料可以是石墨或铁
B.可以用电解熔融的 AlCl3 来制取Al
C.工业上电解饱和食盐水制备烧碱,采用阳离子交换膜
D.电解精炼铜时,溶液中铜离子的浓度不变
4.下列叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1则H2的燃烧热为241.8kJ·mol-1
B.己知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
5.下列关于有效碰撞理论以及活化分子的说法中错误的是
A.对有气体参加的化学反应,增大压强,体系体积减小,活化分子总数不变,但单位体积内活化分子数增加,从而反应速率增大
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,可使活化分子的百分数增大,从而反应速率增大
D.加入适宜的催化剂,使分子能量增加,活化分子的百分数大大增加,从而成千上万倍地增大反应速率
6.下列物质中只含离子键的是
A.Na2O2 B. HCl C. Mg3N2 D.Ca(OH)2
7.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H<0,下列叙述正确的是
A.若保持温度和体积不变,充入少量N2使压强增大,反应速率加快
B.单位时间内生成x mol NO,同时消耗x mol NH3时,说明反应达到化学平衡状态
C.达到化学平衡状态时,若升高温度,则正反应速率减小,逆反应速率增大
D.任意时刻,化学反应速率关系:3v正(NH3)=2v正(H2O)
8.已知:2SO2(g) + O2(g)2SO3(g) ΔH ,不同条件下反应过程能量变化
如图所示。下列说法中错误的是
A.反应的ΔH < 0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b反应历程变成两个基元反应,第一个为吸热反应
9.下列装置不能正确完成相关实验是
A B C D
装置
实验 测定中和热 验证铁的活泼性强于铜 结合秒表测量Zn和硫酸反应的速率 验证铁的吸氧腐蚀
10.下面是几种常见的化学电源示意图,有关说法错误的是
A.上述电池分别属于一次电池、二次电池和燃料电池
B.如图所示,干电池使用时电子从锌筒流向石墨电极,再通过电解质到锌筒
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量增重96 g
D.碱性氢氧燃料电池正极的电极反应式为:O2+2H2O+4e-===4OH-
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列关于反应速率与参与反应物质的浓度关系式v=kca(A)? cb(B)的叙述中错误的是
A.对于所有化学反应,k是数值不变的常数
B.a、b是化学方程式中A、B物质的系数
C.对于某个给定的化学反应,k与反应物的浓度无关
D.反应速率与参与反应物质的浓度关系式是通过实验测定的结果,不能随意根据方程式直接写出
12.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯。下列叙述中正确的是
A.电解时精铜作阳极
B.粗铜连接电源的负极
C.电解时阴极上发生的电极反应为Cu2++2e-===Cu
D.电解后,电解槽底部会形成含有少量Ag、Pt等金属的阳极泥
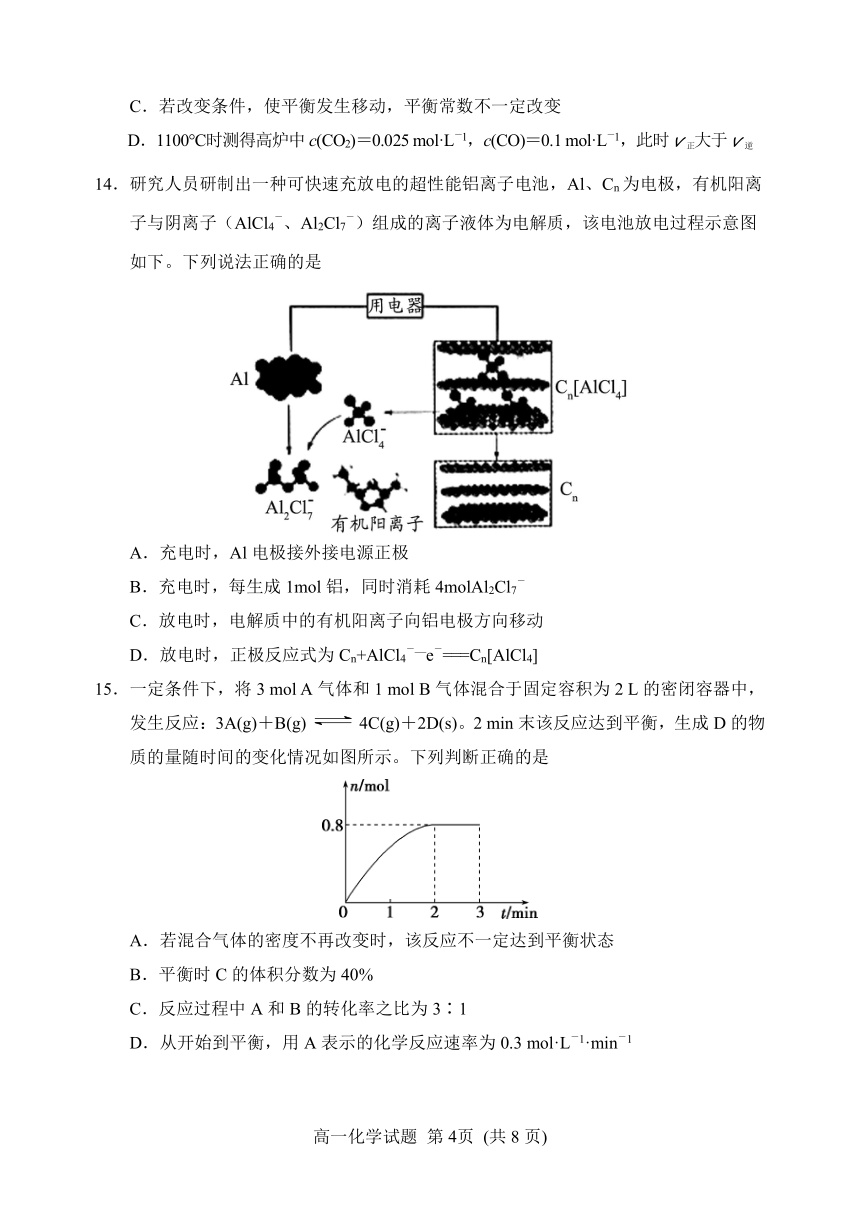
13.高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g)Fe(s)+CO2(g),已知1100℃时K=0.263。下列说法错误的是
A.该反应的平衡常数表达式为
B.平衡后再加入FeO,反应速率会变大
C.若改变条件,使平衡发生移动,平衡常数不一定改变
D.1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时v正大于v逆
14.研究人员研制出一种可快速充放电的超性能铝离子电池,Al、Cn为电极,有机阳离子与阴离子(AlCl4-、Al2Cl7-)组成的离子液体为电解质,该电池放电过程示意图如下。下列说法正确的是
A.充电时,Al电极接外接电源正极
B.充电时,每生成1mol铝,同时消耗4molAl2Cl7-
C.放电时,电解质中的有机阳离子向铝电极方向移动
D.放电时,正极反应式为Cn+AlCl4-—e-===Cn[AlCl4]
15.一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g)4C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.平衡时C的体积分数为40%
C.反应过程中A和B的转化率之比为3∶1
D.从开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
三、非选择题:本题共5小题,共60分。
16.(12分)A、B、D、E、F、G为短周期元素,且原子序数依次增大。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。
回答下列问题:
(1)G在周期表中的位置为 。?
(2)由A、D、E三种元素形成的离子化合物的化学式是 。
(3)F2G的电子式为 ,含有 化学键(填“离子键”或“共价键”)。
(4)由A、F两种元素形成的一种离子化合物X,常温下与水迅速反应生成气体,该反应的化学方程式为 。
(5)D的最简单气态氢化物可用于燃料电池,电池工作时生成无毒物质,工作原理如图所示。该燃料电池的电解质溶液最好选择碱性溶液,则负极电极反应式为 。
17.(12分)能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,△H=+571.68 kJ·mol-1,△H-T△S=+474.38 kJ·mol-1。
则常温下水的分解不能自发进行的热力学依据是 。
(2)已知反应:NO2+COCO2+NO
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为 (用含K的式子表示)。
②下图是该反应中能量变化示意图。
则CO2和NO反应生成NO2和CO的活化能为 ,NO2和CO反应的热化学方程式为 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③ 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
则C(s,石墨)+2H2(g)===CH4(g) ΔH=_________。
(4)已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
请根据键能数据写出CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式: 。
18.(12分)在2 L密闭容器中,800 ℃时,反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表所示。
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上图中,A点处v正________v逆(填“大于”“小于”或“等于”)。
(2)图中表示NO2变化的曲线是______。平衡时NO的转化率为______。
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a.v(NO2)=2v(O2) b.v逆(NO)=2v正(O2)
c.容器内的密度保持不变 d.容器内压强保持不变
(4)下列措施不能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(5)此反应在三种不同情况下的反应速率分别为:①v(NO)=6mol·L-1·min-1
②v(O2)=4mol·L-1·min-1 ③v(NO2)=0.15 mol·L-1s-1其中反应速率最快的是________(填序号)。
19.(12分)采用如图所示装置模拟工业生产。已知:钾离子交换摸只让钾离子通过分子及其它离子均不能通过。
回答下列问题:
(1)若在A池中实现铁上镀铜,b电极的电极材料为 。
(2)若A池中a、b电极材料均为惰性电极,电解一段时间后,两极均有气体产生,则向溶液中加入 (填化学式)固体可以使溶液恢复到电解前的情况。
(3)B池中,c电极为 极(填“正”或“负”),电极反应式为 。
(4)若在C池中用KCl溶液制取KOH溶液和氯气,高浓度的KOH溶液从
口出(填图中字母),当d电极消耗标准状况下1.12LO2 时,C池中阳极室溶液质量减少 g。
20.(12分)碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1 K2S2O8、0.10mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:S2O82-+2I-===2SO42-+I2(慢) I2+2S2O32-===2I-+S4O62-(快)
回答下列问题:
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的_____耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 2(填“>”“<”“=”)。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 体积/mL
K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液
① 10.0 0.0 4.0 4.0 2.0
② 9.0 1.0 4.0 4.0 2.0
③ 8.0 Vx 4.0 4.0 2.0
表中Vx= mL。若实验①中观察到溶液变蓝的时间为10s,则用Na2S2O3的浓度变化表示的反应速率为 。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)。
高一化学参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.A 2.D 3.C 4.B 5.D 6.C 7.D 8.C 9.B 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.AB 12.CD 13.B 14.B 15.BD
三、非选择题:本题共5小题,共60分。
16.(12分,每空2分)
(1)第3周期第VIA族 (2)NH4NO3 (3) 离子键
(4)NaH+H2O===NaOH+H2 (5)2NH3+6OH――6e-===N2+6H2O
17.(12分,每空2分)
(1) 反应的△H-T△S>0,所以不能自发进行
(2) 368 kJ·mol-1
NO2(g)+ CO(g)===NO(g)+ CO2(g) △H=﹣234 kJ·mol-1
(3)-74.8 kJ·mol-1
(4)CH4(g)+4F2(g) ===CF4(g)+4HF(g) △H=﹣1940 kJ·mol-1
18.(12分,每空2分)
(1)大于 (2)b 65% (3)bd (4)a (5)③
19.(12分,每空2分)
(1)铁 (2)Cu(OH)2
(3)负极 8OH-+CH3OH-6e-===CO32-+6H2O
(4)h 14.9
20.(12分)(1)Na2S2O3 <2 (2)2.0 0.002mol·L-1·s-1
(3)
化学试题
2021.04
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Cl 35.5 K 39
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法正确的是
A.如图,对钢管的防护措施为牺牲阳极保护法
B.硅太阳能电池将化学能转化为电能
C.燃料电池的能量转化率为100%
D. 太阳能、氢能、核能、生物质能、水能都属于新能源
2.下列叙述正确的是
A.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
B.离子化合物中一定有离子键,可能有共价键;非金属单质中一定含有共价键
C.硝酸水溶液中含有H+和NO3-,故HNO3为离子化合物。
D.某化合物熔融状态下能导电,该化合物一定为离子化合物
3.下列有关电解的叙述正确的是
A.工业上用电解熔融NaCl的方法制取Na时,阳极材料可以是石墨或铁
B.可以用电解熔融的 AlCl3 来制取Al
C.工业上电解饱和食盐水制备烧碱,采用阳离子交换膜
D.电解精炼铜时,溶液中铜离子的浓度不变
4.下列叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1则H2的燃烧热为241.8kJ·mol-1
B.己知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
5.下列关于有效碰撞理论以及活化分子的说法中错误的是
A.对有气体参加的化学反应,增大压强,体系体积减小,活化分子总数不变,但单位体积内活化分子数增加,从而反应速率增大
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,可使活化分子的百分数增大,从而反应速率增大
D.加入适宜的催化剂,使分子能量增加,活化分子的百分数大大增加,从而成千上万倍地增大反应速率
6.下列物质中只含离子键的是
A.Na2O2 B. HCl C. Mg3N2 D.Ca(OH)2
7.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H<0,下列叙述正确的是
A.若保持温度和体积不变,充入少量N2使压强增大,反应速率加快
B.单位时间内生成x mol NO,同时消耗x mol NH3时,说明反应达到化学平衡状态
C.达到化学平衡状态时,若升高温度,则正反应速率减小,逆反应速率增大
D.任意时刻,化学反应速率关系:3v正(NH3)=2v正(H2O)
8.已知:2SO2(g) + O2(g)2SO3(g) ΔH ,不同条件下反应过程能量变化
如图所示。下列说法中错误的是
A.反应的ΔH < 0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b反应历程变成两个基元反应,第一个为吸热反应
9.下列装置不能正确完成相关实验是
A B C D
装置
实验 测定中和热 验证铁的活泼性强于铜 结合秒表测量Zn和硫酸反应的速率 验证铁的吸氧腐蚀
10.下面是几种常见的化学电源示意图,有关说法错误的是
A.上述电池分别属于一次电池、二次电池和燃料电池
B.如图所示,干电池使用时电子从锌筒流向石墨电极,再通过电解质到锌筒
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量增重96 g
D.碱性氢氧燃料电池正极的电极反应式为:O2+2H2O+4e-===4OH-
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列关于反应速率与参与反应物质的浓度关系式v=kca(A)? cb(B)的叙述中错误的是
A.对于所有化学反应,k是数值不变的常数
B.a、b是化学方程式中A、B物质的系数
C.对于某个给定的化学反应,k与反应物的浓度无关
D.反应速率与参与反应物质的浓度关系式是通过实验测定的结果,不能随意根据方程式直接写出
12.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯。下列叙述中正确的是
A.电解时精铜作阳极
B.粗铜连接电源的负极
C.电解时阴极上发生的电极反应为Cu2++2e-===Cu
D.电解后,电解槽底部会形成含有少量Ag、Pt等金属的阳极泥
13.高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g)Fe(s)+CO2(g),已知1100℃时K=0.263。下列说法错误的是
A.该反应的平衡常数表达式为
B.平衡后再加入FeO,反应速率会变大
C.若改变条件,使平衡发生移动,平衡常数不一定改变
D.1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时v正大于v逆
14.研究人员研制出一种可快速充放电的超性能铝离子电池,Al、Cn为电极,有机阳离子与阴离子(AlCl4-、Al2Cl7-)组成的离子液体为电解质,该电池放电过程示意图如下。下列说法正确的是
A.充电时,Al电极接外接电源正极
B.充电时,每生成1mol铝,同时消耗4molAl2Cl7-
C.放电时,电解质中的有机阳离子向铝电极方向移动
D.放电时,正极反应式为Cn+AlCl4-—e-===Cn[AlCl4]
15.一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g)4C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.平衡时C的体积分数为40%
C.反应过程中A和B的转化率之比为3∶1
D.从开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
三、非选择题:本题共5小题,共60分。
16.(12分)A、B、D、E、F、G为短周期元素,且原子序数依次增大。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。
回答下列问题:
(1)G在周期表中的位置为 。?
(2)由A、D、E三种元素形成的离子化合物的化学式是 。
(3)F2G的电子式为 ,含有 化学键(填“离子键”或“共价键”)。
(4)由A、F两种元素形成的一种离子化合物X,常温下与水迅速反应生成气体,该反应的化学方程式为 。
(5)D的最简单气态氢化物可用于燃料电池,电池工作时生成无毒物质,工作原理如图所示。该燃料电池的电解质溶液最好选择碱性溶液,则负极电极反应式为 。
17.(12分)能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,△H=+571.68 kJ·mol-1,△H-T△S=+474.38 kJ·mol-1。
则常温下水的分解不能自发进行的热力学依据是 。
(2)已知反应:NO2+COCO2+NO
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为 (用含K的式子表示)。
②下图是该反应中能量变化示意图。
则CO2和NO反应生成NO2和CO的活化能为 ,NO2和CO反应的热化学方程式为 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③ 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
则C(s,石墨)+2H2(g)===CH4(g) ΔH=_________。
(4)已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
请根据键能数据写出CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式: 。
18.(12分)在2 L密闭容器中,800 ℃时,反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表所示。
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上图中,A点处v正________v逆(填“大于”“小于”或“等于”)。
(2)图中表示NO2变化的曲线是______。平衡时NO的转化率为______。
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a.v(NO2)=2v(O2) b.v逆(NO)=2v正(O2)
c.容器内的密度保持不变 d.容器内压强保持不变
(4)下列措施不能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(5)此反应在三种不同情况下的反应速率分别为:①v(NO)=6mol·L-1·min-1
②v(O2)=4mol·L-1·min-1 ③v(NO2)=0.15 mol·L-1s-1其中反应速率最快的是________(填序号)。
19.(12分)采用如图所示装置模拟工业生产。已知:钾离子交换摸只让钾离子通过分子及其它离子均不能通过。
回答下列问题:
(1)若在A池中实现铁上镀铜,b电极的电极材料为 。
(2)若A池中a、b电极材料均为惰性电极,电解一段时间后,两极均有气体产生,则向溶液中加入 (填化学式)固体可以使溶液恢复到电解前的情况。
(3)B池中,c电极为 极(填“正”或“负”),电极反应式为 。
(4)若在C池中用KCl溶液制取KOH溶液和氯气,高浓度的KOH溶液从
口出(填图中字母),当d电极消耗标准状况下1.12LO2 时,C池中阳极室溶液质量减少 g。
20.(12分)碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1 K2S2O8、0.10mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:S2O82-+2I-===2SO42-+I2(慢) I2+2S2O32-===2I-+S4O62-(快)
回答下列问题:
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的_____耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 2(填“>”“<”“=”)。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 体积/mL
K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液
① 10.0 0.0 4.0 4.0 2.0
② 9.0 1.0 4.0 4.0 2.0
③ 8.0 Vx 4.0 4.0 2.0
表中Vx= mL。若实验①中观察到溶液变蓝的时间为10s,则用Na2S2O3的浓度变化表示的反应速率为 。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)。
高一化学参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.A 2.D 3.C 4.B 5.D 6.C 7.D 8.C 9.B 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.AB 12.CD 13.B 14.B 15.BD
三、非选择题:本题共5小题,共60分。
16.(12分,每空2分)
(1)第3周期第VIA族 (2)NH4NO3 (3) 离子键
(4)NaH+H2O===NaOH+H2 (5)2NH3+6OH――6e-===N2+6H2O
17.(12分,每空2分)
(1) 反应的△H-T△S>0,所以不能自发进行
(2) 368 kJ·mol-1
NO2(g)+ CO(g)===NO(g)+ CO2(g) △H=﹣234 kJ·mol-1
(3)-74.8 kJ·mol-1
(4)CH4(g)+4F2(g) ===CF4(g)+4HF(g) △H=﹣1940 kJ·mol-1
18.(12分,每空2分)
(1)大于 (2)b 65% (3)bd (4)a (5)③
19.(12分,每空2分)
(1)铁 (2)Cu(OH)2
(3)负极 8OH-+CH3OH-6e-===CO32-+6H2O
(4)h 14.9
20.(12分)(1)Na2S2O3 <2 (2)2.0 0.002mol·L-1·s-1
(3)
同课章节目录
