安徽省黄山市两校2020-2021学年高一下学期期中联考化学试题 Word版含答案
文档属性
| 名称 | 安徽省黄山市两校2020-2021学年高一下学期期中联考化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 555.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-09 09:27:34 | ||
图片预览



文档简介
屯溪一中、中科大附中2020-2021学年高一年级第二学期期中联考
化学试卷
本试题分选择题和非选择题两部分,满分100分,考试时间100分钟。
注意事项:
1. 答选择题时,必须使用2B铅笔将答题卡上对应题号的答案标号涂黑,如需改动
用橡皮檫干净后,再选涂其它答案标号;
2.答非选择题时,必须使用0.5毫米黑色签字笔将答案书写在答题卡规定的位置上;
3. 考试结束后,将答题卡交回。
可能用到的相对原子质量: C—12 O—16 Ca—40
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合题意)
1.下列自然现象能够产生氮肥的是
A
B
C
D
雷雨天气
冬季雾凇
光照榕树
泥石流
A. A B. B C. C D. D
2.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”。这主要是由于硅及其化合物对社会发展所起的巨大促进作用。下列关于硅及其化合物的说法中错误的是
A.传统无机非金属材料是指:玻璃、水泥、陶瓷等硅酸盐材料
B.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
3.化学科学需要借助化学专用语言来描述,下列有关化学用语表示正确的是
A.F-的结构示意图: B.中子数为10的氧原子为false
C.氯化氢的电子式为 D.H2O与D2O互称同素异形体
4.实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
5.新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下。下列说法错误的是
A.false和false生成false是放热反应
B.在该过程中,false结构不发生变化
C.false和false生成了具有极性共价键的false
D.状态I→状态III表示表示false与false反应的过程
6.下列有关化学反应速率和限度的说法不正确的是
A.实验室用H2O2分解制O2,加MnO2作催化剂后,反应速率明显加快
B.在金属钠与足量水的反应中,增加水的量能加快反应速率
C.反应N2+3H2 2NH3, 3mol H2和1mol N2反应生成的NH3的物质的量小于2mol
D.实验室用锌和盐酸反应制取氢气,用锌粉要比锌粒反应速率快
7.古代诗词中蕴含着许多科学知识,下列叙述正确的是
A.“冰,水为之,而寒于水”说明等质量的水和冰相比,冰的能量更高
B.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
C.曹植《七步诗》“煮豆燃豆萁,豆在釜中泣”,这里的变化只有化学能转化为热能
D.于谦《石灰吟》“千锤万凿出深山,烈火焚烧若等闲”,描述的石灰石煅烧是吸热反应
8.某兴趣小组设计的原电池装置如图所示。该电池工作时,下列说法正确的是
A.锌片为正极 B.碳棒上发生了还原反应
C.电子由碳棒经导线流向锌片 D.H+向锌片移动
9.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是
A.溶液B中发生的反应为2SO2+O2===2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO
D.此工艺的优点之一是物质能循环利用
10.科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是
4288790-5080A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
11.将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的虚线所示。其中正确的是
left87630损失质量
损失质量
损失质量
损失质量
损失质量
损失质量
损失质量
损失质量
0 t 0 t 0 t 0 t
A B C D
12.下列物质有关用途与性质的对应关系错误的是
物质
用途
性质
A
小苏打
用于焙制糕点
小苏打能与碱反应
B
金属钠
用于冶炼钛、锆等金属
金属钠有强还原性
C
二氧化硫
常用于漂白秸秆、织物
SO2能跟其中的有色物质结合
D
浓硫酸
实验室干燥气体
浓硫酸具有吸水性
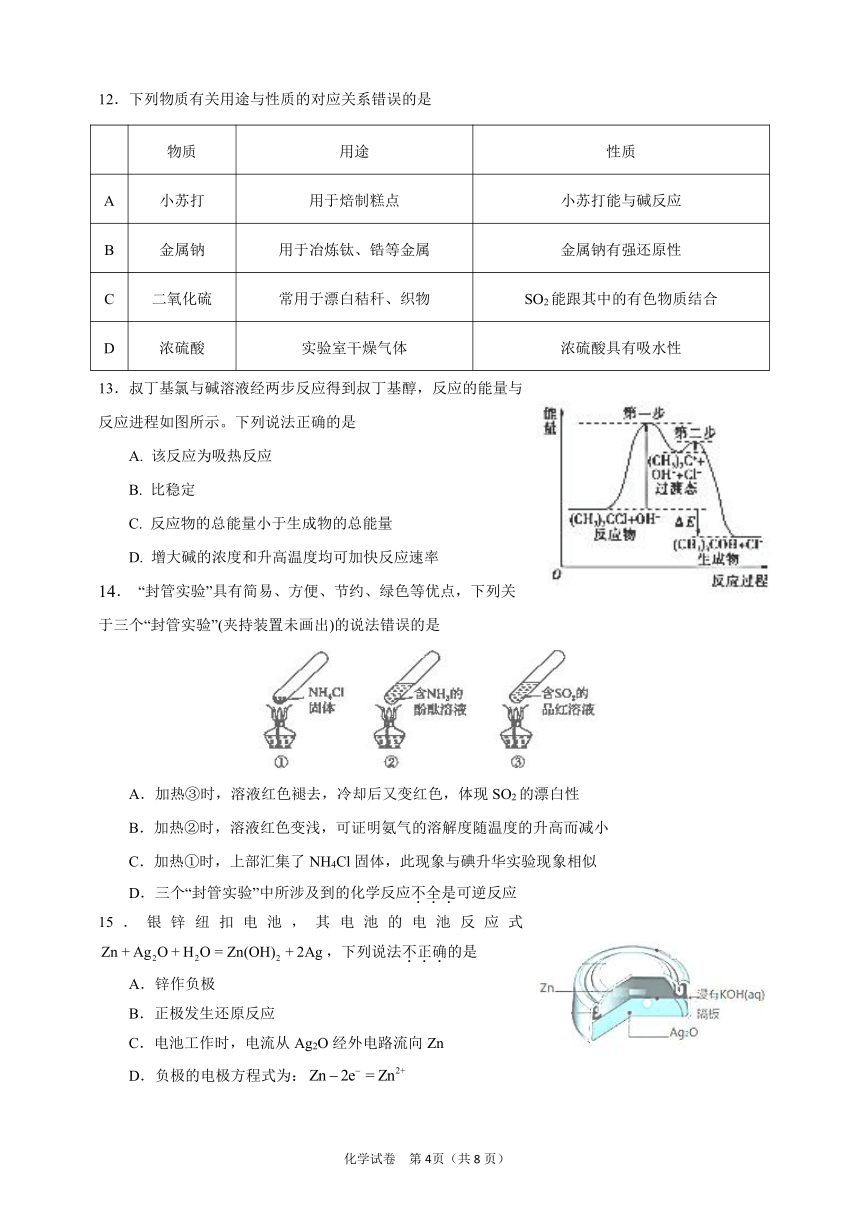
385064026797013.叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应的能量与反应进程如图所示。下列说法正确的是
A. 该反应为吸热反应
B. 比稳定
C. 反应物的总能量小于生成物的总能量
D. 增大碱的浓度和升高温度均可加快反应速率
14. “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是
A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
385064026416015.银锌纽扣电池,其电池的电池反应式false,下列说法不正确的是
A.锌作负极
B.正极发生还原反应
C.电池工作时,电流从Ag2O经外电路流向Zn
D.负极的电极方程式为:false
16. 在通风橱中进行下列实验:
步骤
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法不正确的是
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=NO2
B.Ⅱ中现象因为Fe被浓HNO3氧化,使其表面生成一层氧化膜,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流表,可判断Fe是否被氧化
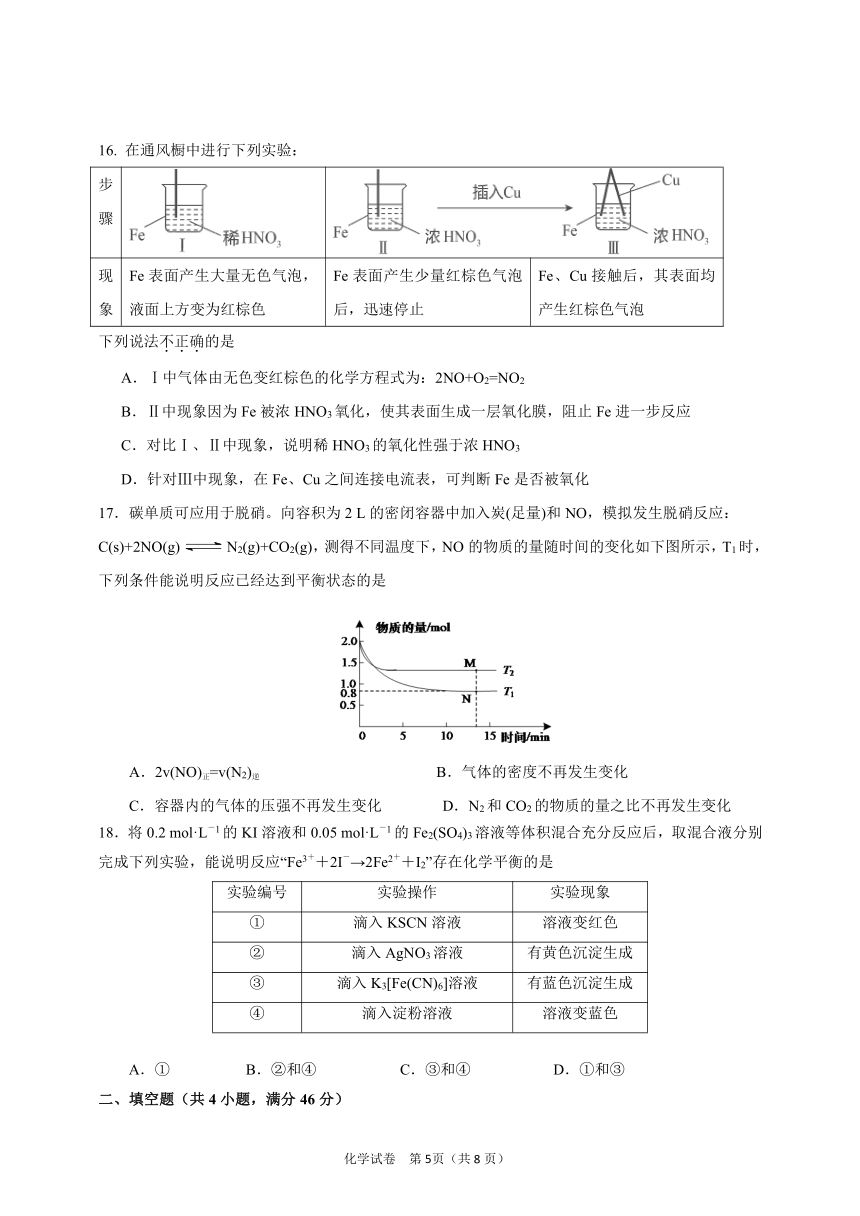
17.碳单质可应用于脱硝。向容积为2 L的密闭容器中加入炭(足量)和NO,模拟发生脱硝反应:C(s)+2NO(g)falseN2(g)+CO2(g),测得不同温度下,NO的物质的量随时间的变化如下图所示,T1时,下列条件能说明反应已经达到平衡状态的是
A.2v(NO)正=v(N2)逆 B.气体的密度不再发生变化
C.容器内的气体的压强不再发生变化 D.N2和CO2的物质的量之比不再发生变化
18.将0.2 mol·L-1的KI溶液和0.05 mol·L-1的Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明反应“Fe3++2I-→2Fe2++I2”存在化学平衡的是
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A.① B.②和④ C.③和④ D.①和③
二、填空题(共4小题,满分46分)
19.(12分)我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有 (写化学式)。
(2)图中物质溶于水溶液呈碱性的是________,请用离子方程式表示呈碱性的原因
_________________________________________________________________。
(3) 工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(4) 实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方程式表示)。
(5) 氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________。
20.(10分)某同学用如图所示做水果电池的实验,测得数据如下表所示:168973530924513970427990
请回答以下问题:
(1)实验⑥中负极的电极反应式为_____________。
(2)实验①、⑤中电流方向相反的原因是_________。
(3)影响水果电池电压的因素有________、________。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”) 。
21.(12分)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
(1)写出A装置中的反应的化学方程式:__________________________________;为除去过量的SO2,C中盛放的试剂为______________。
(2)D中收集到的气体可使带余烬的木条复燃,则B中硬质玻璃管内发生反应的化学方程式为_______________________________________。
(3)有同学认为B中硬质玻璃管内可能还有Na2SO4生成。为检验是否有 Na2SO4生成,他们设计了如下方案:
同学们经过讨论,认为上述方案不合理,指出其不合理的一种理由:
_______________________________ ______;
写出正确的实验方案______________________________________________________________。
22.(12分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
实验编号
0.6 mol·L-1
H2C2O4溶液
H2O
0.2 mol·L-1
KMnO4溶液
3 mol·L-1稀硫酸
1
3.0
2.0
3.0
2.0
4.0
2
3.0
3.0
2.0
2.0
5.2
3
3.0
4.0
1.0
2.0
6.4
请回答下列问题:
(1)根据上表中的实验数据,可以得到的结论是_______________________________________
_______________________________________________________________________________。
(2)利用实验1中数据计算,v(KMnO4)=_____________________________________________。
(3)该化学小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是______________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号
室温下,试管中所加试剂及其用量/mL
再向试管中加入少量固体
室温下溶液颜色褪至无色所需时间/min
0.6 mol·L-1
H2C2O4溶液
H2O
0.2 mol·L-1
KMnO4溶液
3 mol·L-1稀硫酸
4
3.0
2.0
3.0
2.0
t
③若该小组同学提出的假设成立,应观察到的现象是__________________________________
_______________________________________________________________________________。
屯溪一中、中科大附中2020-2021学年高一年级第二学期期中联考
化学参考答案
题号
1
2
3
4
5
6
7
8
9
答案
A
D
A
C
D
B
D
B
D
题号
10
11
12
13
14
15
16
17
18
答案
B
C
A
D
C
D
C
B
A
19.(12分) (1)?N2O5、SO2、SO3?(3分,少一个扣1分,有错不给分)
(2)?NH3?(1分); NH3?H2ONH4++OH-?(2分)
(3)? 4NH3+5O24NO?+6H2O(2分)
(4)??4HNO34NO2↑+O2↑+2H2O(2分)
? (5)4NH3+6NO5N2+6H2O(2分)
20.(10分)Al-3e-=Al3+ (2分) 实验①中锌比铜活泼,锌作负极,实验⑤中铝比锌活泼,锌作正极,两实验中电流方向相反(2分) 水果品种(2分) 电极材料(2分) 合理(2分)
21. (本题共12分)
(1) Na2SO3+H2SO4= Na2SO4 +H2O+SO2↑ (2分)
NaOH溶液(或KMnO4溶液) (合理答案也给分)(2分)
(2)2Na2O2 +2SO2==2Na2SO3+O2 (2分)
(3)稀硝酸能将亚硫酸钡氧化为硫酸钡 或者如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根; (3分)
取少量固体溶于水,往溶液中加入盐酸酸化,再加入BaCl2溶液,观察溶液中是否生成白色沉淀。(3分)
22. (本题共12分)(1)其他条件相同时,增大KMnO4溶液浓度(或反应物浓度),反应速率增大(2分)
(2)1.5×10-2 mol·L-1·min-1(3分)
(3)①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) (2分)
②MnSO4(2分)
③与实验1比较,溶液褪色所需时间更短[或所用时间t小于4.0 min及其他合理答案] (3分)
化学试卷
本试题分选择题和非选择题两部分,满分100分,考试时间100分钟。
注意事项:
1. 答选择题时,必须使用2B铅笔将答题卡上对应题号的答案标号涂黑,如需改动
用橡皮檫干净后,再选涂其它答案标号;
2.答非选择题时,必须使用0.5毫米黑色签字笔将答案书写在答题卡规定的位置上;
3. 考试结束后,将答题卡交回。
可能用到的相对原子质量: C—12 O—16 Ca—40
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合题意)
1.下列自然现象能够产生氮肥的是
A
B
C
D
雷雨天气
冬季雾凇
光照榕树
泥石流
A. A B. B C. C D. D
2.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”。这主要是由于硅及其化合物对社会发展所起的巨大促进作用。下列关于硅及其化合物的说法中错误的是
A.传统无机非金属材料是指:玻璃、水泥、陶瓷等硅酸盐材料
B.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
3.化学科学需要借助化学专用语言来描述,下列有关化学用语表示正确的是
A.F-的结构示意图: B.中子数为10的氧原子为false
C.氯化氢的电子式为 D.H2O与D2O互称同素异形体
4.实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
5.新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下。下列说法错误的是
A.false和false生成false是放热反应
B.在该过程中,false结构不发生变化
C.false和false生成了具有极性共价键的false
D.状态I→状态III表示表示false与false反应的过程
6.下列有关化学反应速率和限度的说法不正确的是
A.实验室用H2O2分解制O2,加MnO2作催化剂后,反应速率明显加快
B.在金属钠与足量水的反应中,增加水的量能加快反应速率
C.反应N2+3H2 2NH3, 3mol H2和1mol N2反应生成的NH3的物质的量小于2mol
D.实验室用锌和盐酸反应制取氢气,用锌粉要比锌粒反应速率快
7.古代诗词中蕴含着许多科学知识,下列叙述正确的是
A.“冰,水为之,而寒于水”说明等质量的水和冰相比,冰的能量更高
B.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
C.曹植《七步诗》“煮豆燃豆萁,豆在釜中泣”,这里的变化只有化学能转化为热能
D.于谦《石灰吟》“千锤万凿出深山,烈火焚烧若等闲”,描述的石灰石煅烧是吸热反应
8.某兴趣小组设计的原电池装置如图所示。该电池工作时,下列说法正确的是
A.锌片为正极 B.碳棒上发生了还原反应
C.电子由碳棒经导线流向锌片 D.H+向锌片移动
9.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是
A.溶液B中发生的反应为2SO2+O2===2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO
D.此工艺的优点之一是物质能循环利用
10.科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是
4288790-5080A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
11.将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的虚线所示。其中正确的是
left87630损失质量
损失质量
损失质量
损失质量
损失质量
损失质量
损失质量
损失质量
0 t 0 t 0 t 0 t
A B C D
12.下列物质有关用途与性质的对应关系错误的是
物质
用途
性质
A
小苏打
用于焙制糕点
小苏打能与碱反应
B
金属钠
用于冶炼钛、锆等金属
金属钠有强还原性
C
二氧化硫
常用于漂白秸秆、织物
SO2能跟其中的有色物质结合
D
浓硫酸
实验室干燥气体
浓硫酸具有吸水性
385064026797013.叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应的能量与反应进程如图所示。下列说法正确的是
A. 该反应为吸热反应
B. 比稳定
C. 反应物的总能量小于生成物的总能量
D. 增大碱的浓度和升高温度均可加快反应速率
14. “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是
A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
385064026416015.银锌纽扣电池,其电池的电池反应式false,下列说法不正确的是
A.锌作负极
B.正极发生还原反应
C.电池工作时,电流从Ag2O经外电路流向Zn
D.负极的电极方程式为:false
16. 在通风橱中进行下列实验:
步骤
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法不正确的是
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=NO2
B.Ⅱ中现象因为Fe被浓HNO3氧化,使其表面生成一层氧化膜,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流表,可判断Fe是否被氧化
17.碳单质可应用于脱硝。向容积为2 L的密闭容器中加入炭(足量)和NO,模拟发生脱硝反应:C(s)+2NO(g)falseN2(g)+CO2(g),测得不同温度下,NO的物质的量随时间的变化如下图所示,T1时,下列条件能说明反应已经达到平衡状态的是
A.2v(NO)正=v(N2)逆 B.气体的密度不再发生变化
C.容器内的气体的压强不再发生变化 D.N2和CO2的物质的量之比不再发生变化
18.将0.2 mol·L-1的KI溶液和0.05 mol·L-1的Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明反应“Fe3++2I-→2Fe2++I2”存在化学平衡的是
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A.① B.②和④ C.③和④ D.①和③
二、填空题(共4小题,满分46分)
19.(12分)我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有 (写化学式)。
(2)图中物质溶于水溶液呈碱性的是________,请用离子方程式表示呈碱性的原因
_________________________________________________________________。
(3) 工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(4) 实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方程式表示)。
(5) 氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________。
20.(10分)某同学用如图所示做水果电池的实验,测得数据如下表所示:168973530924513970427990
请回答以下问题:
(1)实验⑥中负极的电极反应式为_____________。
(2)实验①、⑤中电流方向相反的原因是_________。
(3)影响水果电池电压的因素有________、________。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”) 。
21.(12分)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
(1)写出A装置中的反应的化学方程式:__________________________________;为除去过量的SO2,C中盛放的试剂为______________。
(2)D中收集到的气体可使带余烬的木条复燃,则B中硬质玻璃管内发生反应的化学方程式为_______________________________________。
(3)有同学认为B中硬质玻璃管内可能还有Na2SO4生成。为检验是否有 Na2SO4生成,他们设计了如下方案:
同学们经过讨论,认为上述方案不合理,指出其不合理的一种理由:
_______________________________ ______;
写出正确的实验方案______________________________________________________________。
22.(12分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
实验编号
0.6 mol·L-1
H2C2O4溶液
H2O
0.2 mol·L-1
KMnO4溶液
3 mol·L-1稀硫酸
1
3.0
2.0
3.0
2.0
4.0
2
3.0
3.0
2.0
2.0
5.2
3
3.0
4.0
1.0
2.0
6.4
请回答下列问题:
(1)根据上表中的实验数据,可以得到的结论是_______________________________________
_______________________________________________________________________________。
(2)利用实验1中数据计算,v(KMnO4)=_____________________________________________。
(3)该化学小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是______________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号
室温下,试管中所加试剂及其用量/mL
再向试管中加入少量固体
室温下溶液颜色褪至无色所需时间/min
0.6 mol·L-1
H2C2O4溶液
H2O
0.2 mol·L-1
KMnO4溶液
3 mol·L-1稀硫酸
4
3.0
2.0
3.0
2.0
t
③若该小组同学提出的假设成立,应观察到的现象是__________________________________
_______________________________________________________________________________。
屯溪一中、中科大附中2020-2021学年高一年级第二学期期中联考
化学参考答案
题号
1
2
3
4
5
6
7
8
9
答案
A
D
A
C
D
B
D
B
D
题号
10
11
12
13
14
15
16
17
18
答案
B
C
A
D
C
D
C
B
A
19.(12分) (1)?N2O5、SO2、SO3?(3分,少一个扣1分,有错不给分)
(2)?NH3?(1分); NH3?H2ONH4++OH-?(2分)
(3)? 4NH3+5O24NO?+6H2O(2分)
(4)??4HNO34NO2↑+O2↑+2H2O(2分)
? (5)4NH3+6NO5N2+6H2O(2分)
20.(10分)Al-3e-=Al3+ (2分) 实验①中锌比铜活泼,锌作负极,实验⑤中铝比锌活泼,锌作正极,两实验中电流方向相反(2分) 水果品种(2分) 电极材料(2分) 合理(2分)
21. (本题共12分)
(1) Na2SO3+H2SO4= Na2SO4 +H2O+SO2↑ (2分)
NaOH溶液(或KMnO4溶液) (合理答案也给分)(2分)
(2)2Na2O2 +2SO2==2Na2SO3+O2 (2分)
(3)稀硝酸能将亚硫酸钡氧化为硫酸钡 或者如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根; (3分)
取少量固体溶于水,往溶液中加入盐酸酸化,再加入BaCl2溶液,观察溶液中是否生成白色沉淀。(3分)
22. (本题共12分)(1)其他条件相同时,增大KMnO4溶液浓度(或反应物浓度),反应速率增大(2分)
(2)1.5×10-2 mol·L-1·min-1(3分)
(3)①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) (2分)
②MnSO4(2分)
③与实验1比较,溶液褪色所需时间更短[或所用时间t小于4.0 min及其他合理答案] (3分)
同课章节目录
