高中化学苏教版(2019)选择性必修3专题3石油化工的基础物质——烃单元练习 含答案
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修3专题3石油化工的基础物质——烃单元练习 含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 241.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-10 21:28:39 | ||
图片预览


文档简介
苏教版(2019)高中化学选择性必修3专题3石油化工的基础物质——烃单元练习
一、单选题
1.设NA为阿伏加德罗常数的值。化合物X(CH2=CH-CH=CH2)与相同物质的量的Cl2发生反应生成产物Y,下列说法正确的是
A.标准状况下,35.5
g氯气中含有质子数目为34NA
B.标准状况下,22.4
L化合物X中含有的碳原子数为4NA
C.产物Y的结构简式一定为ClCH2CH=CHCH2Cl
D.产物Y发生加聚反应的产物能使酸性高锰酸钾溶液褪色
2.在下,测得某些烷烃的沸点见下表.据表分析,下列说法不正确的是(
)
物质
沸点(℃)
正丁烷
正戊烷
36.1
异戊烷
27.8
新戊烷
9.5
正己烷
69.0
A.标准状况下,正丁烷是气体
B.烷烃随碳原子数的增加,沸点升高
C.常温常压下,都是液体
D.随着支链数的增加,沸点降低
3.除去乙烷中混有的少量的乙烯,最合理的方法是(
)
A.通入H2使之发生反应
B.通过盛有足量酸性KMnO4溶液的洗气瓶
C.通入NaOH溶液的洗气瓶
D.通过盛有足量溴水的洗气瓶
4.关于化合物(b),(d),(p)的下列说法正确的是(
)
A.b、d都属于芳香烃,且互为同分异构体
B.b、d均有3种一氯代物
C.b、p最多都可有6个原子处于同一直线
D.d、p最少都可有10个碳原子处于同一平面
5.《本草纲目》记载了民间酿酒工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。以上用到的实验方法可应用于分离(
)
A.氯化铵和碳酸铵
B.苯和溴苯
C.CCl4和硫酸钠溶液
D.硝酸钾和氯化钠的混合物
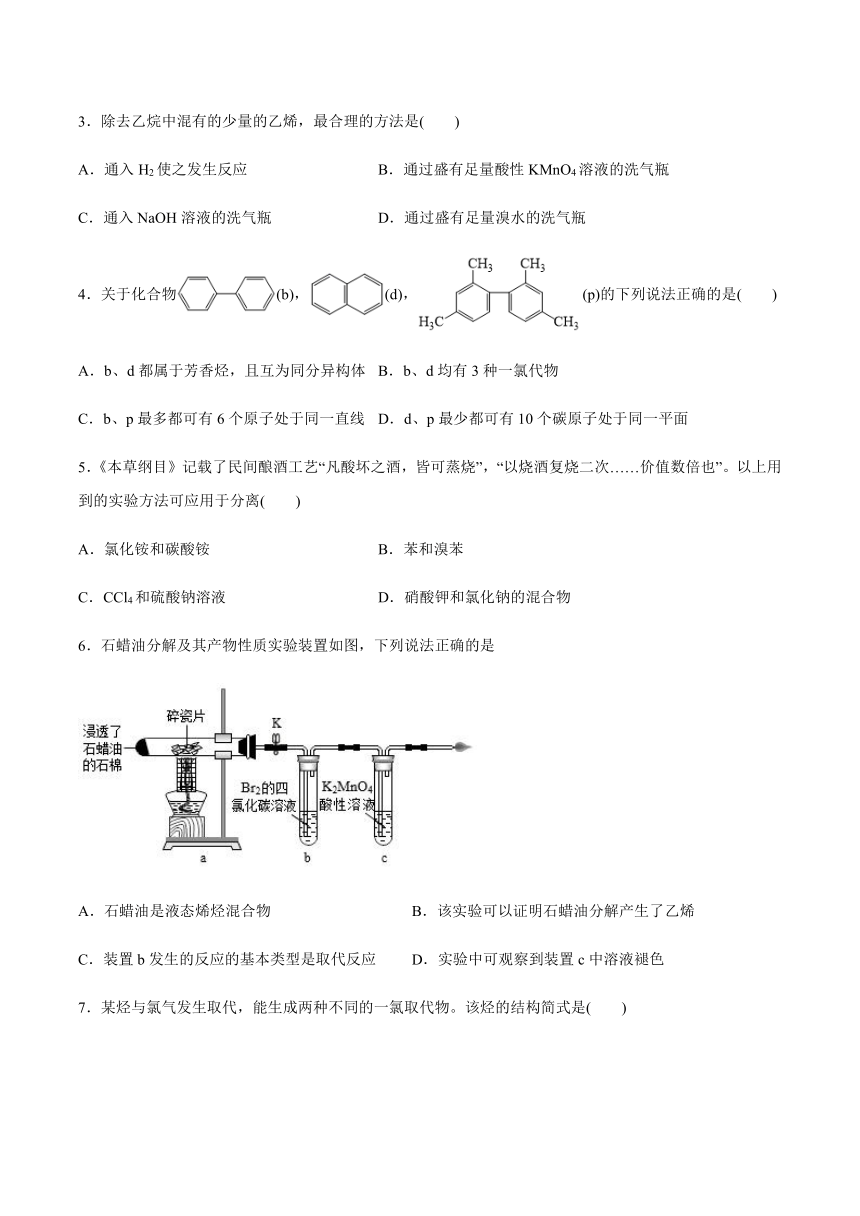
6.石蜡油分解及其产物性质实验装置如图,下列说法正确的是
A.石蜡油是液态烯烃混合物
B.该实验可以证明石蜡油分解产生了乙烯
C.装置b发生的反应的基本类型是取代反应
D.实验中可观察到装置c中溶液褪色
7.某烃与氯气发生取代,能生成两种不同的一氯取代物。该烃的结构简式是(
)
A.
B.CH3CH2CH2CH2CH3
C.
D.
8.下列关于乙炔的物理性质的说法不正确的是(
)
A.乙炔和乙烯一样,是无色气体
B.乙炔和乙烯一样,密度和空气接近
C.乙炔和乙烯一样都微溶于水
D.乙炔和乙烯一样,没有强烈的气味
9.某烯烃氢化后得到的烃是,该烃可能有的结构简式有(
)
A.1种
B.2种
C.3种
D.4种
10.下列有机化合物能使酸性高锰酸钾溶液褪色的是
A.
B.
C.
D.
11.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
A.甲苯燃烧生成CO2
B.甲苯与硝酸发生反应生成TNT
C.甲苯能使酸性KMnO4溶液褪色
D.光照下甲苯与Br2在侧链上发生取代反应
12.下列有机物中一定属于苯的同系物的是
A.C7H8
B.
C.
D.
13.除去乙烷中混有的少量乙炔,正确的方法是
A.将混合气体通入澄清石灰水
B.将混合气体通入碱石灰
C.将混合气体通入浓硫酸
D.将混合气体通入溴水
14.乙烷、乙烯、乙炔共同具有的性质是(
)
A.都难溶于水,且密度比水小
B.都能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
15.已知C—C单键可以绕键轴旋转,某烃的结构简式如图,下列说法中正确的是
A.该有机物的分子式是C14H18
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯代物最多有4种
D.该烃是苯的同系物,能使酸性高锰酸钾褪色
二、填空题
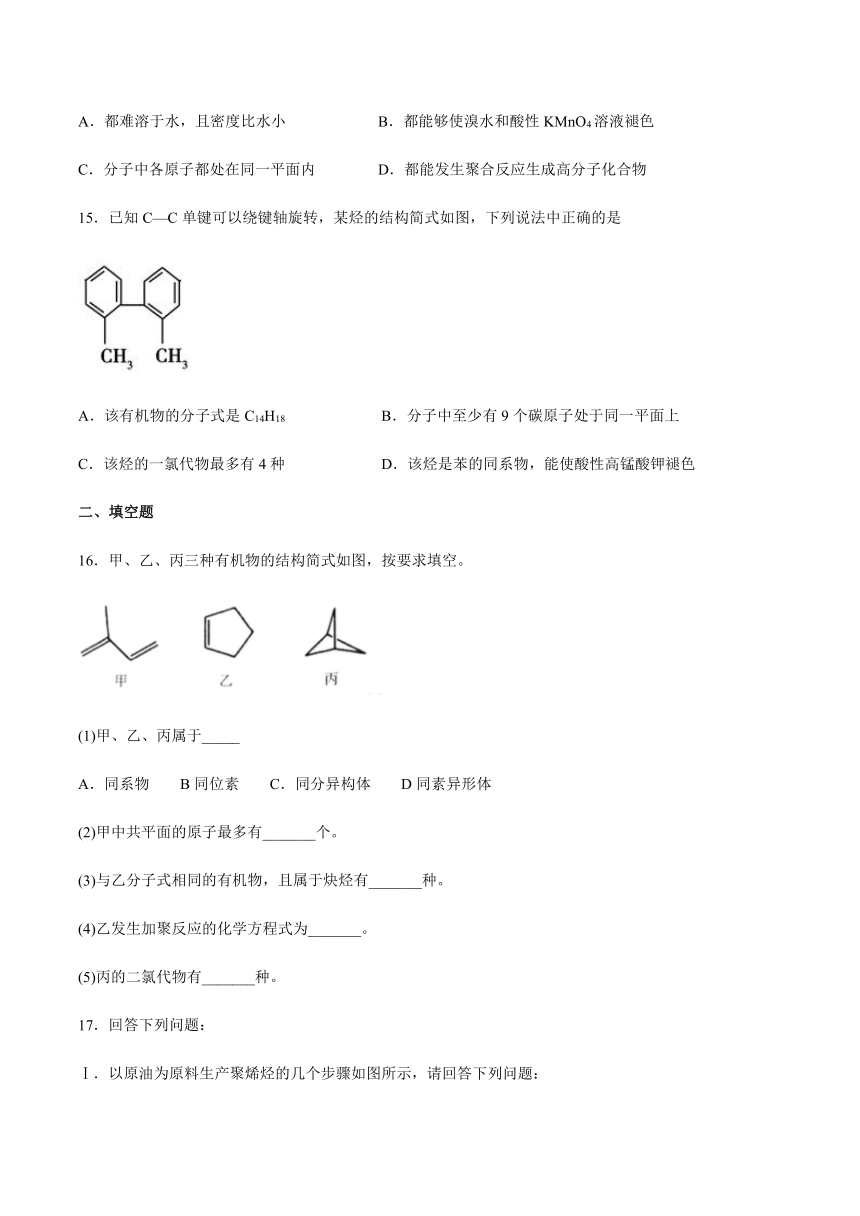
16.甲、乙、丙三种有机物的结构简式如图,按要求填空。
(1)甲、乙、丙属于_____
A.同系物
B同位素
C.同分异构体
D同素异形体
(2)甲中共平面的原子最多有_______个。
(3)与乙分子式相同的有机物,且属于炔烃有_______种。
(4)乙发生加聚反应的化学方程式为_______。
(5)丙的二氯代物有_______种。
17.回答下列问题:
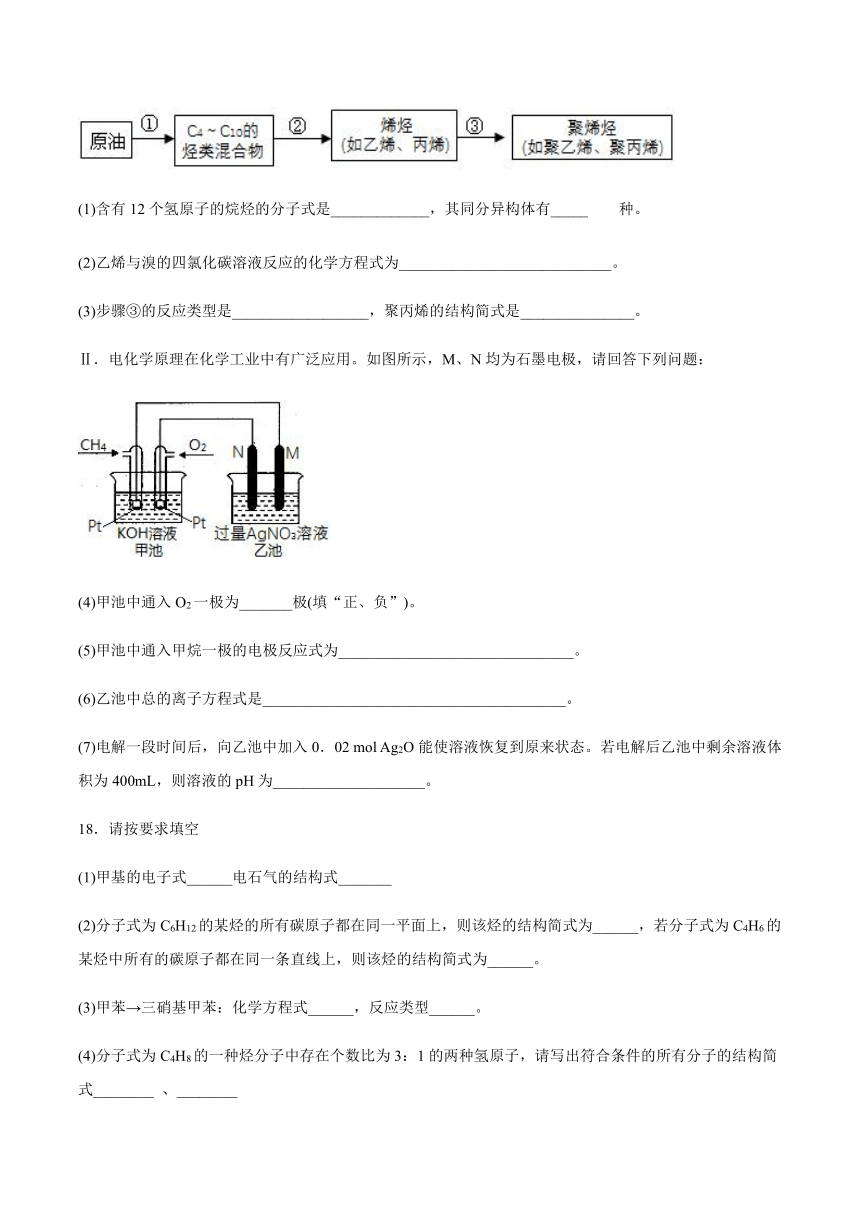
Ⅰ.以原油为原料生产聚烯烃的几个步骤如图所示,请回答下列问题:
(1)含有12个氢原子的烷烃的分子式是_____________,其同分异构体有_____种。
(2)乙烯与溴的四氯化碳溶液反应的化学方程式为____________________________。
(3)步骤③的反应类型是__________________,聚丙烯的结构简式是_______________。
Ⅱ.电化学原理在化学工业中有广泛应用。如图所示,M、N均为石墨电极,请回答下列问题:
(4)甲池中通入O2一极为_______极(填“正、负”)。
(5)甲池中通入甲烷一极的电极反应式为_______________________________。
(6)乙池中总的离子方程式是________________________________________。
(7)电解一段时间后,向乙池中加入0.02
mol
Ag2O能使溶液恢复到原来状态。若电解后乙池中剩余溶液体积为400mL,则溶液的pH为____________________。
18.请按要求填空
(1)甲基的电子式______电石气的结构式_______
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______。
(3)甲苯→三硝基甲苯:化学方程式______,反应类型______。
(4)分子式为C4H8的一种烃分子中存在个数比为3:1的两种氢原子,请写出符合条件的所有分子的结构简式________
、________
(5)已知:+,如果要合成所用的原始原料可以是____
A.2,3-二甲基-1,3-戊二烯和乙炔
B.
2-甲基-l,3-丁二烯和2-丁炔
C.2,3-二甲基-l,3-丁二烯和丙炔
D.1,3-戊二烯和2-丁炔
19.100多年前,“化学守护神”德国化学家李比希发现了一种至今仍在临床使用的催眠药(化合物IV)。由源自石油的基本化工原料I合成化合物IV的一种途径为:
(1)由化合物I合成化合物II的反应类型为____________。
(2)下列关于化合物I和化合物II的说法正确的有________(填字母)。
A.化合物I可以作为植物生长调节剂
B.化合物I能发生加聚反应,不能使酸性KMnO4溶液褪色
C.化合物II能发生酯化反应
D.化合物II不能与金属Na反应
(3)由化合物III合成化合物IV的反应的原子利用率为100%,则除化合物III外,另一种反应物是________。
(4)化合物I含有的官能团是______(填名称),化合物II与IV都含有的官能团是______(填名称),化合物IV的分子式为__________。
20.丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化后得到2-甲基丙烷。完成下列填空:
(1)A可以发生加聚反应,写出反应方程式__________________________
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水:________________________________________________;
A通入溴的四氯化碳溶液:_________________________
(3)烯烃和NBS作用,烯烃中与双键碳相邻碳原子上的一个氢原子被溴原子取代。分子式为C4H8的烃和NBS作用,得到的一溴代烯烃有________种。
三、实验题
21.实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验让混合气体依次通过Ⅰ、Ⅱ、Ⅲ、Ⅳ四个装置,以确认上述混合气体中有乙烯和二氧化硫。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂(将下列有关试剂的序号填入空格内)。是:
Ⅰ___________;Ⅱ___________;Ⅲ___________;Ⅳ___________
A.品红溶液
B.NaOH(aq)
C.浓H2SO4
D.酸性KMnO4(aq)
(2)能说明二氧化硫气体存在的现象是_________________。
(3)使用装置Ⅱ的目的是___________________________。
(4)使用装置Ⅲ的目的是____________________________。
(5)确证含有乙烯的现象是________________________
22.实验室常用如图装置制取乙烯,反应原理为CH3CH2OHCH2CH2↑+H2O,某化学学习小组通过该原理制取乙烯并对其性质进行验证。
(1)在制取时,常常需要在烧瓶中加入碎瓷片,目的是______。
(2)制取时,关键要控制好温度。
①温度过高而发生副反应,生成________、________、水蒸气和炭黑。为了除水蒸气外的杂质气体,常用装有下列试剂的洗气瓶进行洗气,则应选用的试剂是____。
A.酸性KMnO4溶液B.浓硫酸C.NaOH溶液D.溴水
②要检验除水蒸气外的气体生成物,应该首先检验______,常选用的药品为______。
(3)制取时温度过低,在140℃时主要发生分子间取代反应生成乙醚(CH3CH2OCH2CH3),试写出其反应方程式:______________________________________________。
23.利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:
根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
参考答案
1.B2.C3.D4.C5.B6.D7.D8.C9.B10.B11.B12.B13.D14.A15.B
16.C
11
3
n
4
17.C5H12
3
加聚反应
正
1
18.
H-C≡C-H
(CH3)2C=C(CH3)2
CH3C≡CCH3
+3HO-NO2+3H2O
取代反应
CH3-CH=CH-CH3
BC
19.加成反应
AC
水
碳碳双键
羟基
C2H3O2Cl3
20.和
红棕色褪去,且溶液分层
红棕色褪去,互溶不分层
3
21.A
B
A
D
Ⅰ中品红溶液褪色
除去二氧化硫和挥发出来的乙醇
检验二氧化硫是否除尽
Ⅲ中品红溶液不褪色,Ⅳ中酸性高锰酸钾溶液褪色。
22.防止液体暴沸
CO2
SO2
C
SO2
品红溶液
2CH3CH2OH=CH3CH2OCH2CH3+H2O
23.分液漏斗
MnO2+4H++2ClMn2++Cl2↑+2H2O
干燥甲烷
不能,生成的HCl会被碱石灰吸收
CD
分液
一、单选题
1.设NA为阿伏加德罗常数的值。化合物X(CH2=CH-CH=CH2)与相同物质的量的Cl2发生反应生成产物Y,下列说法正确的是
A.标准状况下,35.5
g氯气中含有质子数目为34NA
B.标准状况下,22.4
L化合物X中含有的碳原子数为4NA
C.产物Y的结构简式一定为ClCH2CH=CHCH2Cl
D.产物Y发生加聚反应的产物能使酸性高锰酸钾溶液褪色
2.在下,测得某些烷烃的沸点见下表.据表分析,下列说法不正确的是(
)
物质
沸点(℃)
正丁烷
正戊烷
36.1
异戊烷
27.8
新戊烷
9.5
正己烷
69.0
A.标准状况下,正丁烷是气体
B.烷烃随碳原子数的增加,沸点升高
C.常温常压下,都是液体
D.随着支链数的增加,沸点降低
3.除去乙烷中混有的少量的乙烯,最合理的方法是(
)
A.通入H2使之发生反应
B.通过盛有足量酸性KMnO4溶液的洗气瓶
C.通入NaOH溶液的洗气瓶
D.通过盛有足量溴水的洗气瓶
4.关于化合物(b),(d),(p)的下列说法正确的是(
)
A.b、d都属于芳香烃,且互为同分异构体
B.b、d均有3种一氯代物
C.b、p最多都可有6个原子处于同一直线
D.d、p最少都可有10个碳原子处于同一平面
5.《本草纲目》记载了民间酿酒工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。以上用到的实验方法可应用于分离(
)
A.氯化铵和碳酸铵
B.苯和溴苯
C.CCl4和硫酸钠溶液
D.硝酸钾和氯化钠的混合物
6.石蜡油分解及其产物性质实验装置如图,下列说法正确的是
A.石蜡油是液态烯烃混合物
B.该实验可以证明石蜡油分解产生了乙烯
C.装置b发生的反应的基本类型是取代反应
D.实验中可观察到装置c中溶液褪色
7.某烃与氯气发生取代,能生成两种不同的一氯取代物。该烃的结构简式是(
)
A.
B.CH3CH2CH2CH2CH3
C.
D.
8.下列关于乙炔的物理性质的说法不正确的是(
)
A.乙炔和乙烯一样,是无色气体
B.乙炔和乙烯一样,密度和空气接近
C.乙炔和乙烯一样都微溶于水
D.乙炔和乙烯一样,没有强烈的气味
9.某烯烃氢化后得到的烃是,该烃可能有的结构简式有(
)
A.1种
B.2种
C.3种
D.4种
10.下列有机化合物能使酸性高锰酸钾溶液褪色的是
A.
B.
C.
D.
11.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
A.甲苯燃烧生成CO2
B.甲苯与硝酸发生反应生成TNT
C.甲苯能使酸性KMnO4溶液褪色
D.光照下甲苯与Br2在侧链上发生取代反应
12.下列有机物中一定属于苯的同系物的是
A.C7H8
B.
C.
D.
13.除去乙烷中混有的少量乙炔,正确的方法是
A.将混合气体通入澄清石灰水
B.将混合气体通入碱石灰
C.将混合气体通入浓硫酸
D.将混合气体通入溴水
14.乙烷、乙烯、乙炔共同具有的性质是(
)
A.都难溶于水,且密度比水小
B.都能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
15.已知C—C单键可以绕键轴旋转,某烃的结构简式如图,下列说法中正确的是
A.该有机物的分子式是C14H18
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯代物最多有4种
D.该烃是苯的同系物,能使酸性高锰酸钾褪色
二、填空题
16.甲、乙、丙三种有机物的结构简式如图,按要求填空。
(1)甲、乙、丙属于_____
A.同系物
B同位素
C.同分异构体
D同素异形体
(2)甲中共平面的原子最多有_______个。
(3)与乙分子式相同的有机物,且属于炔烃有_______种。
(4)乙发生加聚反应的化学方程式为_______。
(5)丙的二氯代物有_______种。
17.回答下列问题:
Ⅰ.以原油为原料生产聚烯烃的几个步骤如图所示,请回答下列问题:
(1)含有12个氢原子的烷烃的分子式是_____________,其同分异构体有_____种。
(2)乙烯与溴的四氯化碳溶液反应的化学方程式为____________________________。
(3)步骤③的反应类型是__________________,聚丙烯的结构简式是_______________。
Ⅱ.电化学原理在化学工业中有广泛应用。如图所示,M、N均为石墨电极,请回答下列问题:
(4)甲池中通入O2一极为_______极(填“正、负”)。
(5)甲池中通入甲烷一极的电极反应式为_______________________________。
(6)乙池中总的离子方程式是________________________________________。
(7)电解一段时间后,向乙池中加入0.02
mol
Ag2O能使溶液恢复到原来状态。若电解后乙池中剩余溶液体积为400mL,则溶液的pH为____________________。
18.请按要求填空
(1)甲基的电子式______电石气的结构式_______
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______。
(3)甲苯→三硝基甲苯:化学方程式______,反应类型______。
(4)分子式为C4H8的一种烃分子中存在个数比为3:1的两种氢原子,请写出符合条件的所有分子的结构简式________
、________
(5)已知:+,如果要合成所用的原始原料可以是____
A.2,3-二甲基-1,3-戊二烯和乙炔
B.
2-甲基-l,3-丁二烯和2-丁炔
C.2,3-二甲基-l,3-丁二烯和丙炔
D.1,3-戊二烯和2-丁炔
19.100多年前,“化学守护神”德国化学家李比希发现了一种至今仍在临床使用的催眠药(化合物IV)。由源自石油的基本化工原料I合成化合物IV的一种途径为:
(1)由化合物I合成化合物II的反应类型为____________。
(2)下列关于化合物I和化合物II的说法正确的有________(填字母)。
A.化合物I可以作为植物生长调节剂
B.化合物I能发生加聚反应,不能使酸性KMnO4溶液褪色
C.化合物II能发生酯化反应
D.化合物II不能与金属Na反应
(3)由化合物III合成化合物IV的反应的原子利用率为100%,则除化合物III外,另一种反应物是________。
(4)化合物I含有的官能团是______(填名称),化合物II与IV都含有的官能团是______(填名称),化合物IV的分子式为__________。
20.丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化后得到2-甲基丙烷。完成下列填空:
(1)A可以发生加聚反应,写出反应方程式__________________________
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水:________________________________________________;
A通入溴的四氯化碳溶液:_________________________
(3)烯烃和NBS作用,烯烃中与双键碳相邻碳原子上的一个氢原子被溴原子取代。分子式为C4H8的烃和NBS作用,得到的一溴代烯烃有________种。
三、实验题
21.实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验让混合气体依次通过Ⅰ、Ⅱ、Ⅲ、Ⅳ四个装置,以确认上述混合气体中有乙烯和二氧化硫。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂(将下列有关试剂的序号填入空格内)。是:
Ⅰ___________;Ⅱ___________;Ⅲ___________;Ⅳ___________
A.品红溶液
B.NaOH(aq)
C.浓H2SO4
D.酸性KMnO4(aq)
(2)能说明二氧化硫气体存在的现象是_________________。
(3)使用装置Ⅱ的目的是___________________________。
(4)使用装置Ⅲ的目的是____________________________。
(5)确证含有乙烯的现象是________________________
22.实验室常用如图装置制取乙烯,反应原理为CH3CH2OHCH2CH2↑+H2O,某化学学习小组通过该原理制取乙烯并对其性质进行验证。
(1)在制取时,常常需要在烧瓶中加入碎瓷片,目的是______。
(2)制取时,关键要控制好温度。
①温度过高而发生副反应,生成________、________、水蒸气和炭黑。为了除水蒸气外的杂质气体,常用装有下列试剂的洗气瓶进行洗气,则应选用的试剂是____。
A.酸性KMnO4溶液B.浓硫酸C.NaOH溶液D.溴水
②要检验除水蒸气外的气体生成物,应该首先检验______,常选用的药品为______。
(3)制取时温度过低,在140℃时主要发生分子间取代反应生成乙醚(CH3CH2OCH2CH3),试写出其反应方程式:______________________________________________。
23.利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:
根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
参考答案
1.B2.C3.D4.C5.B6.D7.D8.C9.B10.B11.B12.B13.D14.A15.B
16.C
11
3
n
4
17.C5H12
3
加聚反应
正
1
18.
H-C≡C-H
(CH3)2C=C(CH3)2
CH3C≡CCH3
+3HO-NO2+3H2O
取代反应
CH3-CH=CH-CH3
BC
19.加成反应
AC
水
碳碳双键
羟基
C2H3O2Cl3
20.和
红棕色褪去,且溶液分层
红棕色褪去,互溶不分层
3
21.A
B
A
D
Ⅰ中品红溶液褪色
除去二氧化硫和挥发出来的乙醇
检验二氧化硫是否除尽
Ⅲ中品红溶液不褪色,Ⅳ中酸性高锰酸钾溶液褪色。
22.防止液体暴沸
CO2
SO2
C
SO2
品红溶液
2CH3CH2OH=CH3CH2OCH2CH3+H2O
23.分液漏斗
MnO2+4H++2ClMn2++Cl2↑+2H2O
干燥甲烷
不能,生成的HCl会被碱石灰吸收
CD
分液
