江西师大附属高中2020-2021学年高一下学期4月月考化学试题 Word版含答案
文档属性
| 名称 | 江西师大附属高中2020-2021学年高一下学期4月月考化学试题 Word版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-10 00:00:00 | ||
图片预览


文档简介
江西师大附中高一年级化学4月月考试卷
2021.4
相对原子质量:H:1 Li:7 C:12 N:14 O:16 Mg:24 S:32 Cl:35.5 Fe:56 Cu:64 Ba:137
第 Ⅰ 卷
1、明代《造强水法》记载“绿矾五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,锅下起火,取气冷定,开坛则药化为水。用水入五金皆成水,惟黄金不化水中。”“硝”即硝酸钾。下列说法错误的是 ( )
A.“绿矾”的成分为FeSO4?7H2O
B.“研细”可在蒸发皿中进行
C.“开坛则药化为水”,“水”的主要成分是硝酸
D.“五金皆成水”,发生氧化还原反应
2、发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生的大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟。产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
3、下列化合物中,阴离子半径与阳离子半径之比最小的是
A.LiI B.NaBr C.KCl D.CsF
4、根据元素周期律,由事实进行归纳推测,下列事实或推测不合理的是( )
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(第ⅡA族元素)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素都是半导体材料
C
HCl在1 500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
5、莫尔盐也叫硫酸亚铁铵,是一种重要的化工原料,可作净水剂。在不同温度下其分解产物不同,下图为 500 ℃时隔绝空气加热,探究其分解生成的气体产物的装置。下列说法不正确的是( )
A.乙装置的干燥管盛装无水硫酸铜检验分解产物中可能含有的水
B.丙中浓盐酸检验可能的分解产物NH3,浓盐酸可用浓硝酸代替
C.若分解产物有SO2,无SO3,则丁装置中无现象,戊装置中有白色沉淀生成
D.己装置吸收实验尾气,防止酸性气体对环境造成污染
6、长征2号火箭承担运载“神六”的 使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是( )
A.LiH、LiD、LiT的摩尔质量之比为1∶2∶3 B.它们都是强氧化剂
C.H、D、T之间互称为同素异形体 D.它们都是强还原剂
7、有四个干燥的烧瓶,在标准状况下,向①瓶中装入干燥、纯净的氨气,②瓶中装入干燥的含一半空气的氯化氢,③瓶中装入干燥、纯净的二氧化氮,④瓶中装入干燥的体积比V(NO2)∶V(O2)=4∶1的混合气体。做喷泉实验时四个烧瓶中所得溶液的物质的量浓度之比为(不考虑烧瓶中溶液的扩散)( )
A.2∶1∶2∶2 B.5∶5∶5∶4 C.1∶1∶1∶1 D.无法确定
8、“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下,下列说法正确的是
A.操作①、④为同一操作过程
B.步骤②中发生了置换反应
C.步骤③发生的反应为:NaHSO3+NaOH = Na2SO3+H2O
D.亚硫酸钠粗品中不可能含有Na2SO4
9、A、B、C、D、E五种同周期元素从左向右按原子序数递增(原子序数为短周期的5个连续的自然数)的顺序排列如下所示,下列说法正确的是( )
A
B
C
D
E
A.E元素的最高化合价为+7价时,D元素的最低化合价可为-2价
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
10、下列实验操作及现象与所得实验结论一致的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水变浑浊
证明该溶液中存在SO
B
将NaOH溶液滴入某溶液中并加热,放出的气体能使湿润的红色石蕊试纸变蓝
证明该溶液中有NH
C
将Cl2通入品红溶液中,品红溶液褪色
证明Cl2具有还原性
D
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,
溶液变黄色
证明氧化性:H2O2>Fe2+
11、除去下列试样中的杂质(括号内的物质为杂质),选用的试剂正确的是( )
选项
A
B
C
D
试样
Fe(Cu)
NO(NO2)
CO2(HCl)
SO2(CO2)
除杂试剂
盐酸
水
饱和Na2CO3溶液
Ca(OH)2溶液
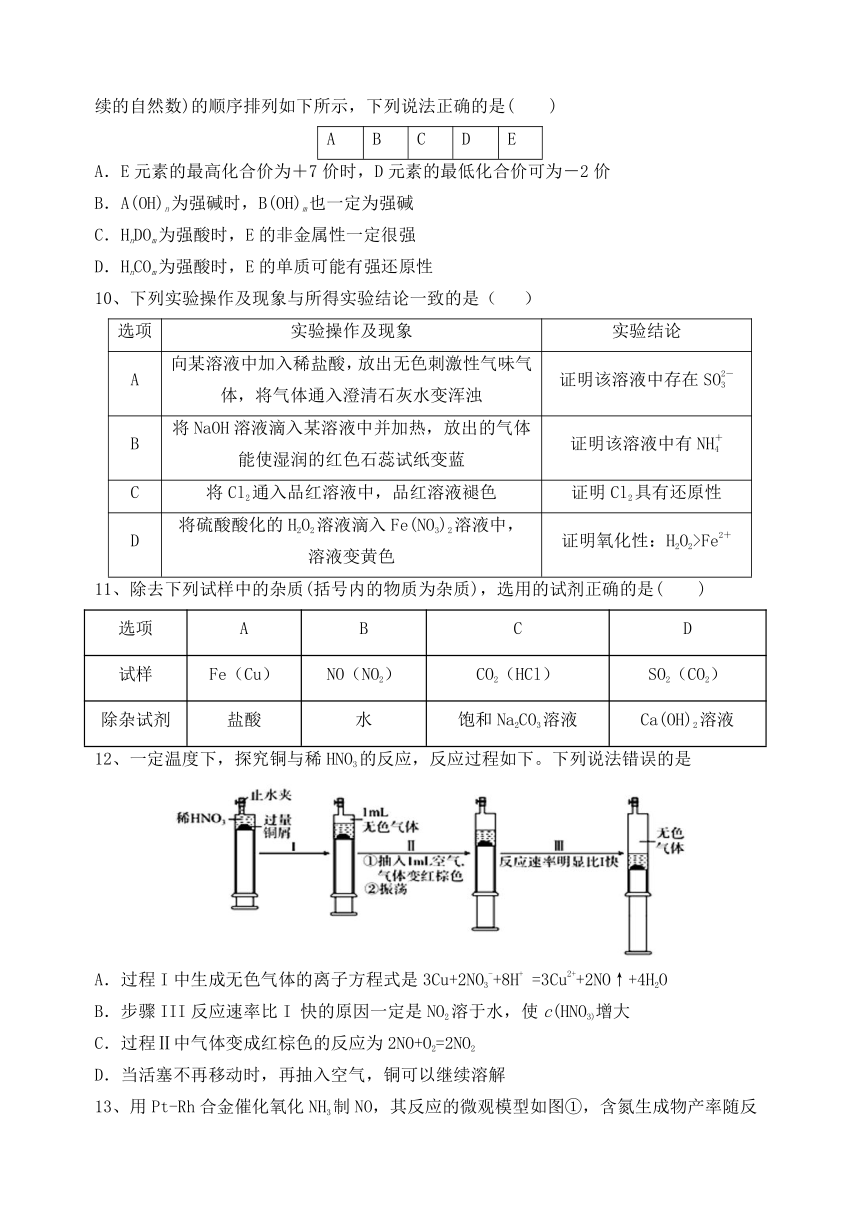
12、一定温度下,探究铜与稀HNO3的反应,反应过程如下。下列说法错误的是
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
B.步骤III反应速率比I 快的原因一定是NO2溶于水,使c(HNO3)增大
C.过程Ⅱ中气体变成红棕色的反应为2NO+O2=2NO2
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
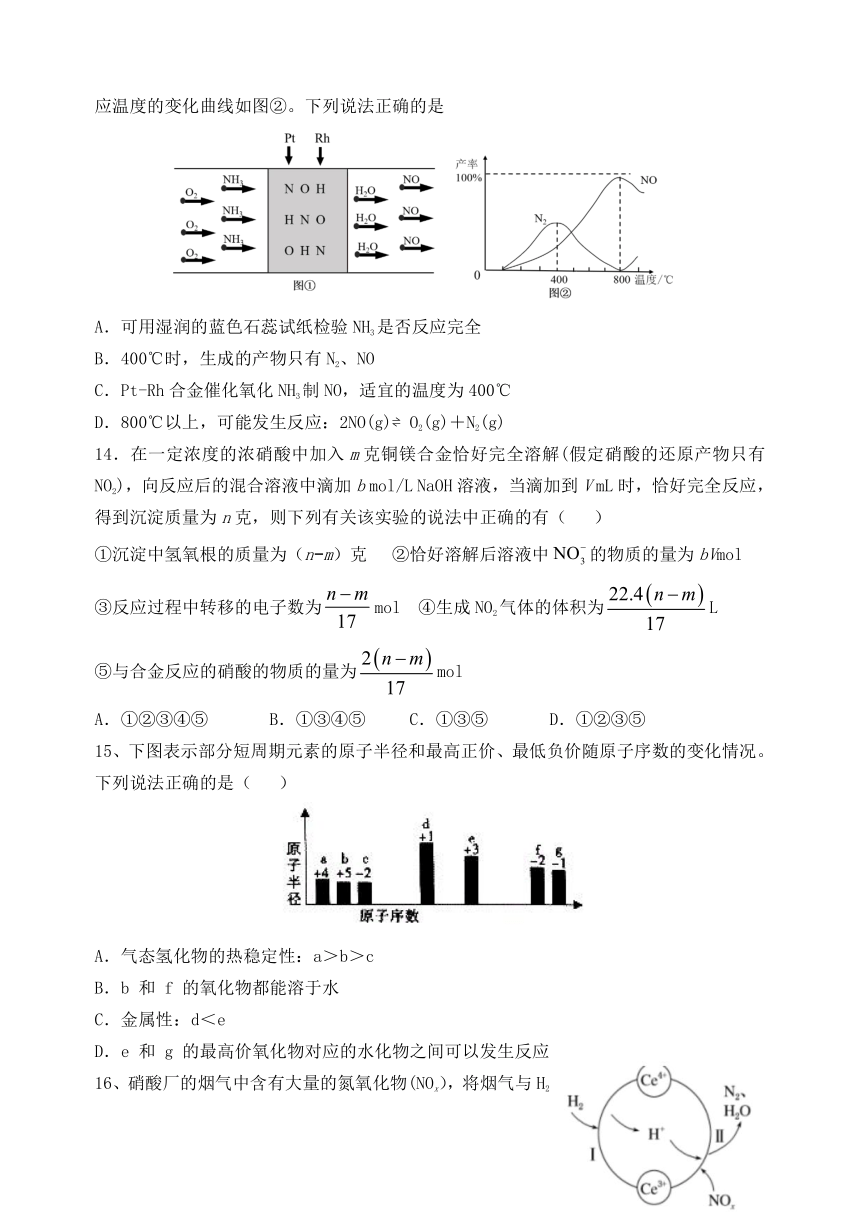
13、用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图①,含氮生成物产率随反应温度的变化曲线如图②。下列说法正确的是
A.可用湿润的蓝色石蕊试纸检验NH3是否反应完全
B.400℃时,生成的产物只有N2、NO
C.Pt-Rh合金催化氧化NH3制NO,适宜的温度为400℃
D.800℃以上,可能发生反应:2NO(g)?O2(g)+N2(g)
14.在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,恰好完全反应,得到沉淀质量为n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n?m)克 ②恰好溶解后溶液中的物质的量为bVmol
③反应过程中转移的电子数为mol ④生成NO2气体的体积为L
⑤与合金反应的硝酸的物质的量为mol
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.①②③⑤
15、下图表示部分短周期元素的原子半径和最高正价、最低负价随原子序数的变化情况。下列说法正确的是( )
A.气态氢化物的热稳定性:a>b>c
B.b 和 f 的氧化物都能溶于水
C.金属性:d<e
D.e 和 g 的最高价氧化物对应的水化物之间可以发生反应
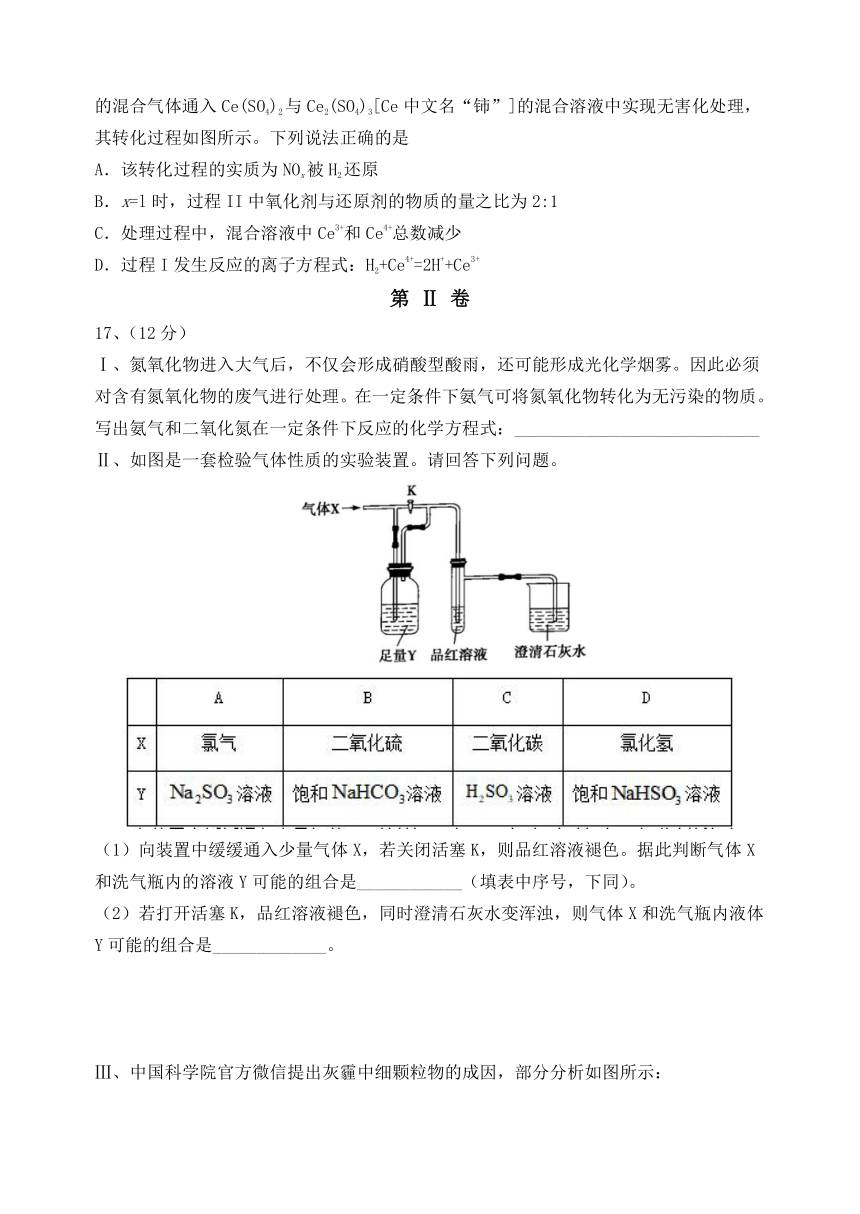
35826704000516、硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是
A.该转化过程的实质为NOx被H2还原
B.x=l时,过程II中氧化剂与还原剂的物质的量之比为2:1
C.处理过程中,混合溶液中Ce3+和Ce4+总数减少
D.过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+
第 Ⅱ 卷
17、(12分)
Ⅰ、氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾。因此必须对含有氮氧化物的废气进行处理。在一定条件下氨气可将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________________________
Ⅱ、如图是一套检验气体性质的实验装置。请回答下列问题。
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是____________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是_____________。
Ⅲ、中国科学院官方微信提出灰霾中细颗粒物的成因,部分分析如图所示:
(1)根据图示信息可以看出,下列气体污染物不是由工业燃煤造成的是____________。
a.SO2 b.NOx c.VOCs d.NH3
(2)机动车尾气是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示,写出该过程中NO发生的主要反应的化学方程式________________________。
(3)科学家经过研究发现我国的灰霾呈中性,其主要原因如图所示:
请写出上述转化过程的离子方程式:___________________________________。
18、(14分)
某实验小组同学欲探究SO2的性质并测定空气中SO2的体积分数。他们设计了如图所示的实验装置,请你参与探究,并回答问题。
(1)装置E中的NaOH溶液可吸收多余的false,发生反应的离子方程式是____________________________________________
(2)装置B用于检验false的漂白性,其中所盛试剂名称为___________。装置D是用于检验false化学性质中的________性。
3016885104140(3)装置C中发生的化学反应现象是__________________________________________;若将装置C中的溶液换成硫酸酸化的false溶液,则发生反应的离子方程式为__________________________________________。
(4)他们拟用以下方案测定空气中false的体积分数(假设空气中无其他还原性气体)。
方案I(如图乙装置):
①洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的false的体积分数________(填“偏大”“偏小”或“无影响”)。
方案Ⅱ:
false
②实验中若通入的空气的体积为false(标准状况),最终所得固体质量为false,计算该空气中false的体积分数:________________(用百分数表示,精确到小数点后三位)。
19、(12分)
Ⅰ、为纪念元素周期表诞生 150 周年,IUPAC 等从世界范围征集优秀青年化学家为化学元素代言,我国有8 位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)下列有关性质的比较,能用元素周期律解释的是___________(填字母序号)
a.非金属性:O>S b.离子半径:S2->Cl-
c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(2)Se 与 S 位于同一主族,二者氢化物中稳定性较强的是:_________(用化学式表示)
(3)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
实验装置
瓶盖
物质
实验现象
A
蘸有品红溶液的棉花
品红溶液褪色
B
HCl、BaCl2 的混合溶液
无明显变化
C
HCl、BaCl2、FeCl3 的混合溶液
产生白色沉淀
能够说明硫元素由+4 价转化为+6 价的证据(现象)是 。
Ⅱ、2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力,2016年IUPAC确认了4种新元素,其中一种为115号元素锁false,它与氮false、磷false为同族元素。回答下列问题:
(1)false元素在周期表中的位置为_________________________________;Mc元素的一种核素X可由反应false得到,X原子核内的中子数为_________。
(2)下列性质的比较中,不能说明N的非金属性强于P的是______false填序号false。
A、熔沸点:false白磷false
B、稳定性:false
C、酸性:false
20、(14分)
Ⅰ、非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。写出B→C的化学方程式________________________________________。
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的false,另外false容积为无色气体。D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式__________________________________________。
(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式__________________________________________。
Ⅱ、A、B、C、D、E、F六种短周期主族元素,原子序数依次増大,A的原子半径最小,B的最外层电子数是次外层的3倍;B、E同主族,B、C的最外层电子数之和与F的最外层电子数相等,D是地壳中含量最多的金属元素。回答下列问题:
(1)B、C、D三种元素中,形成的简单离子的半径由小到大的顺序是______________(填离子符号)
(2)C、D、E、F形成的最高价氧化物对应的水化物中:
①酸性最强的是_______(用化学式填写)。
②D单质能与C的最高价氧化物的水化物溶液反应,其反应的离子方程式是:_____________________________________________。
(3)下列事实能说明F元素的非金属性比E元素的非金属性强的是_______(填序号)
①最高价氧化物对应水化物的酸性:F>E
②F原子得到电子的数目比E原子少
③F元素的最高正价比E元素的最高正价要高
④元素的简单气态氢化物的稳定性:F>E
⑤气态氢化物溶于水后的酸性:F>E
2021.4
相对原子质量:H:1 Li:7 C:12 N:14 O:16 Mg:24 S:32 Cl:35.5 Fe:56 Cu:64 Ba:137
第 Ⅰ 卷
1、明代《造强水法》记载“绿矾五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,锅下起火,取气冷定,开坛则药化为水。用水入五金皆成水,惟黄金不化水中。”“硝”即硝酸钾。下列说法错误的是 ( )
A.“绿矾”的成分为FeSO4?7H2O
B.“研细”可在蒸发皿中进行
C.“开坛则药化为水”,“水”的主要成分是硝酸
D.“五金皆成水”,发生氧化还原反应
2、发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生的大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟。产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
3、下列化合物中,阴离子半径与阳离子半径之比最小的是
A.LiI B.NaBr C.KCl D.CsF
4、根据元素周期律,由事实进行归纳推测,下列事实或推测不合理的是( )
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(第ⅡA族元素)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素都是半导体材料
C
HCl在1 500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
5、莫尔盐也叫硫酸亚铁铵,是一种重要的化工原料,可作净水剂。在不同温度下其分解产物不同,下图为 500 ℃时隔绝空气加热,探究其分解生成的气体产物的装置。下列说法不正确的是( )
A.乙装置的干燥管盛装无水硫酸铜检验分解产物中可能含有的水
B.丙中浓盐酸检验可能的分解产物NH3,浓盐酸可用浓硝酸代替
C.若分解产物有SO2,无SO3,则丁装置中无现象,戊装置中有白色沉淀生成
D.己装置吸收实验尾气,防止酸性气体对环境造成污染
6、长征2号火箭承担运载“神六”的 使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是( )
A.LiH、LiD、LiT的摩尔质量之比为1∶2∶3 B.它们都是强氧化剂
C.H、D、T之间互称为同素异形体 D.它们都是强还原剂
7、有四个干燥的烧瓶,在标准状况下,向①瓶中装入干燥、纯净的氨气,②瓶中装入干燥的含一半空气的氯化氢,③瓶中装入干燥、纯净的二氧化氮,④瓶中装入干燥的体积比V(NO2)∶V(O2)=4∶1的混合气体。做喷泉实验时四个烧瓶中所得溶液的物质的量浓度之比为(不考虑烧瓶中溶液的扩散)( )
A.2∶1∶2∶2 B.5∶5∶5∶4 C.1∶1∶1∶1 D.无法确定
8、“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下,下列说法正确的是
A.操作①、④为同一操作过程
B.步骤②中发生了置换反应
C.步骤③发生的反应为:NaHSO3+NaOH = Na2SO3+H2O
D.亚硫酸钠粗品中不可能含有Na2SO4
9、A、B、C、D、E五种同周期元素从左向右按原子序数递增(原子序数为短周期的5个连续的自然数)的顺序排列如下所示,下列说法正确的是( )
A
B
C
D
E
A.E元素的最高化合价为+7价时,D元素的最低化合价可为-2价
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
10、下列实验操作及现象与所得实验结论一致的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水变浑浊
证明该溶液中存在SO
B
将NaOH溶液滴入某溶液中并加热,放出的气体能使湿润的红色石蕊试纸变蓝
证明该溶液中有NH
C
将Cl2通入品红溶液中,品红溶液褪色
证明Cl2具有还原性
D
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,
溶液变黄色
证明氧化性:H2O2>Fe2+
11、除去下列试样中的杂质(括号内的物质为杂质),选用的试剂正确的是( )
选项
A
B
C
D
试样
Fe(Cu)
NO(NO2)
CO2(HCl)
SO2(CO2)
除杂试剂
盐酸
水
饱和Na2CO3溶液
Ca(OH)2溶液
12、一定温度下,探究铜与稀HNO3的反应,反应过程如下。下列说法错误的是
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
B.步骤III反应速率比I 快的原因一定是NO2溶于水,使c(HNO3)增大
C.过程Ⅱ中气体变成红棕色的反应为2NO+O2=2NO2
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
13、用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图①,含氮生成物产率随反应温度的变化曲线如图②。下列说法正确的是
A.可用湿润的蓝色石蕊试纸检验NH3是否反应完全
B.400℃时,生成的产物只有N2、NO
C.Pt-Rh合金催化氧化NH3制NO,适宜的温度为400℃
D.800℃以上,可能发生反应:2NO(g)?O2(g)+N2(g)
14.在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,恰好完全反应,得到沉淀质量为n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n?m)克 ②恰好溶解后溶液中的物质的量为bVmol
③反应过程中转移的电子数为mol ④生成NO2气体的体积为L
⑤与合金反应的硝酸的物质的量为mol
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.①②③⑤
15、下图表示部分短周期元素的原子半径和最高正价、最低负价随原子序数的变化情况。下列说法正确的是( )
A.气态氢化物的热稳定性:a>b>c
B.b 和 f 的氧化物都能溶于水
C.金属性:d<e
D.e 和 g 的最高价氧化物对应的水化物之间可以发生反应
35826704000516、硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是
A.该转化过程的实质为NOx被H2还原
B.x=l时,过程II中氧化剂与还原剂的物质的量之比为2:1
C.处理过程中,混合溶液中Ce3+和Ce4+总数减少
D.过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+
第 Ⅱ 卷
17、(12分)
Ⅰ、氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾。因此必须对含有氮氧化物的废气进行处理。在一定条件下氨气可将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________________________
Ⅱ、如图是一套检验气体性质的实验装置。请回答下列问题。
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是____________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是_____________。
Ⅲ、中国科学院官方微信提出灰霾中细颗粒物的成因,部分分析如图所示:
(1)根据图示信息可以看出,下列气体污染物不是由工业燃煤造成的是____________。
a.SO2 b.NOx c.VOCs d.NH3
(2)机动车尾气是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示,写出该过程中NO发生的主要反应的化学方程式________________________。
(3)科学家经过研究发现我国的灰霾呈中性,其主要原因如图所示:
请写出上述转化过程的离子方程式:___________________________________。
18、(14分)
某实验小组同学欲探究SO2的性质并测定空气中SO2的体积分数。他们设计了如图所示的实验装置,请你参与探究,并回答问题。
(1)装置E中的NaOH溶液可吸收多余的false,发生反应的离子方程式是____________________________________________
(2)装置B用于检验false的漂白性,其中所盛试剂名称为___________。装置D是用于检验false化学性质中的________性。
3016885104140(3)装置C中发生的化学反应现象是__________________________________________;若将装置C中的溶液换成硫酸酸化的false溶液,则发生反应的离子方程式为__________________________________________。
(4)他们拟用以下方案测定空气中false的体积分数(假设空气中无其他还原性气体)。
方案I(如图乙装置):
①洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的false的体积分数________(填“偏大”“偏小”或“无影响”)。
方案Ⅱ:
false
②实验中若通入的空气的体积为false(标准状况),最终所得固体质量为false,计算该空气中false的体积分数:________________(用百分数表示,精确到小数点后三位)。
19、(12分)
Ⅰ、为纪念元素周期表诞生 150 周年,IUPAC 等从世界范围征集优秀青年化学家为化学元素代言,我国有8 位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)下列有关性质的比较,能用元素周期律解释的是___________(填字母序号)
a.非金属性:O>S b.离子半径:S2->Cl-
c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(2)Se 与 S 位于同一主族,二者氢化物中稳定性较强的是:_________(用化学式表示)
(3)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
实验装置
瓶盖
物质
实验现象
A
蘸有品红溶液的棉花
品红溶液褪色
B
HCl、BaCl2 的混合溶液
无明显变化
C
HCl、BaCl2、FeCl3 的混合溶液
产生白色沉淀
能够说明硫元素由+4 价转化为+6 价的证据(现象)是 。
Ⅱ、2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力,2016年IUPAC确认了4种新元素,其中一种为115号元素锁false,它与氮false、磷false为同族元素。回答下列问题:
(1)false元素在周期表中的位置为_________________________________;Mc元素的一种核素X可由反应false得到,X原子核内的中子数为_________。
(2)下列性质的比较中,不能说明N的非金属性强于P的是______false填序号false。
A、熔沸点:false白磷false
B、稳定性:false
C、酸性:false
20、(14分)
Ⅰ、非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。写出B→C的化学方程式________________________________________。
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的false,另外false容积为无色气体。D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式__________________________________________。
(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式__________________________________________。
Ⅱ、A、B、C、D、E、F六种短周期主族元素,原子序数依次増大,A的原子半径最小,B的最外层电子数是次外层的3倍;B、E同主族,B、C的最外层电子数之和与F的最外层电子数相等,D是地壳中含量最多的金属元素。回答下列问题:
(1)B、C、D三种元素中,形成的简单离子的半径由小到大的顺序是______________(填离子符号)
(2)C、D、E、F形成的最高价氧化物对应的水化物中:
①酸性最强的是_______(用化学式填写)。
②D单质能与C的最高价氧化物的水化物溶液反应,其反应的离子方程式是:_____________________________________________。
(3)下列事实能说明F元素的非金属性比E元素的非金属性强的是_______(填序号)
①最高价氧化物对应水化物的酸性:F>E
②F原子得到电子的数目比E原子少
③F元素的最高正价比E元素的最高正价要高
④元素的简单气态氢化物的稳定性:F>E
⑤气态氢化物溶于水后的酸性:F>E
同课章节目录
