化学必修二第一章物质结构 元素周期律第一节元素周期表_精品课件
文档属性
| 名称 | 化学必修二第一章物质结构 元素周期律第一节元素周期表_精品课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-16 14:17:09 | ||
图片预览





文档简介
(共30张PPT)
§1 元素周期表
必修2 第一章
物质结构 元素周期律
(一)元素周期表的历史
1.第一张元素周期表
(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:
俄国化学家——门捷列夫
1869年
将元素按照相对原子质量由小到大依次排列
揭示了化学元素的内在联系——里程碑
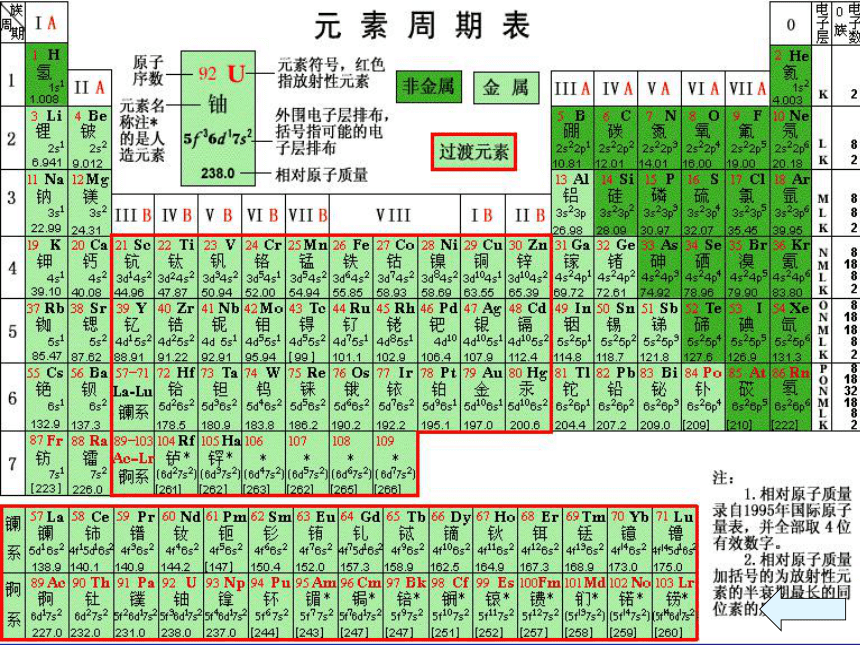
2.现行元素周期表
(1)排序依据:
(2)原子序数:
(3)结构特点:
原子的核电荷数
按照元素在周期表中的顺序给元素编号
将化学性质相似的元素放在一个纵行
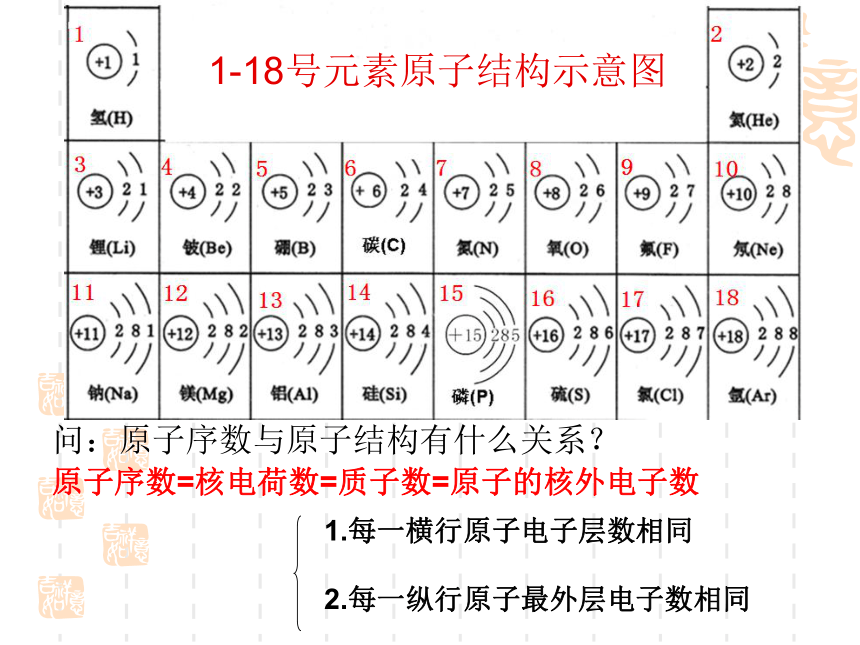
1-18号元素原子结构示意图
问:原子序数与原子结构有什么关系?
原子序数=核电荷数=质子数=原子的核外电子数
1.每一横行原子电子层数相同
2.每一纵行原子最外层电子数相同
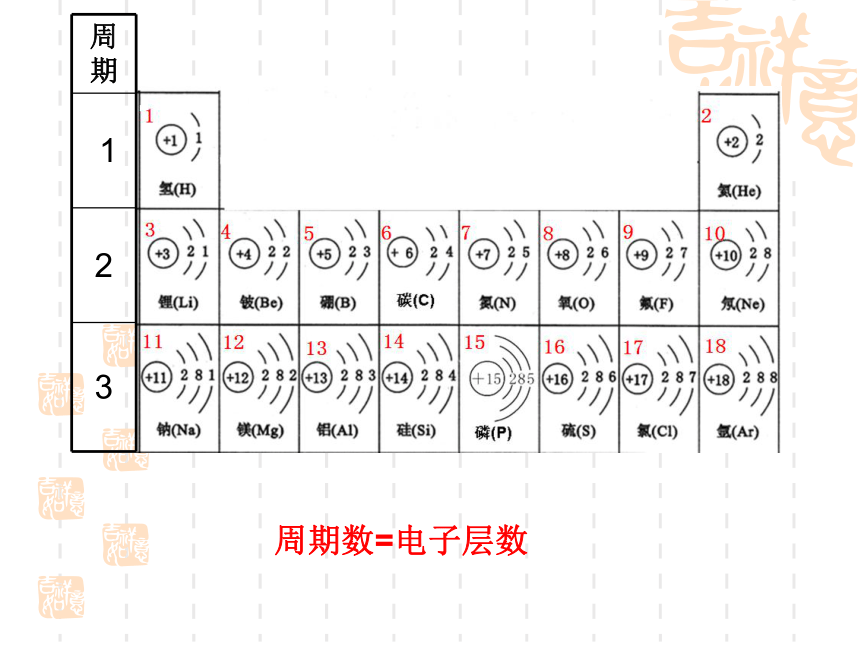
问:1. 在元素周期表中横行和纵行又称为什么?
2. 元素周期表中有多少横行,多少周期?
多少纵行,多少族?
周 期
1
2
3
周期数=电子层数
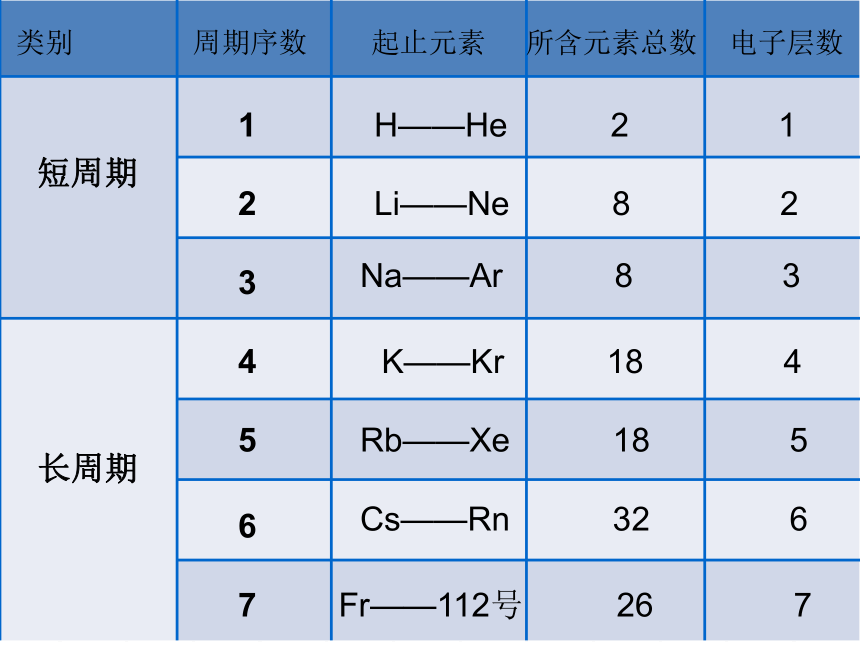
类别 周期序数 起止元素 所含元素总数 电子层数
短周期
长周期
1
2
3
4
5
6
7
H——He 2 1
Li——Ne 8 2
Na——Ar 8 3
K——Kr 18 4
Rb——Xe 18 5
Cs——Rn 32 6
Fr——112号 26 7
(1)周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期序数 = 电子层数
周期
短周期:第1~3周期
长周期:第4~7周期
周期表里数周期,1234567.
(2)族(纵行)
主族:
由短周期元素和长周期元素共同构成的族。
副族:
完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
第VⅢ族:
0族:
(“八、九、十” 三个纵行)
稀有气体元素
七主七副八和0
表示方法:在罗马数字表示的族序数后面标“A”字。
ⅠA、ⅡA、ⅢA、…
ⅠA
0
ⅡA ⅢA Ⅳ A ⅤA ⅥA ⅦA
族序数=最外层电子数
注意
总结:
周期
(7个)
族
(16个)
短周期
长周期
第 1周期
第 2周期
第 6周期
第 3周期
第 5周期
第 4周期
第 7周期
—— 2 种
—— 8 种
—— 8 种
—— 18 种
—— 18 种
—— 32 种
—— 26 种
主族
副族
第VIII族
0 族
共 7 个主族,包括短周期和长周期元素
共 7 个副族,只包括在长周期中
包括第8、9、10 纵行
稀有气体元素
周期表里数周期,1
2
3
4
5
6
7
七主七副和零族,最后莫忘第Ⅷ族。
螺旋型周期表
它们分别位于周期表的什么位置?
1.已知碳元素、镁元素和溴等主族元素的原子
结构示意图:
练一练
2.根据元素的原子序数,不能确定的是?
A.原子核内质子数
B.原子核内中子
C.原子核外电子数
B
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周期是?
A.第4周期 B.第5周期
C.第6周期 D.第7周期
C
判断下列说法是否正确
错,还有0族元素
错,短周期包括1、2、3周期,共18种元素
正确,过渡元素还全是金属元素
1、短周期元素全是主族元素
2、短周期元素共有20种元素
3、过渡元素全是长周期元素
4、过渡元素全是副族元素
错,还有第VIII族元素
元素名称
核电荷数
原子结构示意图
最外层电子数
电子层数
碱
金
属
元
素
1
5
6
锂
钠
钾
铷
铯
3
11
19
37
55
1
1
1
1
2
3
4
1、 碱 金 属 元 素
碱金属: 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)
放射性元素
碱金属的原子结构
Na钠
K钾
Li锂
Rb铷
Cs铯
碱金属原子结构示意图
碱金属原子 结构异同:异:核电荷数:由小→大;电子层数:由少→多;同:最外层电子数均为1个
钾在空气中燃烧
钾与水反应
钠与水反应
钠与钾性质对比实验
与O2反应
反应不如钠剧烈,生成Li2O
点燃剧烈燃烧,生成Na2O2
燃烧更加剧烈生成比过氧化物复杂的氧化物
遇空气立即燃烧,生成更复杂的氧化物
遇空气立即燃烧,生成更复杂的氧化物
Li
Na
K
Rb
Cs
与H2O反应
剧烈,生成H2
更剧烈,生成H2
轻微的爆炸,生成H2
遇水立即燃烧,爆炸
结论
金 属 性 逐 渐 增 强
碱金属的化学性质
遇水立即燃烧,爆炸
Li Na K Rb Cs
1.相似性:
都易失电子表现强还原性
化合物中均为+1价
总结: 碱金属的原子结构
2.递变性:
核电荷数
电子层数
(电子层数的影响大于核电荷数的影响)
失电子能力
还原性
金属性
原子半径
化学性质相似
最外层上都只有一个电子
核对最外层电子的引力
§1 元素周期表
必修2 第一章
物质结构 元素周期律
(一)元素周期表的历史
1.第一张元素周期表
(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:
俄国化学家——门捷列夫
1869年
将元素按照相对原子质量由小到大依次排列
揭示了化学元素的内在联系——里程碑
2.现行元素周期表
(1)排序依据:
(2)原子序数:
(3)结构特点:
原子的核电荷数
按照元素在周期表中的顺序给元素编号
将化学性质相似的元素放在一个纵行
1-18号元素原子结构示意图
问:原子序数与原子结构有什么关系?
原子序数=核电荷数=质子数=原子的核外电子数
1.每一横行原子电子层数相同
2.每一纵行原子最外层电子数相同
问:1. 在元素周期表中横行和纵行又称为什么?
2. 元素周期表中有多少横行,多少周期?
多少纵行,多少族?
周 期
1
2
3
周期数=电子层数
类别 周期序数 起止元素 所含元素总数 电子层数
短周期
长周期
1
2
3
4
5
6
7
H——He 2 1
Li——Ne 8 2
Na——Ar 8 3
K——Kr 18 4
Rb——Xe 18 5
Cs——Rn 32 6
Fr——112号 26 7
(1)周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期序数 = 电子层数
周期
短周期:第1~3周期
长周期:第4~7周期
周期表里数周期,1234567.
(2)族(纵行)
主族:
由短周期元素和长周期元素共同构成的族。
副族:
完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
第VⅢ族:
0族:
(“八、九、十” 三个纵行)
稀有气体元素
七主七副八和0
表示方法:在罗马数字表示的族序数后面标“A”字。
ⅠA、ⅡA、ⅢA、…
ⅠA
0
ⅡA ⅢA Ⅳ A ⅤA ⅥA ⅦA
族序数=最外层电子数
注意
总结:
周期
(7个)
族
(16个)
短周期
长周期
第 1周期
第 2周期
第 6周期
第 3周期
第 5周期
第 4周期
第 7周期
—— 2 种
—— 8 种
—— 8 种
—— 18 种
—— 18 种
—— 32 种
—— 26 种
主族
副族
第VIII族
0 族
共 7 个主族,包括短周期和长周期元素
共 7 个副族,只包括在长周期中
包括第8、9、10 纵行
稀有气体元素
周期表里数周期,1
2
3
4
5
6
7
七主七副和零族,最后莫忘第Ⅷ族。
螺旋型周期表
它们分别位于周期表的什么位置?
1.已知碳元素、镁元素和溴等主族元素的原子
结构示意图:
练一练
2.根据元素的原子序数,不能确定的是?
A.原子核内质子数
B.原子核内中子
C.原子核外电子数
B
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周期是?
A.第4周期 B.第5周期
C.第6周期 D.第7周期
C
判断下列说法是否正确
错,还有0族元素
错,短周期包括1、2、3周期,共18种元素
正确,过渡元素还全是金属元素
1、短周期元素全是主族元素
2、短周期元素共有20种元素
3、过渡元素全是长周期元素
4、过渡元素全是副族元素
错,还有第VIII族元素
元素名称
核电荷数
原子结构示意图
最外层电子数
电子层数
碱
金
属
元
素
1
5
6
锂
钠
钾
铷
铯
3
11
19
37
55
1
1
1
1
2
3
4
1、 碱 金 属 元 素
碱金属: 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)
放射性元素
碱金属的原子结构
Na钠
K钾
Li锂
Rb铷
Cs铯
碱金属原子结构示意图
碱金属原子 结构异同:异:核电荷数:由小→大;电子层数:由少→多;同:最外层电子数均为1个
钾在空气中燃烧
钾与水反应
钠与水反应
钠与钾性质对比实验
与O2反应
反应不如钠剧烈,生成Li2O
点燃剧烈燃烧,生成Na2O2
燃烧更加剧烈生成比过氧化物复杂的氧化物
遇空气立即燃烧,生成更复杂的氧化物
遇空气立即燃烧,生成更复杂的氧化物
Li
Na
K
Rb
Cs
与H2O反应
剧烈,生成H2
更剧烈,生成H2
轻微的爆炸,生成H2
遇水立即燃烧,爆炸
结论
金 属 性 逐 渐 增 强
碱金属的化学性质
遇水立即燃烧,爆炸
Li Na K Rb Cs
1.相似性:
都易失电子表现强还原性
化合物中均为+1价
总结: 碱金属的原子结构
2.递变性:
核电荷数
电子层数
(电子层数的影响大于核电荷数的影响)
失电子能力
还原性
金属性
原子半径
化学性质相似
最外层上都只有一个电子
核对最外层电子的引力
