课件精讲05 回归无机物性质及应用-2021高考化学考前30天之回归课本 (24张ppt)
文档属性
| 名称 | 课件精讲05 回归无机物性质及应用-2021高考化学考前30天之回归课本 (24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-11 21:37:45 | ||
图片预览

文档简介
(共24张PPT)
05-无机物的性质及应用
2021高考三轮复习之回归课本
物质
1
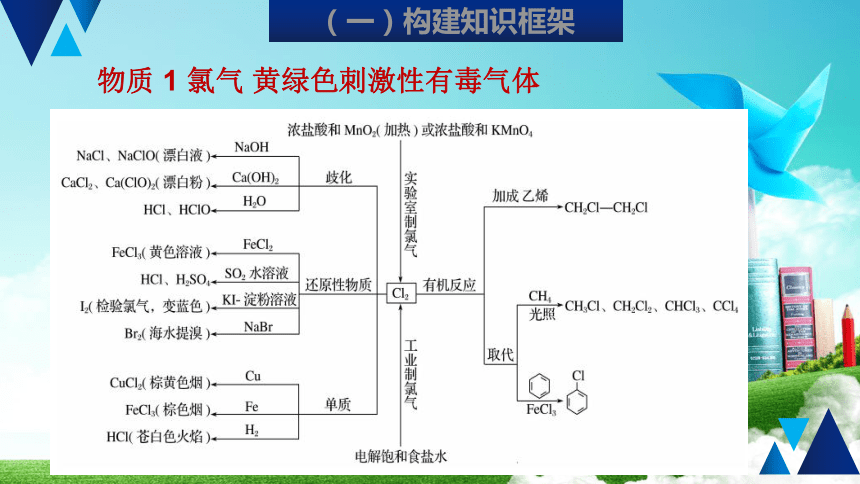
氯气
黄绿色刺激性有毒气体
(一)构建知识框架
物质
2
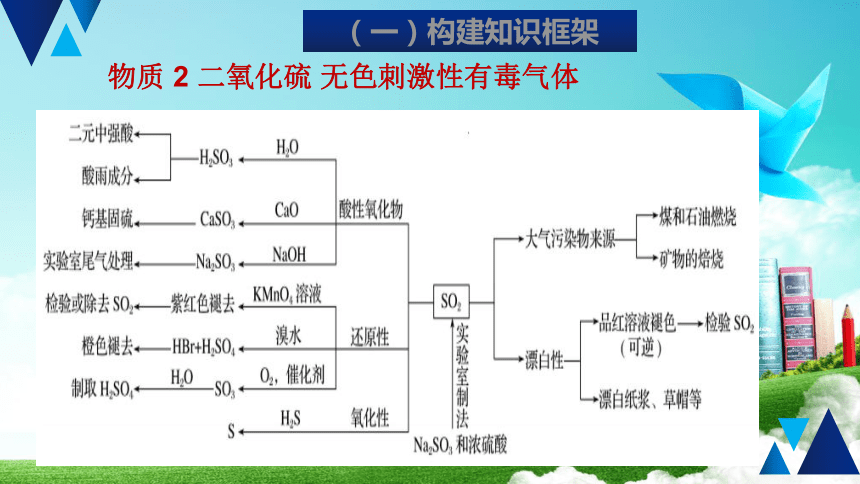
二氧化硫
无色刺激性有毒气体
(一)构建知识框架
物质
3
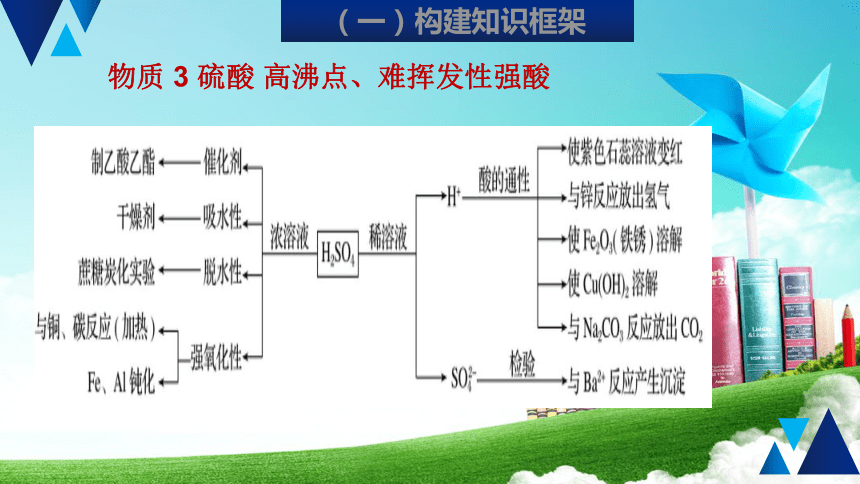
硫酸
高沸点、难挥发性强酸
(一)构建知识框架
物质
4
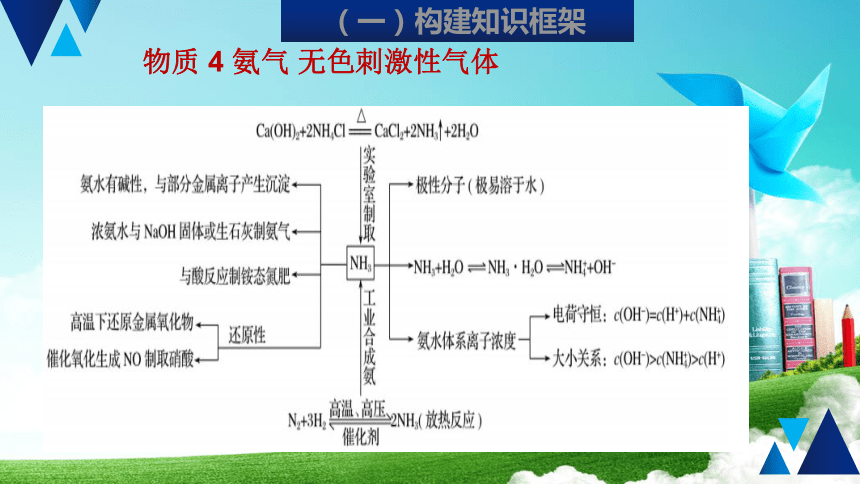
氨气
无色刺激性气体
(一)构建知识框架
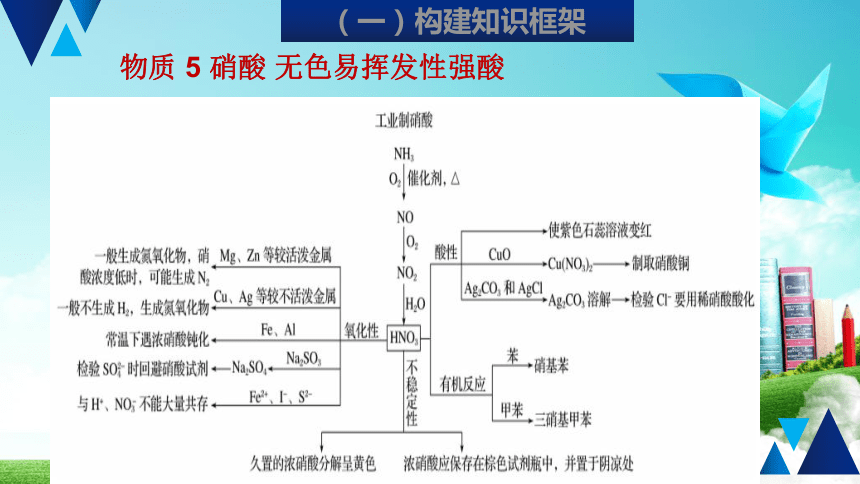
物质
5
硝酸
无色易挥发性强酸
(一)构建知识框架
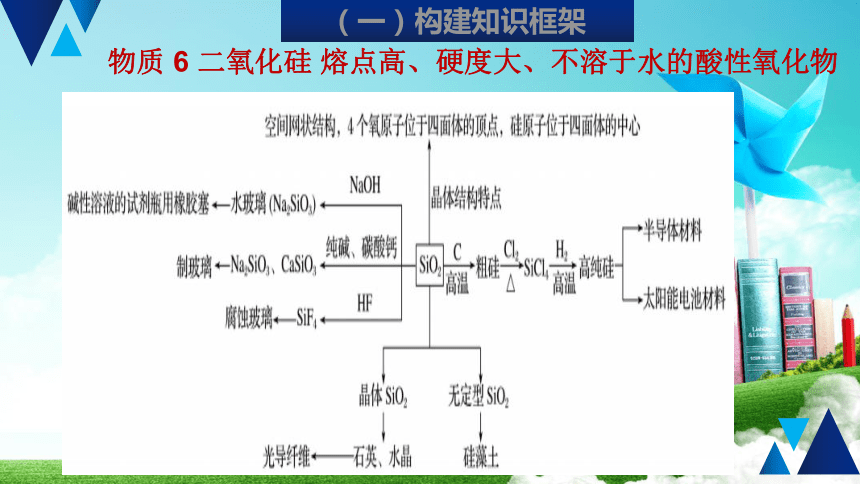
物质
6
二氧化硅
熔点高、硬度大、不溶于水的酸性氧化物
(一)构建知识框架
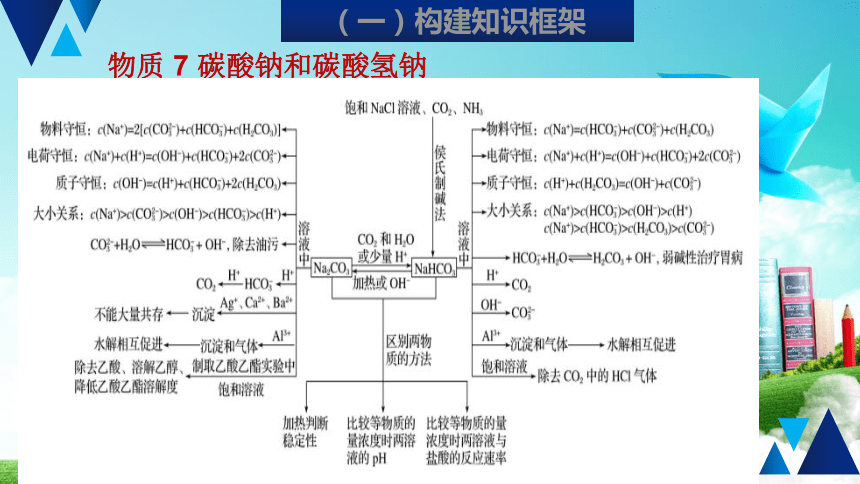
物质
7
碳酸钠和碳酸氢钠
(一)构建知识框架
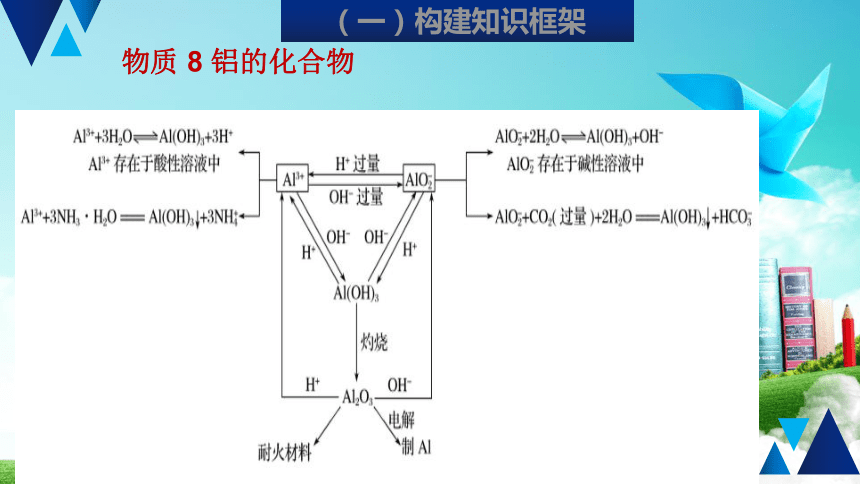
物质
8
铝的化合物
(一)构建知识框架
物质
9
铁盐与亚铁盐
(一)构建知识框架
(1)过氧化钠吸收空气中的二氧化碳:2Na2O2+2CO2=2Na2CO3+O2
(二)重要方程式再现
1.常见金属及其化合物
(3)
纯
碱
溶
液
中
通
入
CO2
气
体
:
Na2CO3
+
CO2
+
H2O=2NaHCO3
(2)过氧化钠溶于水:2Na2O2+2H2O=4NaOH+O2↑
(4)电解饱和食盐水:2NaCl+2H2O
Cl2↑+H2↑+2NaOH
(5)
铝
片
溶
于
烧
碱
溶
液
:
2Al
+
2NaOH
+
2H2O=2NaAlO2
+
3H2↑
(6)用
AlCl3
溶液和氨水制备
Al(OH)3:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
(二)重要方程式再现
1.常见金属及其化合物
(7)NaAlO2溶液与
NaHCO3溶液混合:NaAlO2+NaHCO3+H2O=Al(OH)3↓+Na2CO3
(8)泡沫灭火器的反应原理:Al3++3HCO3-
=Al(OH)3↓+3CO2↑
(9)FeCl2溶液中滴加氯水:2FeCl2+Cl2=2FeCl3
(10)用
FeCl3溶液腐蚀铜片:2FeCl3+Cu=2FeCl2+CuCl2
(11)铝热反应(金属氧化物
Fe3O4):3Fe3O4+8Al
9Fe+4Al2O3
(12)镁在二氧化碳中燃烧:2Mg+CO2
2MgO+C
(3)氯水滴入
KBr
溶液,比较
Cl2和
Br2的氧化性:
2KBr+Cl2=2KCl+Br2
2.常见非金属及其化合物
(二)重要方程式再现
(2)用烧碱溶液吸收尾气中的
Cl2:Cl2+2NaOH=NaCl+NaClO+H2O
(1)实验室用
MnO2和浓盐酸制氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(4)铜片溶于浓硫酸:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
(5)SO2使溴水褪色:SO2+Br2+2H2O=H2SO4+2HBr
(6)硫化氢与二氧化硫气体混合产生浅黄色沉淀:2H2S+SO2=3S↓+2H2O
(7)SO2型酸雨在空气中放置酸性增强:2H2SO3+O2=2H2SO4
(8)CuSO4溶液吸收
H2S
气体:CuSO4+H2S=CuS↓+H2SO4
2.常见非金属及其化合物
(二)重要方程式再现
(10)氨气的催化氧化反应:4NH3+5O2
4NO+6H2O
(9)实验室用
NH4Cl
取制氨气:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
(11)
铜
溶
于
稀
硝
酸
:
3Cu
+
8HNO3(
稀
)=3Cu(NO3)2+2NO↑+4H2O
(12)久置浓硝酸变黄:4HNO3
4NO2↑+O2↑+2H2O
(13)工业上制取粗硅:SiO2+2C
Si+2CO↑
(14)硅酸钠溶液中通入少量
CO2:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
30
(1)利用次氯酸具有强氧化性可用于漂白织物。
( )
(2)浓HCl制备纯净Cl2时可让气体产物先通过浓H2SO4,后通过饱和食盐水。
( )
(3)漂白粉在空气中久置变质是由于漂白粉中的CaCl2
与空气中的CO2反应生成CaCO3。
( )
(4)液溴易挥发,在存放液溴的试剂瓶中应加水封。
( )
(5)向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色说明Br-的还原性强于Cl-。
( )
×
×
√
√
√
正误判断
30
(6)为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。
( )
(7)等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数相等。
( )
(8)漂白粉在空气中不稳定,可用于漂白纸张。
( )
(9)除去氯气中的HCl气体,装置如图。
( )
(10)向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,现象是溶液变成蓝色,说明氧化性:Cl2>I2。
( )
×
×
×
√
√
正误判断
31
(11)除去Cu粉中混有CuO的操作是加入稀HNO3溶解,过滤、洗涤、干燥。
( )(12)铁比铜金属性强的实际应用是FeCl3腐蚀Cu刻制印刷电路板。( )(13)将铜粉加入1.0
mol·L-1Fe2(SO4)3溶液中,现象是溶液变蓝、有黑色固体出现。
( )(14)铝与Fe2O3发生铝热反应后固体物质增重。
( )(15)H2通过灼热的CuO粉末,反应后固体物质增重。( )(16)FeCl3溶液可用于铜质印刷线路板制作的原理是FeCl3能从含Cu2+的溶液中置换出铜。
( )
×
×
×
×
×
×
正误判断
31
(17)CuSO4溶液中通入CO2气体产生蓝色沉淀。
( )(18)CuSO4溶液与H2S反应的离子方程式为Cu2++S2-=CuS↓。( )(19)气体通过无水CuSO4粉末变蓝,证明原气体中含有水蒸气。
( )(20)浓HNO3中加入过量的Cu,反应生成的气体有NO2和NO。
( )(21)用稀盐酸除去铜锈的离子方程式为CuO+2H+=Cu2++H2O。( )(22)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。
( )
×
×
√
√
√
×
正误判断
32
(23)纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附。
( )(24)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,则说明常温下,铁与浓硫酸一定没有发生化学反应。
( )(25)将稀HNO3加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液呈血红色,说明稀HNO3将铁氧化为Fe3+。
( )(26)将铜粉加入1.0
mol·L-1
Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现,说明金属铁比铜活泼。
( )(27)浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑。( )
×
×
×
×
×
正误判断
32
(28)FeCl3与氢碘酸反应生成棕色物质的离子方程式为
2Fe3++2I-=2Fe2++I2。
( )(29)硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑。
( )(30)磁性氧化铁溶于稀HNO3:Fe3O4+8H+=2Fe3++Fe2++4H2O( )(31)铁在高温下与H2O(g)发生置换反应生成Fe2O3。( )(32)向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液,加入H2O2后溶液变成血红色,说明Fe2+既有氧化性又有还原性。
( )(33)保存FeSO4时可向溶液中加入Fe和稀盐酸。
( )
×
×
×
×
×
√
正误判断
33
(34)将浓HNO3滴入用砂纸打磨过的铝条中,产生红棕色气体。
( )(35)用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明Al的熔点较低。
( )(36)氯化铝溶液滴入浓氢氧化钠溶液中,产生大量白色沉淀。
( )(37)制备Al(OH)3悬浊液:向1
mol·L-1
AlCl3溶液中加过量的6
mol·L-1
NaOH溶液。
( )(38)Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O=2AlO2-+3H2↑。
( )
×
×
×
×
√
正误判断
33
(39)AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O=AlO2-+4NH4++2H2O。
( )(40)明矾净水的原理是明矾水解生成Al(OH)3胶体吸附悬浮物同时杀菌消毒。
( )(41)常温下将Al片放入浓HNO3中无明显现象可得出Al与浓HNO3不反应。
( )(42)向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成。( )(43)做完实验后,剩余的白磷放回原试剂瓶,不能随意丢弃。( )
×
×
×
√
×
正误判断
34
(44)钠在空气中燃烧可生成多种氧化物。23
g钠充分燃烧时转移电子数为NA。
( )
(45)1
L
0.1
mol/L的Na2CO3溶液中CO32-、HCO3-和H2CO3的粒子数之和为0.1NA。
( )
(46)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液,立即产生气泡
( )
(47)用热的烧碱溶液洗去油污,是因为Na2CO3可直接与油污反应。
( )
(48)CO2通过Na2O2粉末后固体物质增重。( )
×
×
√
√
√
正误判断
34
(49)碳酸氢钠受热分解实验如图所示。
( )
(50)Na2O2与水反应是水作还原剂的氧化还原反应。
( )
(51)灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+。
( )
(52)海水中提取镁的过程中,可以将MgCl2溶液蒸干得到MgCl2。( )
(53)保存液溴时向其中加入少量酒精,减少挥发。( )
×
×
×
×
×
正误判断
05-无机物的性质及应用
2021高考三轮复习之回归课本
物质
1
氯气
黄绿色刺激性有毒气体
(一)构建知识框架
物质
2
二氧化硫
无色刺激性有毒气体
(一)构建知识框架
物质
3
硫酸
高沸点、难挥发性强酸
(一)构建知识框架
物质
4
氨气
无色刺激性气体
(一)构建知识框架
物质
5
硝酸
无色易挥发性强酸
(一)构建知识框架
物质
6
二氧化硅
熔点高、硬度大、不溶于水的酸性氧化物
(一)构建知识框架
物质
7
碳酸钠和碳酸氢钠
(一)构建知识框架
物质
8
铝的化合物
(一)构建知识框架
物质
9
铁盐与亚铁盐
(一)构建知识框架
(1)过氧化钠吸收空气中的二氧化碳:2Na2O2+2CO2=2Na2CO3+O2
(二)重要方程式再现
1.常见金属及其化合物
(3)
纯
碱
溶
液
中
通
入
CO2
气
体
:
Na2CO3
+
CO2
+
H2O=2NaHCO3
(2)过氧化钠溶于水:2Na2O2+2H2O=4NaOH+O2↑
(4)电解饱和食盐水:2NaCl+2H2O
Cl2↑+H2↑+2NaOH
(5)
铝
片
溶
于
烧
碱
溶
液
:
2Al
+
2NaOH
+
2H2O=2NaAlO2
+
3H2↑
(6)用
AlCl3
溶液和氨水制备
Al(OH)3:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
(二)重要方程式再现
1.常见金属及其化合物
(7)NaAlO2溶液与
NaHCO3溶液混合:NaAlO2+NaHCO3+H2O=Al(OH)3↓+Na2CO3
(8)泡沫灭火器的反应原理:Al3++3HCO3-
=Al(OH)3↓+3CO2↑
(9)FeCl2溶液中滴加氯水:2FeCl2+Cl2=2FeCl3
(10)用
FeCl3溶液腐蚀铜片:2FeCl3+Cu=2FeCl2+CuCl2
(11)铝热反应(金属氧化物
Fe3O4):3Fe3O4+8Al
9Fe+4Al2O3
(12)镁在二氧化碳中燃烧:2Mg+CO2
2MgO+C
(3)氯水滴入
KBr
溶液,比较
Cl2和
Br2的氧化性:
2KBr+Cl2=2KCl+Br2
2.常见非金属及其化合物
(二)重要方程式再现
(2)用烧碱溶液吸收尾气中的
Cl2:Cl2+2NaOH=NaCl+NaClO+H2O
(1)实验室用
MnO2和浓盐酸制氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(4)铜片溶于浓硫酸:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
(5)SO2使溴水褪色:SO2+Br2+2H2O=H2SO4+2HBr
(6)硫化氢与二氧化硫气体混合产生浅黄色沉淀:2H2S+SO2=3S↓+2H2O
(7)SO2型酸雨在空气中放置酸性增强:2H2SO3+O2=2H2SO4
(8)CuSO4溶液吸收
H2S
气体:CuSO4+H2S=CuS↓+H2SO4
2.常见非金属及其化合物
(二)重要方程式再现
(10)氨气的催化氧化反应:4NH3+5O2
4NO+6H2O
(9)实验室用
NH4Cl
取制氨气:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
(11)
铜
溶
于
稀
硝
酸
:
3Cu
+
8HNO3(
稀
)=3Cu(NO3)2+2NO↑+4H2O
(12)久置浓硝酸变黄:4HNO3
4NO2↑+O2↑+2H2O
(13)工业上制取粗硅:SiO2+2C
Si+2CO↑
(14)硅酸钠溶液中通入少量
CO2:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
30
(1)利用次氯酸具有强氧化性可用于漂白织物。
( )
(2)浓HCl制备纯净Cl2时可让气体产物先通过浓H2SO4,后通过饱和食盐水。
( )
(3)漂白粉在空气中久置变质是由于漂白粉中的CaCl2
与空气中的CO2反应生成CaCO3。
( )
(4)液溴易挥发,在存放液溴的试剂瓶中应加水封。
( )
(5)向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色说明Br-的还原性强于Cl-。
( )
×
×
√
√
√
正误判断
30
(6)为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。
( )
(7)等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数相等。
( )
(8)漂白粉在空气中不稳定,可用于漂白纸张。
( )
(9)除去氯气中的HCl气体,装置如图。
( )
(10)向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,现象是溶液变成蓝色,说明氧化性:Cl2>I2。
( )
×
×
×
√
√
正误判断
31
(11)除去Cu粉中混有CuO的操作是加入稀HNO3溶解,过滤、洗涤、干燥。
( )(12)铁比铜金属性强的实际应用是FeCl3腐蚀Cu刻制印刷电路板。( )(13)将铜粉加入1.0
mol·L-1Fe2(SO4)3溶液中,现象是溶液变蓝、有黑色固体出现。
( )(14)铝与Fe2O3发生铝热反应后固体物质增重。
( )(15)H2通过灼热的CuO粉末,反应后固体物质增重。( )(16)FeCl3溶液可用于铜质印刷线路板制作的原理是FeCl3能从含Cu2+的溶液中置换出铜。
( )
×
×
×
×
×
×
正误判断
31
(17)CuSO4溶液中通入CO2气体产生蓝色沉淀。
( )(18)CuSO4溶液与H2S反应的离子方程式为Cu2++S2-=CuS↓。( )(19)气体通过无水CuSO4粉末变蓝,证明原气体中含有水蒸气。
( )(20)浓HNO3中加入过量的Cu,反应生成的气体有NO2和NO。
( )(21)用稀盐酸除去铜锈的离子方程式为CuO+2H+=Cu2++H2O。( )(22)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。
( )
×
×
√
√
√
×
正误判断
32
(23)纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附。
( )(24)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,则说明常温下,铁与浓硫酸一定没有发生化学反应。
( )(25)将稀HNO3加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液呈血红色,说明稀HNO3将铁氧化为Fe3+。
( )(26)将铜粉加入1.0
mol·L-1
Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现,说明金属铁比铜活泼。
( )(27)浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑。( )
×
×
×
×
×
正误判断
32
(28)FeCl3与氢碘酸反应生成棕色物质的离子方程式为
2Fe3++2I-=2Fe2++I2。
( )(29)硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑。
( )(30)磁性氧化铁溶于稀HNO3:Fe3O4+8H+=2Fe3++Fe2++4H2O( )(31)铁在高温下与H2O(g)发生置换反应生成Fe2O3。( )(32)向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液,加入H2O2后溶液变成血红色,说明Fe2+既有氧化性又有还原性。
( )(33)保存FeSO4时可向溶液中加入Fe和稀盐酸。
( )
×
×
×
×
×
√
正误判断
33
(34)将浓HNO3滴入用砂纸打磨过的铝条中,产生红棕色气体。
( )(35)用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明Al的熔点较低。
( )(36)氯化铝溶液滴入浓氢氧化钠溶液中,产生大量白色沉淀。
( )(37)制备Al(OH)3悬浊液:向1
mol·L-1
AlCl3溶液中加过量的6
mol·L-1
NaOH溶液。
( )(38)Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O=2AlO2-+3H2↑。
( )
×
×
×
×
√
正误判断
33
(39)AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O=AlO2-+4NH4++2H2O。
( )(40)明矾净水的原理是明矾水解生成Al(OH)3胶体吸附悬浮物同时杀菌消毒。
( )(41)常温下将Al片放入浓HNO3中无明显现象可得出Al与浓HNO3不反应。
( )(42)向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成。( )(43)做完实验后,剩余的白磷放回原试剂瓶,不能随意丢弃。( )
×
×
×
√
×
正误判断
34
(44)钠在空气中燃烧可生成多种氧化物。23
g钠充分燃烧时转移电子数为NA。
( )
(45)1
L
0.1
mol/L的Na2CO3溶液中CO32-、HCO3-和H2CO3的粒子数之和为0.1NA。
( )
(46)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液,立即产生气泡
( )
(47)用热的烧碱溶液洗去油污,是因为Na2CO3可直接与油污反应。
( )
(48)CO2通过Na2O2粉末后固体物质增重。( )
×
×
√
√
√
正误判断
34
(49)碳酸氢钠受热分解实验如图所示。
( )
(50)Na2O2与水反应是水作还原剂的氧化还原反应。
( )
(51)灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+。
( )
(52)海水中提取镁的过程中,可以将MgCl2溶液蒸干得到MgCl2。( )
(53)保存液溴时向其中加入少量酒精,减少挥发。( )
×
×
×
×
×
正误判断
同课章节目录
