2020-2021学年人教版化学九年级下册 第九单元 课题3 溶液的浓度(ppt 共23张)
文档属性
| 名称 | 2020-2021学年人教版化学九年级下册 第九单元 课题3 溶液的浓度(ppt 共23张) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-13 08:57:19 | ||
图片预览







文档简介
(共23张PPT)
你看到了什么?
想到了什么?
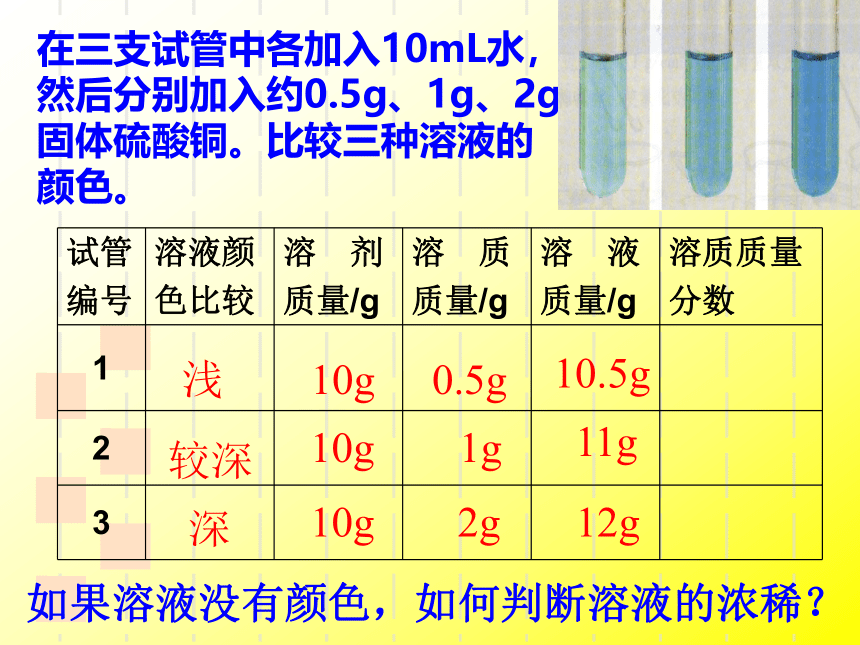
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质质量
分数
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
2g
10.5g
11g
12g
如果溶液没有颜色,如何判断溶液的浓稀?
一、溶质质量分数
溶质质量分数:溶质质量与溶液质量之比
意义:表示一定量溶液中含有溶质的多少
溶质的质量分数=
溶质质量
溶液质量
×100%
溶液的质量=溶质的质量+溶剂的质量
溶质的质量
=
溶液质量
×溶质的质量分数
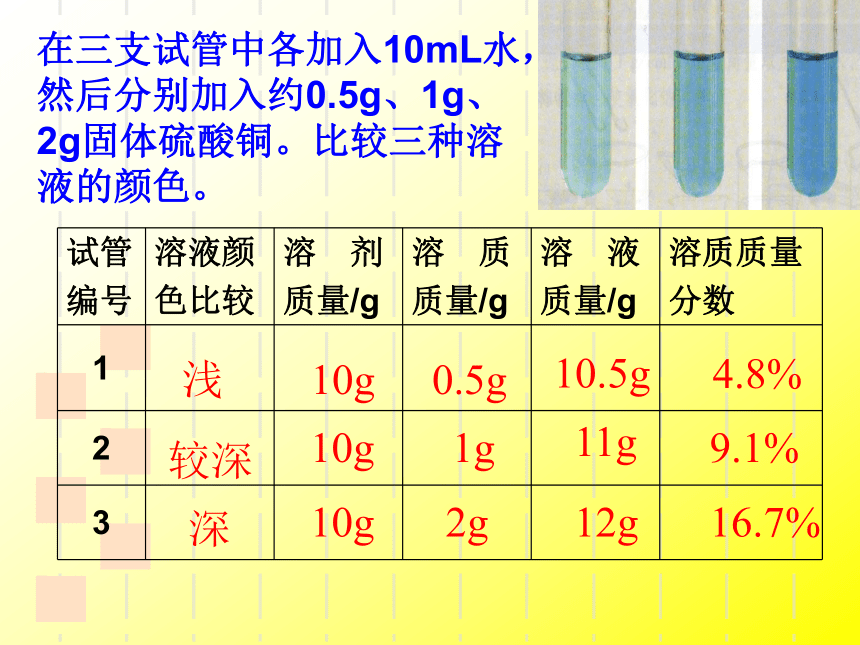
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质质量
分数
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
2g
10.5g
11g
12g
4.8%
9.1%
16.7%
[实验9-6]
溶质质量
溶剂质量
溶液中溶质质量分数
10g
20g
90g
80g
10%
20%
二、溶
质
质
量
分
数
的
计
算
例1、20g食盐溶液中含有
2g食盐,求:该溶液的溶质质量分数
例2、40g
2%的食盐溶液中含有
多少g食盐和水?
含食盐:
40
g×
2%
=
0.8
g
2g
20g
=10%
解:
答:略
解:
答:略
含 水:
40
g
–
0.8g
=
39.2
g
例1:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种.现要配制150g这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量=溶液质量×溶质的质量分数
=150g×16%
=24g
溶剂质量=溶液质量-溶质质量
=150g-24g
=126g
答:需要氯化钠质量为24g,水的质量为126g.
二、溶
质
质
量
分
数
的
计
算
例3、20g
10%的盐水中放入
2g水或2g食盐,求:所得溶液的溶质质量分数。
例4、20g
10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是
10
%
解:
20g
X10%
加水:
20g
+2g
=9.1%
加盐:
20g
X10%+2g
20g
+2g
=18.2%
二、溶
质
质
量
分
数
的
计
算
饱和溶液的
溶质质量分数=
溶解度
100g+溶解度
溶质的质量分数36%
是指:
100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指:
在T0C
时,100g水最多溶解该溶质36g。
溶质质量分数与溶解度的比较
例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
=26.5%
36g
100g+36g
答:
20℃时食盐饱和溶液的溶质质量分数为26.5%
。
2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数
分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度
36
/(100+36)。
解:
x
=
18g
<
20g
则:溶质在溶液中的质量分数为:
×100%
≈
26.5%
100g
36g
=
50g
x
18g
50g+18g
或
36g
100g+36g
练习:现将1克食盐放入烧杯中,再加入9
mL水,用玻璃棒搅拌至全部溶解,再向上述烧杯中加入10mL
水搅拌。(水的密度为1
g
/cm3)填写下表:
溶质
质量
溶剂
质量
溶液
质量
溶质质量分数
稀释前
稀释后
1
g
9g
10g
10%
1g
19g
20g
5%
分析稀释前后各量的变化情况,总结出溶液稀释问题解题的关键是什么?
浓溶液的质量×浓溶液中溶质的质量分数
=
稀溶液的质量×稀溶液中溶质的质量分数
溶液的稀释原理:
根据稀释前后溶质的质量不变.
M浓溶液
×
A
浓%
=
M稀溶液
×
B稀%
例题2:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
[解析]溶液稀释(或浓缩)前后溶质的质量不变。
二、溶液稀释和配制问题的计算
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要水195g。
例题2:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
[解]
设:稀释后溶液的质量为x。
50g
×98%=x×20%
x=(50g×98%)/20%=245g
则水的质量为245g-50g=195g
如果把50g换成50mL,那么还需要什么条件才能解题?
根据公式:
质量
=
密度
×
体积
进行计算。
练习:P45
第2题
第3题
配制步骤:1.计算
2.称量
3.溶解
4.装瓶
例1:(溶质为固体)配制50g质量分数6%的食盐水
计算:需食盐:50
g×
6%
=
3
g
需水:
50
g–
3
g
=
47
g
称量:用天平称量
3
g
食盐
用量筒量取47
mL水
溶解:在烧杯中用玻璃棒搅拌溶解
实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒
三、配制溶质质量分数一定的溶液
装瓶:把配好的溶液装入指定的瓶
中,盖好瓶盖,贴上标签,入柜。
配制溶液操作过程需注意:
注意药品的名称
左“物”右“码”
选用适合量程的量筒
分析结果偏大或偏小的原因:
偏大的原因有:
1、食盐称量多了
2、量筒量水时,俯视刻度读数
偏小的原因有:
3、倒水时,把水倒撒了
1、称量食盐时,左码右物
2、量筒量水时,仰视刻度读数
3、食盐不纯,含有杂质
4、烧杯中事先有水
5、倒食盐时,把食盐倒撒了
回顾旧知
1、溶液稀释问题的计算,关键是什么?
2、配制溶质质量分数一定的溶液需要哪些仪器?步骤是什么?
根据稀释前后溶质的质量不变.
实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒
配制步骤:1.计算
2.称量
3.溶解
4.装瓶
四、溶质质量分数应用于化学方程式的计算
例4:P45-5
100
g某硫酸溶液恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。
思考:1、与锌反应的是硫酸溶液中的哪种成分(溶质、溶剂、溶液)?
2、解出此题的关键是什么?
练习
1、
50
g质量分数为38%的盐酸与足量的大理石反应,生成CO2的质量是多少?这些CO2的体积(标准状况下)是多少?(在标准状况下CO2的密度为1.977g/L)
2、
称取铜、锌混合物粉末10.0
g
置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0
g稀硫酸,剩余固体3.5
g。
(1)该混合物粉末中铜的质量分数为多少?
(2)所用的稀硫酸溶质的质量分数是多少?
你看到了什么?
想到了什么?
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质质量
分数
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
2g
10.5g
11g
12g
如果溶液没有颜色,如何判断溶液的浓稀?
一、溶质质量分数
溶质质量分数:溶质质量与溶液质量之比
意义:表示一定量溶液中含有溶质的多少
溶质的质量分数=
溶质质量
溶液质量
×100%
溶液的质量=溶质的质量+溶剂的质量
溶质的质量
=
溶液质量
×溶质的质量分数
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质质量
分数
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
2g
10.5g
11g
12g
4.8%
9.1%
16.7%
[实验9-6]
溶质质量
溶剂质量
溶液中溶质质量分数
10g
20g
90g
80g
10%
20%
二、溶
质
质
量
分
数
的
计
算
例1、20g食盐溶液中含有
2g食盐,求:该溶液的溶质质量分数
例2、40g
2%的食盐溶液中含有
多少g食盐和水?
含食盐:
40
g×
2%
=
0.8
g
2g
20g
=10%
解:
答:略
解:
答:略
含 水:
40
g
–
0.8g
=
39.2
g
例1:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种.现要配制150g这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量=溶液质量×溶质的质量分数
=150g×16%
=24g
溶剂质量=溶液质量-溶质质量
=150g-24g
=126g
答:需要氯化钠质量为24g,水的质量为126g.
二、溶
质
质
量
分
数
的
计
算
例3、20g
10%的盐水中放入
2g水或2g食盐,求:所得溶液的溶质质量分数。
例4、20g
10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是
10
%
解:
20g
X10%
加水:
20g
+2g
=9.1%
加盐:
20g
X10%+2g
20g
+2g
=18.2%
二、溶
质
质
量
分
数
的
计
算
饱和溶液的
溶质质量分数=
溶解度
100g+溶解度
溶质的质量分数36%
是指:
100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指:
在T0C
时,100g水最多溶解该溶质36g。
溶质质量分数与溶解度的比较
例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
=26.5%
36g
100g+36g
答:
20℃时食盐饱和溶液的溶质质量分数为26.5%
。
2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数
分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度
36
/(100+36)。
解:
x
=
18g
<
20g
则:溶质在溶液中的质量分数为:
×100%
≈
26.5%
100g
36g
=
50g
x
18g
50g+18g
或
36g
100g+36g
练习:现将1克食盐放入烧杯中,再加入9
mL水,用玻璃棒搅拌至全部溶解,再向上述烧杯中加入10mL
水搅拌。(水的密度为1
g
/cm3)填写下表:
溶质
质量
溶剂
质量
溶液
质量
溶质质量分数
稀释前
稀释后
1
g
9g
10g
10%
1g
19g
20g
5%
分析稀释前后各量的变化情况,总结出溶液稀释问题解题的关键是什么?
浓溶液的质量×浓溶液中溶质的质量分数
=
稀溶液的质量×稀溶液中溶质的质量分数
溶液的稀释原理:
根据稀释前后溶质的质量不变.
M浓溶液
×
A
浓%
=
M稀溶液
×
B稀%
例题2:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
[解析]溶液稀释(或浓缩)前后溶质的质量不变。
二、溶液稀释和配制问题的计算
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要水195g。
例题2:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
[解]
设:稀释后溶液的质量为x。
50g
×98%=x×20%
x=(50g×98%)/20%=245g
则水的质量为245g-50g=195g
如果把50g换成50mL,那么还需要什么条件才能解题?
根据公式:
质量
=
密度
×
体积
进行计算。
练习:P45
第2题
第3题
配制步骤:1.计算
2.称量
3.溶解
4.装瓶
例1:(溶质为固体)配制50g质量分数6%的食盐水
计算:需食盐:50
g×
6%
=
3
g
需水:
50
g–
3
g
=
47
g
称量:用天平称量
3
g
食盐
用量筒量取47
mL水
溶解:在烧杯中用玻璃棒搅拌溶解
实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒
三、配制溶质质量分数一定的溶液
装瓶:把配好的溶液装入指定的瓶
中,盖好瓶盖,贴上标签,入柜。
配制溶液操作过程需注意:
注意药品的名称
左“物”右“码”
选用适合量程的量筒
分析结果偏大或偏小的原因:
偏大的原因有:
1、食盐称量多了
2、量筒量水时,俯视刻度读数
偏小的原因有:
3、倒水时,把水倒撒了
1、称量食盐时,左码右物
2、量筒量水时,仰视刻度读数
3、食盐不纯,含有杂质
4、烧杯中事先有水
5、倒食盐时,把食盐倒撒了
回顾旧知
1、溶液稀释问题的计算,关键是什么?
2、配制溶质质量分数一定的溶液需要哪些仪器?步骤是什么?
根据稀释前后溶质的质量不变.
实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒
配制步骤:1.计算
2.称量
3.溶解
4.装瓶
四、溶质质量分数应用于化学方程式的计算
例4:P45-5
100
g某硫酸溶液恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。
思考:1、与锌反应的是硫酸溶液中的哪种成分(溶质、溶剂、溶液)?
2、解出此题的关键是什么?
练习
1、
50
g质量分数为38%的盐酸与足量的大理石反应,生成CO2的质量是多少?这些CO2的体积(标准状况下)是多少?(在标准状况下CO2的密度为1.977g/L)
2、
称取铜、锌混合物粉末10.0
g
置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0
g稀硫酸,剩余固体3.5
g。
(1)该混合物粉末中铜的质量分数为多少?
(2)所用的稀硫酸溶质的质量分数是多少?
同课章节目录
