热点二 气候峰会“碳中和”2021届高考化学热点押题训练 含解析
文档属性
| 名称 | 热点二 气候峰会“碳中和”2021届高考化学热点押题训练 含解析 |  | |
| 格式 | doc | ||
| 文件大小 | 588.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-13 21:45:08 | ||
图片预览


文档简介
热点二 气候峰会“碳中和”2021届高考化学热点押题训练
2021年4月22日晚,习近平主席应邀出席领导人气候峰会并发表重要讲话后,外交部连夜举行中外媒体会议,介绍峰会主要情况和重要成果,中国气候变化事务特使和国家发展和改革委员会、生态环境部相关负责人通过视频连线方式与会,阐释我气候变化领域重大政策主张,并回答了记者提问。
有关负责人表示,习近平主席应邀出席领导人气候峰会并发表重要讲话,再次彰显了中国对气候变化问题的高度重视,以及对全球环境治理的大国担当,具有十分重要的现实意义和深远历史意义。习近平主席在讲话中首次全面系统阐释了“人与自然生命共同体”理念的丰富内涵和核心要义。
绿水青山就是金山银山。生态园林建设可以吸收更多的二氧化碳,这与“碳中和”目标一致。山清水秀是每一代人最宝贵的财富,锦绣山河才能让梦想源远流长。碳中和的含义是减少含碳温室气体的排放,采用合适的技术固碳,最终达到平衡。人类对能源利用的探索历程,实际上是从利用核外电子到利用核内电子的过程,但这恰是宇宙、物质、能源发展的逆过程。
“碳中和”对我国到底意味着什么?
一是我国碳排放下降斜率更大。
二是能源转型首当其冲,要实现“碳中和”,能源转型首当其冲。
三是通过工艺改造、节能等降耗的措施减少二氧化碳的排放在能源的产生、转换、消费过程。
1.“十四五”是我国实现2030年碳达峰时期,以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是( )
A.利用太阳能制氢气 B.用纯液态有机物代替水作溶剂
C.举行“地球一小时”熄灯活动 D.不使用一次性塑料制品
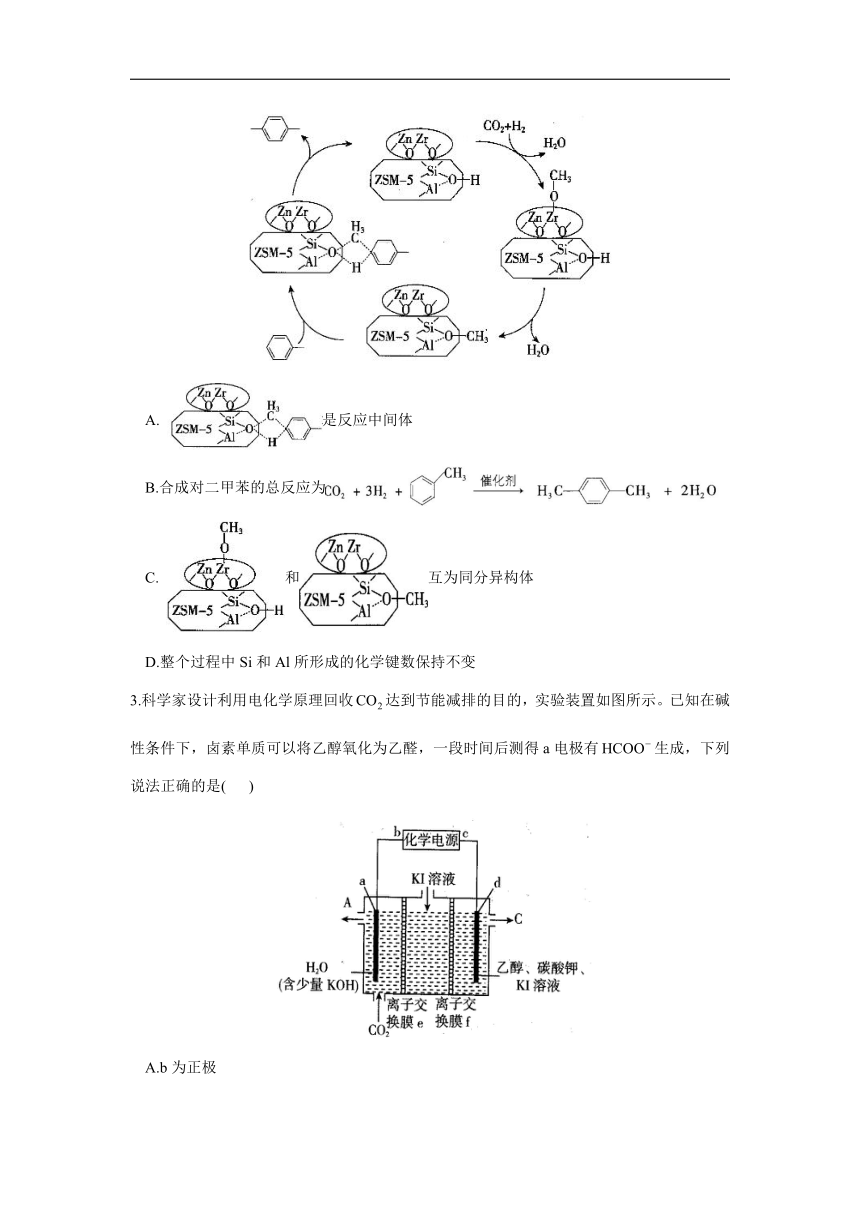
2.二氧化碳加氢与甲苯烷其化耦合制对二甲苯的反应机理如图所示。下列叙述错误的是( )
A. 是反应中间体
B.合成对二甲苯的总反应为
C. 和互为同分异构体
D.整个过程中Si和Al所形成的化学键数保持不变
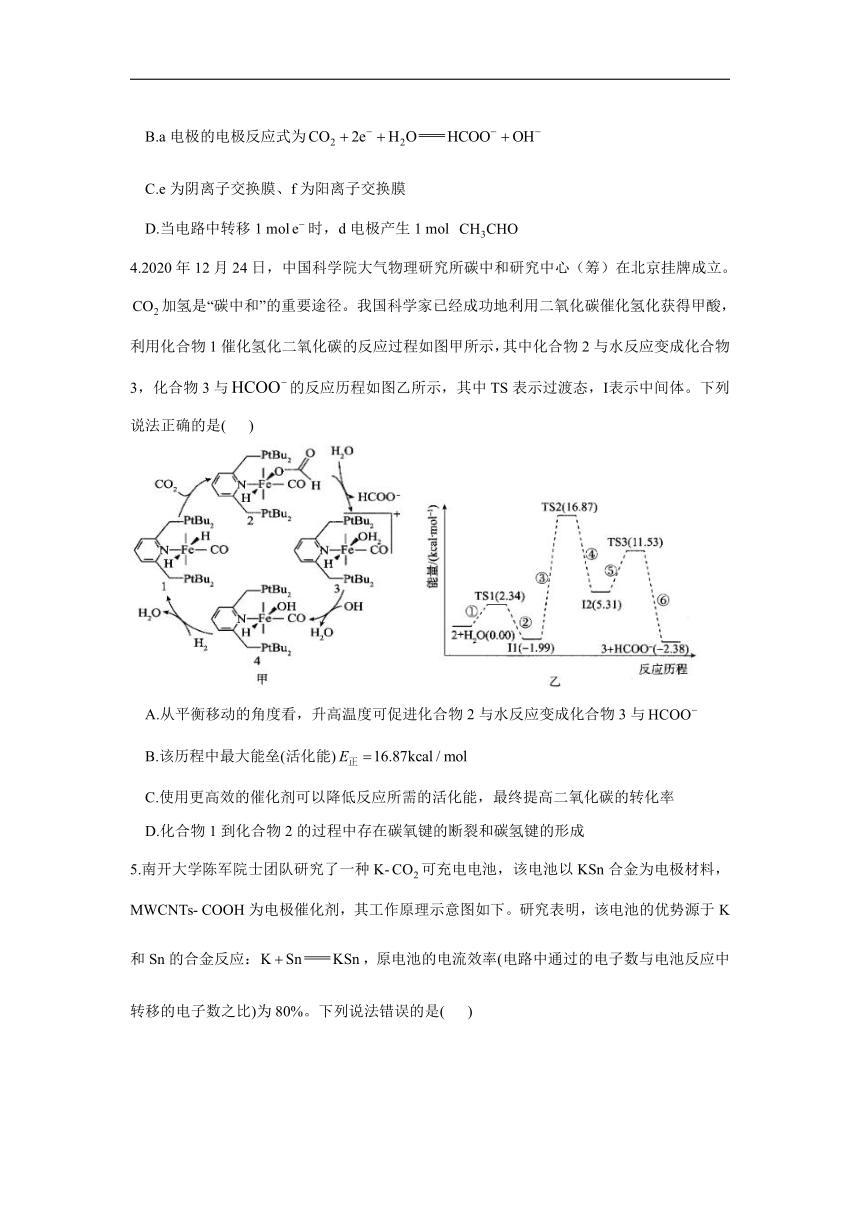
3.科学家设计利用电化学原理回收达到节能减排的目的,实验装置如图所示。已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛,一段时间后测得a电极有生成,下列说法正确的是( )
A.b为正极
B.a电极的电极反应式为
C.e为阴离子交换膜、f为阳离子交换膜
D.当电路中转移1 mol时,d电极产生1 mol
4.2020年12月24日,中国科学院大气物理研究所碳中和研究中心(筹)在北京挂牌成立。加氢是“碳中和”的重要途径。我国科学家已经成功地利用二氧化碳催化氢化获得甲酸,利用化合物1催化氢化二氧化碳的反应过程如图甲所示,其中化合物2与水反应变成化合物3,化合物3与的反应历程如图乙所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是( )
A.从平衡移动的角度看,升高温度可促进化合物2与水反应变成化合物3与
B.该历程中最大能垒(活化能)
C.使用更高效的催化剂可以降低反应所需的活化能,最终提高二氧化碳的转化率
D.化合物1到化合物2的过程中存在碳氧键的断裂和碳氢键的形成
5.南开大学陈军院士团队研究了一种K-可充电电池,该电池以KSn合金为电极材料, MWCNTs- COOH为电极催化剂,其工作原理示意图如下。研究表明,该电池的优势源于K和Sn的合金反应:,原电池的电流效率(电路中通过的电子数与电池反应中转移的电子数之比)为80%。下列说法错误的是( )
A.放电时,Y极的电极反应式为
B.放电时,由Y极向X极方向迁移
C.放电时,外电路中每转移1 mol,消耗16.8 L(标准状况)
D.充电时,X极的电极反应式为
6.氢最有可能成为21世纪的新型能源,以煤的转化为基础的制氢方法是一个重要的研究方向。某温度下,炭水气化炉中的主要反应如下:
①
②
氢气参加的副反应主要有(不考虑其他副反应):
③
利用氧化钙吸收二氧化碳:
④
(指用平衡体系中各气体分压求得的平衡常数,如反应①的,各气体分压为该气体的物质的量分数与体系总压的乘积)
(1)写出C(s)与水蒸气反应生成二氧化碳气体与氢气的热化学方程式:_______________。该反应的=_________________________。
(2)该温度下,将一定物质的量的C(s)、2 mol 与56 g充入的气化炉中,3 min后达平衡状态,气化炉内压强为25 MPa,此时混合气体的总物质的量为2.07 mol,CO的物质的量为0.36 mol,固体CaO增重0.572 g,则0~3 min内用CO表示反应①的反应速率为______________________________。
(3)研究表明气化炉平衡体系中各组分的物质的量分数受温度影响如图所示。
900℃时,平衡混合气中CO与的含量均接近50%,而与接近0,原因是_______
_________________________。
(4)气化炉制取水煤气时,气化前常先通入氧气燃烧部分煤,再通入水蒸气,目的是________________________,反应一段时间,需停止通水蒸气,再次通入氧气,如此不断循环操作,实现水煤气的制取过程。第二次通入氧气前应先用水蒸气对气化炉吹扫后方可通入,目的是__________________________________。
(5)水煤气是工业制取氨气的原料气,是重要的氢源,但CO会造成催化剂中毒。欲除去原料气中的CO,可通过转换反应②实现,若只考虑反应②,下列可提高CO平衡转化率的措施有______________________________。
A.充入水蒸气 B.升高温度 C.增大压强 D.及时分离出二氧化碳
答案以及解析
1.答案:B
解析:所谓低碳经济,是指在可持续发展理念指导下,通过技术创新、制度创新、产业转型、新能源开发等多种手段,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。发展氢能和太阳能,不使用难降解的塑料制品和举行“地球一小时”熄灯活动,都符合低碳经济。
2.答案:C
解析:本题考查二氧化碳加氢与甲苯烷基化耦合制对二甲苯的反应机理。由反应机理可知,是催化剂,是反应中间体,A项正确;由反应机理图可知,、为反应物,、为生成物,反应的化学方程式为,B项正确;由分子组成可知,和之间分子组成相差一个OH,二者不互为同分异构体,C项错误:由反应机理图可知,整个过程中Si都是形成4个共价键,Al形成的化学键数目也保持不变,D项正确。
3.答案:B
解析:a电极上转化为,发生还原反应,电极反应式为,则a为阴极、b为负极,A错误、B正确;a电极上转化为,需要补充阳离子保持溶液电荷守恒,所以e为阳离子交换膜,透过阳离子交换膜进入阴极室,f为阴离子交换膜,C错误;d电极的电极反应式为,溶液中发生反应,当电路中转移1 mol时,d电极产生0.5 mol ,D错误。
4.答案:D
解析:由化合物2与水反应变成化合物3与的反应历程图可得该过程是放热反应,升高温度,不利于该过程的进行,A错误;该历程中I1到TS2过程的能垒(活化能)最大,为,B错误;使用更高效的催化剂可以改变反应途径,降低反应所需的活化能,但不能使化学平衡发生移动,不能提高二氧化碳的转化率,C错误;根据化合物1与化合物2的结构可知,在化合物1()与反应生成化合物2()的过程中存在碳氧键的断裂和碳氢键的形成,D正确。
5.答案:C
解析:由信息可知KSn类似“化合物”,书写电极反应式时不能拆开写,故电极反应式为,A项正确;放电时,X为正极,Y为负极,向正极方向移动,B项正确;放电时,正极反应式为,电流效率为80%,故外电路中转移1 mol时,实际上消耗()mol,即消耗标准状况下21 L,C项错误;充电时,X极为阴极,根据电子得失守恒、原子守恒可得电极反应式为,D项正确。
6.答案:(1);12.75
(2)
(3)反应①为吸热反应,升高温度对反应有利,而其余反应均为放热反应,高温不利于反应正向进行,故900℃主要发生反应①(合理即可)
(4)为气化反应提供所需的热量;防止炉内残留的可燃性气体发生爆炸
(5)AD
解析:(1)根据盖斯定律,反应①与反应②相加可得,则其焓变,故C(s)与水蒸气反应生成二氧化碳气体与氢气的热化学方程式为
,其化学平衡常数。
(2)已知反应④的,可得平衡时;由题意知平衡体系中,,反应混合气体的总物质的量,则平衡混合气中物质的量;又由固体增重0.572 g,可知参加反应④的CO2的物质的量为;则反应②消耗CO的物质的量为,又知平衡体系中CO的物质的量为0.36 mol,所以反应①生成CO的总物质的量为0.103 mol+0.36 mol=0.463 mol,故用CO表示的反应①的速率为。
(3)由题目所给热化学方程式,可看出反应①为吸热反应、②③④均为放热反应,结合图像,CO与的百分含量随温度升高而升高,可推知900℃时,平衡混合气中CO与的含量均接近50%,而与接近0,原因是反应①为吸热反应,升高温度对反应有利,而其余反应均为放热反应,高温不利于反应正向进行,故900℃主要发生反应①。
(4)气化炉制取水煤气需在高温下进行,因此气化前要先通入氧气燃烧部分煤,为气化反应提供热量;随着反应的进行,特别是高温下主要发生的是吸热反应,炉内温度不断降低,因此一段时间后,需停止通水蒸气,再次通入氧气,通过煤燃烧放出热量以提高气化炉内温度,如此不断循环操作,实现水煤气的制取。在第二次通入氧气前,炉内会有残留的水煤气,因此应先用水蒸气对气化炉进行吹扫,除去水煤气,防止发生爆炸。
(5)对于反应 ,充入水蒸气,,平衡正向移动,CO的转化率增大,A正确;该反应为放热反应,升高温度,平衡逆向移动,CO转化率减小,B错误;该反应为前后气体分子数不变的反应,增大压强,平衡不受影响,C错误;及时分离出二氧化碳,,平衡正向移动,CO的转化率增大, D正确。
2021年4月22日晚,习近平主席应邀出席领导人气候峰会并发表重要讲话后,外交部连夜举行中外媒体会议,介绍峰会主要情况和重要成果,中国气候变化事务特使和国家发展和改革委员会、生态环境部相关负责人通过视频连线方式与会,阐释我气候变化领域重大政策主张,并回答了记者提问。
有关负责人表示,习近平主席应邀出席领导人气候峰会并发表重要讲话,再次彰显了中国对气候变化问题的高度重视,以及对全球环境治理的大国担当,具有十分重要的现实意义和深远历史意义。习近平主席在讲话中首次全面系统阐释了“人与自然生命共同体”理念的丰富内涵和核心要义。
绿水青山就是金山银山。生态园林建设可以吸收更多的二氧化碳,这与“碳中和”目标一致。山清水秀是每一代人最宝贵的财富,锦绣山河才能让梦想源远流长。碳中和的含义是减少含碳温室气体的排放,采用合适的技术固碳,最终达到平衡。人类对能源利用的探索历程,实际上是从利用核外电子到利用核内电子的过程,但这恰是宇宙、物质、能源发展的逆过程。
“碳中和”对我国到底意味着什么?
一是我国碳排放下降斜率更大。
二是能源转型首当其冲,要实现“碳中和”,能源转型首当其冲。
三是通过工艺改造、节能等降耗的措施减少二氧化碳的排放在能源的产生、转换、消费过程。
1.“十四五”是我国实现2030年碳达峰时期,以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是( )
A.利用太阳能制氢气 B.用纯液态有机物代替水作溶剂
C.举行“地球一小时”熄灯活动 D.不使用一次性塑料制品
2.二氧化碳加氢与甲苯烷其化耦合制对二甲苯的反应机理如图所示。下列叙述错误的是( )
A. 是反应中间体
B.合成对二甲苯的总反应为
C. 和互为同分异构体
D.整个过程中Si和Al所形成的化学键数保持不变
3.科学家设计利用电化学原理回收达到节能减排的目的,实验装置如图所示。已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛,一段时间后测得a电极有生成,下列说法正确的是( )
A.b为正极
B.a电极的电极反应式为
C.e为阴离子交换膜、f为阳离子交换膜
D.当电路中转移1 mol时,d电极产生1 mol
4.2020年12月24日,中国科学院大气物理研究所碳中和研究中心(筹)在北京挂牌成立。加氢是“碳中和”的重要途径。我国科学家已经成功地利用二氧化碳催化氢化获得甲酸,利用化合物1催化氢化二氧化碳的反应过程如图甲所示,其中化合物2与水反应变成化合物3,化合物3与的反应历程如图乙所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是( )
A.从平衡移动的角度看,升高温度可促进化合物2与水反应变成化合物3与
B.该历程中最大能垒(活化能)
C.使用更高效的催化剂可以降低反应所需的活化能,最终提高二氧化碳的转化率
D.化合物1到化合物2的过程中存在碳氧键的断裂和碳氢键的形成
5.南开大学陈军院士团队研究了一种K-可充电电池,该电池以KSn合金为电极材料, MWCNTs- COOH为电极催化剂,其工作原理示意图如下。研究表明,该电池的优势源于K和Sn的合金反应:,原电池的电流效率(电路中通过的电子数与电池反应中转移的电子数之比)为80%。下列说法错误的是( )
A.放电时,Y极的电极反应式为
B.放电时,由Y极向X极方向迁移
C.放电时,外电路中每转移1 mol,消耗16.8 L(标准状况)
D.充电时,X极的电极反应式为
6.氢最有可能成为21世纪的新型能源,以煤的转化为基础的制氢方法是一个重要的研究方向。某温度下,炭水气化炉中的主要反应如下:
①
②
氢气参加的副反应主要有(不考虑其他副反应):
③
利用氧化钙吸收二氧化碳:
④
(指用平衡体系中各气体分压求得的平衡常数,如反应①的,各气体分压为该气体的物质的量分数与体系总压的乘积)
(1)写出C(s)与水蒸气反应生成二氧化碳气体与氢气的热化学方程式:_______________。该反应的=_________________________。
(2)该温度下,将一定物质的量的C(s)、2 mol 与56 g充入的气化炉中,3 min后达平衡状态,气化炉内压强为25 MPa,此时混合气体的总物质的量为2.07 mol,CO的物质的量为0.36 mol,固体CaO增重0.572 g,则0~3 min内用CO表示反应①的反应速率为______________________________。
(3)研究表明气化炉平衡体系中各组分的物质的量分数受温度影响如图所示。
900℃时,平衡混合气中CO与的含量均接近50%,而与接近0,原因是_______
_________________________。
(4)气化炉制取水煤气时,气化前常先通入氧气燃烧部分煤,再通入水蒸气,目的是________________________,反应一段时间,需停止通水蒸气,再次通入氧气,如此不断循环操作,实现水煤气的制取过程。第二次通入氧气前应先用水蒸气对气化炉吹扫后方可通入,目的是__________________________________。
(5)水煤气是工业制取氨气的原料气,是重要的氢源,但CO会造成催化剂中毒。欲除去原料气中的CO,可通过转换反应②实现,若只考虑反应②,下列可提高CO平衡转化率的措施有______________________________。
A.充入水蒸气 B.升高温度 C.增大压强 D.及时分离出二氧化碳
答案以及解析
1.答案:B
解析:所谓低碳经济,是指在可持续发展理念指导下,通过技术创新、制度创新、产业转型、新能源开发等多种手段,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。发展氢能和太阳能,不使用难降解的塑料制品和举行“地球一小时”熄灯活动,都符合低碳经济。
2.答案:C
解析:本题考查二氧化碳加氢与甲苯烷基化耦合制对二甲苯的反应机理。由反应机理可知,是催化剂,是反应中间体,A项正确;由反应机理图可知,、为反应物,、为生成物,反应的化学方程式为,B项正确;由分子组成可知,和之间分子组成相差一个OH,二者不互为同分异构体,C项错误:由反应机理图可知,整个过程中Si都是形成4个共价键,Al形成的化学键数目也保持不变,D项正确。
3.答案:B
解析:a电极上转化为,发生还原反应,电极反应式为,则a为阴极、b为负极,A错误、B正确;a电极上转化为,需要补充阳离子保持溶液电荷守恒,所以e为阳离子交换膜,透过阳离子交换膜进入阴极室,f为阴离子交换膜,C错误;d电极的电极反应式为,溶液中发生反应,当电路中转移1 mol时,d电极产生0.5 mol ,D错误。
4.答案:D
解析:由化合物2与水反应变成化合物3与的反应历程图可得该过程是放热反应,升高温度,不利于该过程的进行,A错误;该历程中I1到TS2过程的能垒(活化能)最大,为,B错误;使用更高效的催化剂可以改变反应途径,降低反应所需的活化能,但不能使化学平衡发生移动,不能提高二氧化碳的转化率,C错误;根据化合物1与化合物2的结构可知,在化合物1()与反应生成化合物2()的过程中存在碳氧键的断裂和碳氢键的形成,D正确。
5.答案:C
解析:由信息可知KSn类似“化合物”,书写电极反应式时不能拆开写,故电极反应式为,A项正确;放电时,X为正极,Y为负极,向正极方向移动,B项正确;放电时,正极反应式为,电流效率为80%,故外电路中转移1 mol时,实际上消耗()mol,即消耗标准状况下21 L,C项错误;充电时,X极为阴极,根据电子得失守恒、原子守恒可得电极反应式为,D项正确。
6.答案:(1);12.75
(2)
(3)反应①为吸热反应,升高温度对反应有利,而其余反应均为放热反应,高温不利于反应正向进行,故900℃主要发生反应①(合理即可)
(4)为气化反应提供所需的热量;防止炉内残留的可燃性气体发生爆炸
(5)AD
解析:(1)根据盖斯定律,反应①与反应②相加可得,则其焓变,故C(s)与水蒸气反应生成二氧化碳气体与氢气的热化学方程式为
,其化学平衡常数。
(2)已知反应④的,可得平衡时;由题意知平衡体系中,,反应混合气体的总物质的量,则平衡混合气中物质的量;又由固体增重0.572 g,可知参加反应④的CO2的物质的量为;则反应②消耗CO的物质的量为,又知平衡体系中CO的物质的量为0.36 mol,所以反应①生成CO的总物质的量为0.103 mol+0.36 mol=0.463 mol,故用CO表示的反应①的速率为。
(3)由题目所给热化学方程式,可看出反应①为吸热反应、②③④均为放热反应,结合图像,CO与的百分含量随温度升高而升高,可推知900℃时,平衡混合气中CO与的含量均接近50%,而与接近0,原因是反应①为吸热反应,升高温度对反应有利,而其余反应均为放热反应,高温不利于反应正向进行,故900℃主要发生反应①。
(4)气化炉制取水煤气需在高温下进行,因此气化前要先通入氧气燃烧部分煤,为气化反应提供热量;随着反应的进行,特别是高温下主要发生的是吸热反应,炉内温度不断降低,因此一段时间后,需停止通水蒸气,再次通入氧气,通过煤燃烧放出热量以提高气化炉内温度,如此不断循环操作,实现水煤气的制取。在第二次通入氧气前,炉内会有残留的水煤气,因此应先用水蒸气对气化炉进行吹扫,除去水煤气,防止发生爆炸。
(5)对于反应 ,充入水蒸气,,平衡正向移动,CO的转化率增大,A正确;该反应为放热反应,升高温度,平衡逆向移动,CO转化率减小,B错误;该反应为前后气体分子数不变的反应,增大压强,平衡不受影响,C错误;及时分离出二氧化碳,,平衡正向移动,CO的转化率增大, D正确。
同课章节目录
