专题复习: 突破2012年理综化学无机化工工艺流程图试题
文档属性
| 名称 | 专题复习: 突破2012年理综化学无机化工工艺流程图试题 |
|
|
| 格式 | zip | ||
| 文件大小 | 346.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-18 00:00:00 | ||
图片预览




文档简介
专题复习一 突破2012年理综化学无机化工工艺流程图试题
1. 某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
已知:① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
② IV中的电解反应式为MnSO4+ZnSO4+2H2OMnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是__________ ______。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;II需要加热的原因是 ;C的化学式是________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______。
2. 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
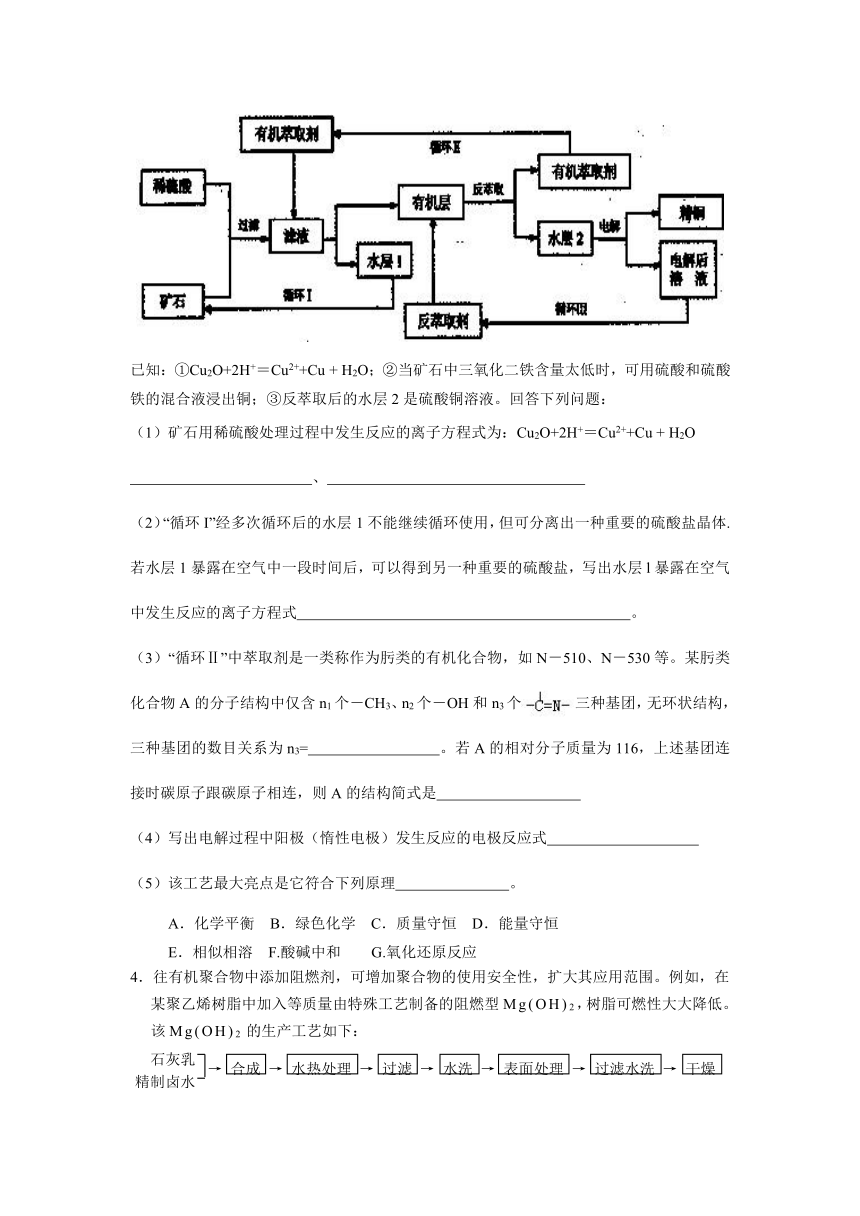
3. 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
(5)该工艺最大亮点是它符合下列原理 。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
4.往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],
反应的化学方程式 。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
[Mg(OH)2-xClx·mH2O]==(1-)Mg(OH)2+MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
(4)已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g); △H1=+81.5kJ·mol-1
Al(OH)3(s)=Al2O3(s)+H2O(g); △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:A、卤系,如四溴乙烷;B、磷系,如磷酸三苯酯;C、无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
5. 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
物质 Fe(OH)3 Fe(OH)2 Mn(OH)2
开始沉淀pH 2.7 7.6 8.3
完全沉淀pH 3.7 9.6 9.8
物质 MnS CuS PbS
Ksp 2.5×10-13 6.3×10-36 8.0×10-28
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2+SO2===MnSO4 2Fe3++SO2+2H2O====2Fe2++SO42—+4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填写工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为____________,这样设计的目的和原理是_______________________________________________________。
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
6. 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3 +7KCl+12H2O,
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
(2)操作③的目的是什么,用简要的文字说明: 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
7.工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
(1)原料A的名称是__________,步骤①反应的离子方程式是_______________________。
(2)滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:___________________________________________。
(3)步骤③的化学方程式是:___________________________________________。
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响_______________________________________________________________________。
8.在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
请回答下列问题:
(1)镉在元素周期表中第 周期,第 族。
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属的名称是 ,如何处理“溶液1”? 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
9.为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的
稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱
性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如下:
(1)碘的原子序数为 。
(2)碘、氯酸钾和水混合后的反应为:I2+KClO3+H2OKH(IO3)2+KCl+Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
。
(3)混合反应后,用稀酸酸化的作用是 ,在稀盐酸和稀硝酸中不能选用的酸是 ,理由是
(4)X的化学式为 写出用试剂X调节pH的化学方程式
(5)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么影响?
。
10.某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:
。
11.科学家从化肥厂生产的(NH4)2SO4中检验出组成为N2H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N2H4+两种形式存在,植物的根系极易吸收N4H4+
,但它遇到碱时,会生成一种形似白磷的N4分子,N4不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)与草木灰混合使用。
(3)已知白磷、NH4+、N4H4+的空间构形均为四面体,NH4+的结构为:
(→表示共用电子对有N原子单方面提供),白磷(P4)的结构为
请画出N4H4+的结构式:
(4)已知液氨中存在着平衡:2NH3NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)
和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”在此溶液中加入少
量的强酸或者强碱时,溶液的 pH几乎不变,这可由下列离子方程式来说明。
加酸时:NH3·H2O+H+=NH4++H2O
加碱时:NH4++OH-= NH3·H2O
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c(H+)与c(OH-)基本保持不变; 含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或者强碱时发生的离子反应方程式:
加酸时: ;
加碱时: 。
12.生产重铬酸钠的专业厂是用铬铁矿(主要成分是Cr2O3.FeO,还有一定量的Al2O3等)为原料的,其生产过程如下:
(1)Cr元素所在周期表中的位置
(2)在特制熔炉中将铬铁矿和过量纯碱混合,在1100℃左右通空气进行氧化:Cr2O3发生反应的化学方程式:
___Cr2O3 + Na2CO3 + O2 == Na2CrO4 + CO2↑
Al2O3发生反应的化学方程式: 。
(3)经上述过程后的反应料(称熟料),冷却后用水浸取,其中可溶性的物质主要有 ,不溶性杂质经过滤后除去。
(4)为了除去滤液中的铝元素,用稀硫酸将溶液中和至PH为7~8,其反应的离子方程式为 。
(5)除去铝元素后的滤液,再用稀硫酸调到PH为2~3,这时可得Na2Cr2O7溶液,其反应方程式为:
Na2CrO4 + H2SO4 —— + +
(6)请简述在实验室中可通过哪些操作可除去溶液中所混有的硫酸钠晶体,从而得到较纯的重铬酸钠溶液。(已知硫酸钠的溶解度随温度的变化较大,而重铬酸钠变化较小。)
13.(Ⅰ)氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下:
依据上图完成下列填空:
(1)与电源正极相连的电极上所发生反应的化学方程式为___________________;与电源负极相连的电极附近,溶液的pH__________(选填“不变”“升高”“降低”)。
(2)工业食盐含Ca2+、Mg2+、Fe3+等杂质,精制过程中发生反应的离子方程式为 ______________________ 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 _____(选填a、b、c)。a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH;后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、_______________(填写操作名称)除去NaCl。
(6)由图示可知用离子交换膜法电解制碱工艺中___________产品可循环使用。
(7)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g 经分析,电解后溶液密度为1.37 g·cm-3,其中含有20g NaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1。
(Ⅱ) 在隔膜法电解食盐水(见下页图)过程中,与电源正极相联的电极上所发生反应为
与电源负极相连的电极附近溶液的pH___________(填:升高、下降或不变)。
若采用无隔膜电解冷的食盐水时,Cl2与 NaOH充分接触,
产物仅是NaClO和H2,相应的化学方程式为:
____________________________。
由隔膜法电解食盐水中离子交换膜的功能,进行大胆设
想,能否用电解饱和Na2SO4溶液的方法生产NaOH和
H2SO4 。若能,参照上图在方框内试画出装置
示意图。
14.制取纯净CuCl2·2H2O的生产过程是:
(1)用粗CuO(含少量铁)溶解在足量的稀盐酸里加热、过滤,得到CuCl2(含FeCl2)的溶液,经测定,溶液的PH植为3。
(2)对(1)的溶液按下列步骤进行提纯:
已知:①可做氧化剂的物质有(A)KMnO4 (B)K2Cr2O7 (C)H2O2 (D)NaClO
②Cu2+ 、Fe2+在PH值为4~5时不水解,而Fe3+却几乎全部水解。
试回答:
(1)加入的氧化剂X是(答编号): ;
加入X的作用是: ;
反应的离子方程式是: 。
(2)物质Y是 ;沉淀Z是 。加入Y能形成沉淀Z的原因是: 。
(3)分离出沉淀Z,并将溶液III蒸发欲获得晶体CuCl2·2H2O。采取什么措施才能顺利得到晶体CuCl2·2H2O?______________________ 。
15.辉钼矿(MoS2)是钼最重要的矿物。图26—1是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图26—2给出了各炉层的固体物料的摩尔百分组成。
已知:MoS2焙烧生成1molMoO3的反应热为△H1=-1011KJ/mol,MoO2氧化生成1molMoO3的反应热为△H2=-154KJ/mol。试回答:
(1)辉钼矿焙烧生成MoO3的反应中被氧化的元素是: ;指出辉钼矿焙烧生成的尾气对环境的一种危害: 。
(2)第6炉层存在的固体物质分别是: ;它们的物质的量之比是: 。
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是: 。
(4)图26—2表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的化学方程式: 。
(5)通过(3)和(4)你能解释为什么中间炉层(4~6)的炉温比上下炉层的炉温低吗?
________________________________________________________________。
突破2012年理综化学无机化工工艺流程图试题参考答案
1.(1) MnSO4 (2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;H2SO4 (3) Fe2O3、Al2O3、S (4)纯碱 、H2SO4(5)降温结晶 (6)1.03(或1)
2.(1)温度较低(2)2NaCl + 2H2O2NaOH + H2↑ + Cl2↑(3)Fe元素的化合价显+6价,易得电子(4)10 mol/L(5)AC(6)KNO3 KCl, KNO3可用于化肥,炸药等(合理就给分)
3.(1)CuO+2H+=Cu2++H2O,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+
(2)4Fe2++O2+4H+=4Fe3++2H2O (3)n3=n1+n2-2
(4)4OH- -4e-=2H2O+O2 (5)B
4.⑴2MgCl2+(2-X)Ca(OH) 2+2mH2O2[Mg(OH)2-XClx ·mH2O]+(2-X)CaCl2
⑵除去附着在Mg(OH)2表面的可溶性物质MgCl2 、CaCl2 等。⑶表面处理。
⑷①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。②Mg(OH)2 Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1 等质量的Mg(OH)2比Al(OH)3吸热多。
⑸C 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2和Al(OH)3无烟、无毒、腐蚀性小。
5.(1)小,工业制备硫酸。 (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀。
(4)使MnCO3沉淀完全。MnCO3沉淀量少,NH4HCO3与酸反应。(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)
6. ⑴Al2O3 + Na2CO32NaAlO2 +CO2↑;SiO2 +Na2CO3 Na2SiO3 + CO2↑
⑵由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2OHSiO3-+OH-,HSiO3-+H2OH2SiO3+OH-,AlO2-+H2OAl(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全。⑶2CrO42-+2H+ Cr2O72-+H2O ⑷①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去 ②94.08%
7.(1)盐酸(硫酸、硝酸);Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
(2)NaOH ;H++OH-=H2O ;Fe3++3OH-=Fe(OH)3 ↓ ;Al3++4OH-=AlO2-+2H2O
(3)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
8.(1)5,ⅡB (2)Cd+2H+=Cd2++H2↑,Zn+2H+=Zn2++H2↑ (3)锌,回收炼锌
(4)阴、镉板 (5)Cd2++S2-=CdS↓
9.(1)53 (2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
(3)促进氯气从反应混合物中逸出;稀盐酸;盐酸还原已生成的碘酸氢钾。
(4)KOH;KH(IO3)2+KOH=2KIO3+H2O (5)反应产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾。
10.(1)硫 铜 Na2SO4 (2)ⅡB 三 (3)过滤
(4)MnO2+MS+2H2SO4==MnSO4+ MSO4+S↓+2H2O(5)Fe(OH)3、Al(OH)3
(6)MnSO4+ ZnSO4+2H2OMnO2+Zn+2H2SO4(7)新工艺不需要高温焙烧,大大节约了能源(燃料)(或旧工艺高温焙烧产生大气污染物SO2,新工艺不产生有害气体;或新工艺许多物质都可以循环利用)
11. (1)D (2)不能 (4)8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O
(5)HPO42-+H+=H2PO4- H2PO4-+OH-= HPO42-+H2O
12.(1) 第四周期第VIB族
(2) 2 Cr2O3 + 4 Na2CO3 + 3 O2 == 4 Na2CrO4 + 4 CO2↑
Al2O3 + Na2CO3 == 2NaAlO2 + CO2↑
(3)Na2CO3、Na2CrO4、NaAlO2
(4)AlO2- + H+ + H2O == Al(OH)3 CO32- + H+ == HCO3-
(5)2 Na2CrO4 + H2SO4 == Na2Cr2O7 + Na2SO4 + H2O (6)加热、浓缩、冷却、结晶、过滤
13.(Ⅰ)(1)2Cl—2e=Cl2 ↑ 升高
(2)Ca2++CO32-=CaCO3 ↓;Mg2++2OH-=Mg(OH)2↓ ;Fe3++3OH-=Fe(OH)3↓
(3)a、c (4)b 、c (5)蒸发 过滤 (6)NaCl (或淡盐水) (7)7.14
(Ⅱ)2Clˉ- 2eˉ== Cl2↑ 升高
NaCl +H2O NaClO + H2 ↑
或 2 NaCl + 2 H2OH2↑ + Cl2↑+ 2NaOH
Cl2 + 2NaOH ==== NaCl + NaClO + H2O
能;图如右。
14.(1)C;把Fe2+ 氧化成Fe3+;
2Fe2++H2O2+2H+=2Fe3++2H2O
(2)CuO或Cu(OH)2或CCO3;Fe(OH)3(若有Y也不扣分);CuO与H+反应,使溶液的PH值升高,促进了Fe3+的水解,当PH值为4~5时,Fe3+几乎完全水解生成Fe(OH)3。
(3)用HCl气体做保护气,防止CuCl2水解。
15.(1)Mo和S;形成酸雨(合理即得分)。 (2)MoS2、MoO3、MoO2;1:1:3。
(3)MoS2 (s)+ 3.5O2 (g)= MoO3(s) + 2SO2(g) △H1=-1011KJ/mol (4)MoS2 + 6MoO3 = 7MoO2 + 2SO2(不标条件不扣分) (5)由① MoS2 (s)+ 3.5O2 (g)= MoO3(s) + 2SO2(g) △H1=-1011KJ/mol和 ② MoO2(s)+ 0.5O2 (g)= MoO3(s) △H2=-154KJ/mol得反应③MoS2 (s)+ 6MoO3 (s)= 7MoO2 (s)+ 2SO2(g) △H3=△H1-7△H2=-1011KJ/mol-(-154KJ/mol)×7=+67KJ/mol,因为△H3>0,故反应③是吸热反应,因其发生在中间层,故炉温降低。
稀硫酸、闪锌矿粉、软锰矿粉
加热、浸取(I)
A
B(III)
加热(II)
电解(IV)
Na2SO4
过滤,回收S
过滤、灼热,回收Fe2O3、Al2O3
MnCO3、Zn2(OH)2CO3
回收MnO2、Zn
C
Na2CO3
石灰乳
精制卤水
→ 合成 → 水热处理 → 过滤 → 水洗 → 表面处理 → 过滤水洗 → 干燥
+
-
O2
H2
Na2SO4溶液
NaOH
H2SO4
阴离子交换膜
阳离子交换膜
1. 某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
已知:① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
② IV中的电解反应式为MnSO4+ZnSO4+2H2OMnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是__________ ______。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;II需要加热的原因是 ;C的化学式是________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______。
2. 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
3. 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
(5)该工艺最大亮点是它符合下列原理 。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
4.往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],
反应的化学方程式 。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
[Mg(OH)2-xClx·mH2O]==(1-)Mg(OH)2+MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
(4)已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g); △H1=+81.5kJ·mol-1
Al(OH)3(s)=Al2O3(s)+H2O(g); △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:A、卤系,如四溴乙烷;B、磷系,如磷酸三苯酯;C、无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
5. 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
物质 Fe(OH)3 Fe(OH)2 Mn(OH)2
开始沉淀pH 2.7 7.6 8.3
完全沉淀pH 3.7 9.6 9.8
物质 MnS CuS PbS
Ksp 2.5×10-13 6.3×10-36 8.0×10-28
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2+SO2===MnSO4 2Fe3++SO2+2H2O====2Fe2++SO42—+4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填写工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为____________,这样设计的目的和原理是_______________________________________________________。
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
6. 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3 +7KCl+12H2O,
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
(2)操作③的目的是什么,用简要的文字说明: 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
7.工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
(1)原料A的名称是__________,步骤①反应的离子方程式是_______________________。
(2)滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:___________________________________________。
(3)步骤③的化学方程式是:___________________________________________。
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响_______________________________________________________________________。
8.在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
请回答下列问题:
(1)镉在元素周期表中第 周期,第 族。
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属的名称是 ,如何处理“溶液1”? 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
9.为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的
稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱
性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如下:
(1)碘的原子序数为 。
(2)碘、氯酸钾和水混合后的反应为:I2+KClO3+H2OKH(IO3)2+KCl+Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
。
(3)混合反应后,用稀酸酸化的作用是 ,在稀盐酸和稀硝酸中不能选用的酸是 ,理由是
(4)X的化学式为 写出用试剂X调节pH的化学方程式
(5)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么影响?
。
10.某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:
。
11.科学家从化肥厂生产的(NH4)2SO4中检验出组成为N2H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N2H4+两种形式存在,植物的根系极易吸收N4H4+
,但它遇到碱时,会生成一种形似白磷的N4分子,N4不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)与草木灰混合使用。
(3)已知白磷、NH4+、N4H4+的空间构形均为四面体,NH4+的结构为:
(→表示共用电子对有N原子单方面提供),白磷(P4)的结构为
请画出N4H4+的结构式:
(4)已知液氨中存在着平衡:2NH3NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)
和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”在此溶液中加入少
量的强酸或者强碱时,溶液的 pH几乎不变,这可由下列离子方程式来说明。
加酸时:NH3·H2O+H+=NH4++H2O
加碱时:NH4++OH-= NH3·H2O
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c(H+)与c(OH-)基本保持不变; 含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或者强碱时发生的离子反应方程式:
加酸时: ;
加碱时: 。
12.生产重铬酸钠的专业厂是用铬铁矿(主要成分是Cr2O3.FeO,还有一定量的Al2O3等)为原料的,其生产过程如下:
(1)Cr元素所在周期表中的位置
(2)在特制熔炉中将铬铁矿和过量纯碱混合,在1100℃左右通空气进行氧化:Cr2O3发生反应的化学方程式:
___Cr2O3 + Na2CO3 + O2 == Na2CrO4 + CO2↑
Al2O3发生反应的化学方程式: 。
(3)经上述过程后的反应料(称熟料),冷却后用水浸取,其中可溶性的物质主要有 ,不溶性杂质经过滤后除去。
(4)为了除去滤液中的铝元素,用稀硫酸将溶液中和至PH为7~8,其反应的离子方程式为 。
(5)除去铝元素后的滤液,再用稀硫酸调到PH为2~3,这时可得Na2Cr2O7溶液,其反应方程式为:
Na2CrO4 + H2SO4 —— + +
(6)请简述在实验室中可通过哪些操作可除去溶液中所混有的硫酸钠晶体,从而得到较纯的重铬酸钠溶液。(已知硫酸钠的溶解度随温度的变化较大,而重铬酸钠变化较小。)
13.(Ⅰ)氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下:
依据上图完成下列填空:
(1)与电源正极相连的电极上所发生反应的化学方程式为___________________;与电源负极相连的电极附近,溶液的pH__________(选填“不变”“升高”“降低”)。
(2)工业食盐含Ca2+、Mg2+、Fe3+等杂质,精制过程中发生反应的离子方程式为 ______________________ 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 _____(选填a、b、c)。a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH;后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、_______________(填写操作名称)除去NaCl。
(6)由图示可知用离子交换膜法电解制碱工艺中___________产品可循环使用。
(7)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g 经分析,电解后溶液密度为1.37 g·cm-3,其中含有20g NaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1。
(Ⅱ) 在隔膜法电解食盐水(见下页图)过程中,与电源正极相联的电极上所发生反应为
与电源负极相连的电极附近溶液的pH___________(填:升高、下降或不变)。
若采用无隔膜电解冷的食盐水时,Cl2与 NaOH充分接触,
产物仅是NaClO和H2,相应的化学方程式为:
____________________________。
由隔膜法电解食盐水中离子交换膜的功能,进行大胆设
想,能否用电解饱和Na2SO4溶液的方法生产NaOH和
H2SO4 。若能,参照上图在方框内试画出装置
示意图。
14.制取纯净CuCl2·2H2O的生产过程是:
(1)用粗CuO(含少量铁)溶解在足量的稀盐酸里加热、过滤,得到CuCl2(含FeCl2)的溶液,经测定,溶液的PH植为3。
(2)对(1)的溶液按下列步骤进行提纯:
已知:①可做氧化剂的物质有(A)KMnO4 (B)K2Cr2O7 (C)H2O2 (D)NaClO
②Cu2+ 、Fe2+在PH值为4~5时不水解,而Fe3+却几乎全部水解。
试回答:
(1)加入的氧化剂X是(答编号): ;
加入X的作用是: ;
反应的离子方程式是: 。
(2)物质Y是 ;沉淀Z是 。加入Y能形成沉淀Z的原因是: 。
(3)分离出沉淀Z,并将溶液III蒸发欲获得晶体CuCl2·2H2O。采取什么措施才能顺利得到晶体CuCl2·2H2O?______________________ 。
15.辉钼矿(MoS2)是钼最重要的矿物。图26—1是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图26—2给出了各炉层的固体物料的摩尔百分组成。
已知:MoS2焙烧生成1molMoO3的反应热为△H1=-1011KJ/mol,MoO2氧化生成1molMoO3的反应热为△H2=-154KJ/mol。试回答:
(1)辉钼矿焙烧生成MoO3的反应中被氧化的元素是: ;指出辉钼矿焙烧生成的尾气对环境的一种危害: 。
(2)第6炉层存在的固体物质分别是: ;它们的物质的量之比是: 。
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是: 。
(4)图26—2表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的化学方程式: 。
(5)通过(3)和(4)你能解释为什么中间炉层(4~6)的炉温比上下炉层的炉温低吗?
________________________________________________________________。
突破2012年理综化学无机化工工艺流程图试题参考答案
1.(1) MnSO4 (2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;H2SO4 (3) Fe2O3、Al2O3、S (4)纯碱 、H2SO4(5)降温结晶 (6)1.03(或1)
2.(1)温度较低(2)2NaCl + 2H2O2NaOH + H2↑ + Cl2↑(3)Fe元素的化合价显+6价,易得电子(4)10 mol/L(5)AC(6)KNO3 KCl, KNO3可用于化肥,炸药等(合理就给分)
3.(1)CuO+2H+=Cu2++H2O,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+
(2)4Fe2++O2+4H+=4Fe3++2H2O (3)n3=n1+n2-2
(4)4OH- -4e-=2H2O+O2 (5)B
4.⑴2MgCl2+(2-X)Ca(OH) 2+2mH2O2[Mg(OH)2-XClx ·mH2O]+(2-X)CaCl2
⑵除去附着在Mg(OH)2表面的可溶性物质MgCl2 、CaCl2 等。⑶表面处理。
⑷①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。②Mg(OH)2 Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1 等质量的Mg(OH)2比Al(OH)3吸热多。
⑸C 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2和Al(OH)3无烟、无毒、腐蚀性小。
5.(1)小,工业制备硫酸。 (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀。
(4)使MnCO3沉淀完全。MnCO3沉淀量少,NH4HCO3与酸反应。(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)
6. ⑴Al2O3 + Na2CO32NaAlO2 +CO2↑;SiO2 +Na2CO3 Na2SiO3 + CO2↑
⑵由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2OHSiO3-+OH-,HSiO3-+H2OH2SiO3+OH-,AlO2-+H2OAl(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全。⑶2CrO42-+2H+ Cr2O72-+H2O ⑷①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去 ②94.08%
7.(1)盐酸(硫酸、硝酸);Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O
(2)NaOH ;H++OH-=H2O ;Fe3++3OH-=Fe(OH)3 ↓ ;Al3++4OH-=AlO2-+2H2O
(3)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
8.(1)5,ⅡB (2)Cd+2H+=Cd2++H2↑,Zn+2H+=Zn2++H2↑ (3)锌,回收炼锌
(4)阴、镉板 (5)Cd2++S2-=CdS↓
9.(1)53 (2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
(3)促进氯气从反应混合物中逸出;稀盐酸;盐酸还原已生成的碘酸氢钾。
(4)KOH;KH(IO3)2+KOH=2KIO3+H2O (5)反应产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾。
10.(1)硫 铜 Na2SO4 (2)ⅡB 三 (3)过滤
(4)MnO2+MS+2H2SO4==MnSO4+ MSO4+S↓+2H2O(5)Fe(OH)3、Al(OH)3
(6)MnSO4+ ZnSO4+2H2OMnO2+Zn+2H2SO4(7)新工艺不需要高温焙烧,大大节约了能源(燃料)(或旧工艺高温焙烧产生大气污染物SO2,新工艺不产生有害气体;或新工艺许多物质都可以循环利用)
11. (1)D (2)不能 (4)8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O
(5)HPO42-+H+=H2PO4- H2PO4-+OH-= HPO42-+H2O
12.(1) 第四周期第VIB族
(2) 2 Cr2O3 + 4 Na2CO3 + 3 O2 == 4 Na2CrO4 + 4 CO2↑
Al2O3 + Na2CO3 == 2NaAlO2 + CO2↑
(3)Na2CO3、Na2CrO4、NaAlO2
(4)AlO2- + H+ + H2O == Al(OH)3 CO32- + H+ == HCO3-
(5)2 Na2CrO4 + H2SO4 == Na2Cr2O7 + Na2SO4 + H2O (6)加热、浓缩、冷却、结晶、过滤
13.(Ⅰ)(1)2Cl—2e=Cl2 ↑ 升高
(2)Ca2++CO32-=CaCO3 ↓;Mg2++2OH-=Mg(OH)2↓ ;Fe3++3OH-=Fe(OH)3↓
(3)a、c (4)b 、c (5)蒸发 过滤 (6)NaCl (或淡盐水) (7)7.14
(Ⅱ)2Clˉ- 2eˉ== Cl2↑ 升高
NaCl +H2O NaClO + H2 ↑
或 2 NaCl + 2 H2OH2↑ + Cl2↑+ 2NaOH
Cl2 + 2NaOH ==== NaCl + NaClO + H2O
能;图如右。
14.(1)C;把Fe2+ 氧化成Fe3+;
2Fe2++H2O2+2H+=2Fe3++2H2O
(2)CuO或Cu(OH)2或CCO3;Fe(OH)3(若有Y也不扣分);CuO与H+反应,使溶液的PH值升高,促进了Fe3+的水解,当PH值为4~5时,Fe3+几乎完全水解生成Fe(OH)3。
(3)用HCl气体做保护气,防止CuCl2水解。
15.(1)Mo和S;形成酸雨(合理即得分)。 (2)MoS2、MoO3、MoO2;1:1:3。
(3)MoS2 (s)+ 3.5O2 (g)= MoO3(s) + 2SO2(g) △H1=-1011KJ/mol (4)MoS2 + 6MoO3 = 7MoO2 + 2SO2(不标条件不扣分) (5)由① MoS2 (s)+ 3.5O2 (g)= MoO3(s) + 2SO2(g) △H1=-1011KJ/mol和 ② MoO2(s)+ 0.5O2 (g)= MoO3(s) △H2=-154KJ/mol得反应③MoS2 (s)+ 6MoO3 (s)= 7MoO2 (s)+ 2SO2(g) △H3=△H1-7△H2=-1011KJ/mol-(-154KJ/mol)×7=+67KJ/mol,因为△H3>0,故反应③是吸热反应,因其发生在中间层,故炉温降低。
稀硫酸、闪锌矿粉、软锰矿粉
加热、浸取(I)
A
B(III)
加热(II)
电解(IV)
Na2SO4
过滤,回收S
过滤、灼热,回收Fe2O3、Al2O3
MnCO3、Zn2(OH)2CO3
回收MnO2、Zn
C
Na2CO3
石灰乳
精制卤水
→ 合成 → 水热处理 → 过滤 → 水洗 → 表面处理 → 过滤水洗 → 干燥
+
-
O2
H2
Na2SO4溶液
NaOH
H2SO4
阴离子交换膜
阳离子交换膜
同课章节目录
